Complicações
Os pacientes tratados em unidades de terapia intensiva podem apresentar síndrome pós-cuidados intensivos, um espectro de deficiência psiquiátrica, cognitiva e/ou física (por exemplo, fraqueza muscular, disfunção cognitiva, insônia, depressão, ansiedade, transtorno de estresse pós-traumático, delirium, encefalopatia) que afeta sobreviventes de doenças críticas e persiste após o paciente ter alta da unidade de terapia intensiva. O risco pode ser minimizado com tratamento medicamentoso, reabilitação física, apoio familiar e clínica de acompanhamento. Sintomas físicos, mentais ou cognitivos foram relatados com frequência em pacientes que sobreviveram 1 ano após uma internação em unidade de terapia intensiva.[964]
Um estado de hipercoagulabilidade é uma das características da doença, particularmente nos pacientes críticos, muitas vezes manifestando-se como tromboembolismo venoso e arterial. A coagulopatia na COVID-19 tem caráter pró-trombótico, com aumentos no dímero D, fibrina, produtos de degradação da fibrina e fibrinogênio.[965] Anticorpos antifosfolipídeos foram detectados em pacientes com doença grave e crítica; no entanto, atualmente não parece haver qualquer associação entre esse achado e os desfechos da doença (por exemplo, trombose, mortalidade).[966]
Epidemiologia: as incidências combinadas de tromboembolismo venoso, trombose venosa profunda e embolia pulmonar entre os pacientes hospitalizados foram de 14.7%, 11.2% e 7.8%, respectivamente. A prevalência foi significativamente maior nos pacientes admitidos a unidades de terapia intensiva, apesar de tromboprofilaxia. A prevalência do tromboembolismo arterial parece ser menor, a 3.9%; no entanto, as evidências são limitadas.[967] Os eventos tromboembólicos são raros nas crianças.[968] Os fatores de risco com mais evidências para predizer o tromboembolismo venoso são a idade avançada e os níveis elevados de dímero D.[969] Sexo masculino, obesidade, ventilação mecânica, internação em unidade de terapia intensiva, anormalidades parenquimatosas graves e leucócitos elevados foram também identificados como fatores de risco.[970] As incidências cumulativas de embolia pulmonar aguda e trombose venosa profunda entre pacientes recuperados após a alta hospitalar foram de 1.2% e 2.3%, respectivamente, muito menores em comparação com a incidência intra-hospitalar.[971] Os pacientes não hospitalizados também podem apresentar um risco aumentado de eventos tromboembólicos.[972]
Etiologia: a patogênese não é completamente compreendida. Tem-se a hipótese de que os trombos locais são formados devido a um processo inflamatório local, em vez dos êmbolos clássicos provenientes de outras partes do corpo.'[973][974] Os pacientes podem estar predispostos a tromboembolismo devido aos efeitos diretos da infecção, ou aos efeitos indiretos da infecção (por exemplo, resposta inflamatória grave, doença crítica, fatores de risco tradicionais).[975] Os eventos trombóticos podem ser devidos à tempestade de citocinas, lesão hipóxica, disfunção endotelial, hipercoagulabilidade e/ou aumento da atividade plaquetária.[976]
Diagnóstico: monitore os pacientes quanto a sinais ou sintomas sugestivos de tromboembolismo venoso ou arterial e proceda de acordo com os protocolos hospitalares para o diagnóstico. O nível de dímero D no momento da internação foi associado a um diagnóstico de tromboembolismo venoso durante a hospitalização; no entanto, não existem limiares ideais para orientar as medidas de profilaxia.[977] Avalie os pacientes hospitalizados que apresentem rápida deterioração da função pulmonar, cardíaca ou neurológica, ou perda súbita localizada de perfusão periférica por doença tromboembólica.
Manejo: trate os pacientes com um evento tromboembólico (ou com alta suspeita de doença tromboembólica se exames de imagem não forem possíveis) com anticoagulação terapêutica. Siga seus protocolos institucionais locais.
Monitoramento: os parâmetros hematológicos e de coagulação são comumente medidos em pacientes hospitalizados; no entanto, atualmente não há evidências suficientes para recomendar a favor ou contra o uso de tais dados para orientar as decisões de manejo. Os pacientes com níveis muito altos de dímero D têm maior risco de trombose e podem se beneficiar de um monitoramento ativo.[630][631]
Prognóstico: os pacientes com eventos tromboembólicos têm 1.93 vezes a chance de morrer em comparação com pacientes sem tromboembolismo venoso.[978]
Também consulte Coagulação intravascular disseminada abaixo.
As complicações cardiovasculares incluem arritmias, lesão miocárdica, síndrome coronariana aguda e insuficiência cardíaca.[979] Embora a infecção aguda tenha sido associada a um aumento de seis vezes nos diagnósticos cardiovasculares em geral, o risco começou a diminuir 5 semanas após a infecção e retornou aos níveis basais ou abaixo a partir de 12 semanas a 1 ano.[980]
Epidemiologia: complicações cardiovasculares foram relatadas em 14.1% dos pacientes durante a internação.[979] A incidência global combinada de infarto agudo do miocárdio, insuficiência cardíaca, arritmias, parada cardíaca e síndrome coronariana aguda foi de 21%, 14%, 16%, 3.45% e 1.3%, respectivamente.[981] Taxas mais altas de lesão miocárdica foram relatadas nos EUA (9% a 52%) em comparação com a China (7% a 28%).[982] Uma revisão Cochrane revelou que as complicações cardiovasculares mais comuns foram arritmias, insuficiência cardíaca e eventos oclusivos arteriais e venosos.[174] Mais raramente, foram relatados casos de miocardite fulminante, pericardite, tamponamento cardíaco, cor pulmonale e síndrome do takotsubo.[983] Os fatores de risco incluem idade avançada, hipertensão, doença cardiovascular subjacente e doença renal crônica.[982]
Etiologia: a COVID-19 está associada a uma alta carga inflamatória. A inflamação do miocárdio pode resultar em miocardite, insuficiência cardíaca, arritmias, síndrome coronariana aguda, rápida deterioração e morte súbita.[984][985]
Diagnóstico: realize um eletrocardiograma e solicite os níveis de troponina I (hs-cTnI) ou T (hs-cTnT) de alta sensibilidade e do fragmento N-terminal do peptídeo natriurético tipo B (NT-proPNB) nos pacientes com sintomas ou sinais que sugiram lesão miocárdica aguda para fazer um diagnóstico. Os seguintes resultados de testes podem ajudar a informar o diagnóstico: alterações evolutivas no ECG sugerindo isquemia miocárdica; nível de NT-proBNP >400 nanogramas/L; altos níveis de hs-cTnI ou hs-cTnT, particularmente níveis crescentes ao longo do tempo. Níveis elevados de troponina podem refletir uma resposta inflamatória cardíaca à doença grave, em vez de síndrome coronariana aguda. Procure orientação de um especialista em cardiologia acerca de exames e imagens adicionais.[405]
Manejo: busque orientação de um especialista em cardiologia sobre o tratamento e siga os protocolos de tratamento locais.[405] O tratamento das arritmias deve ser baseado nas diretrizes atuais para a respectiva arritmia.[986] Existem dados limitados para recomendar qualquer tratamento medicamentoso específico para esses pacientes. Envolva uma equipe multidisciplinar, incluindo especialistas em terapia intensiva, cardiologistas e especialistas em doenças infecciosas.[987]
Monitoramento: monitore a pressão arterial, a frequência cardíaca e o equilíbrio hídrico, e realize o monitoramento contínuo do ECG em todos os pacientes com lesão miocárdica aguda suspeitada ou confirmada. Monitore em um ambiente onde a deterioração cardíaca ou respiratória possa ser rapidamente identificada.[405] Os biomarcadores laboratoriais podem ajudar a identificar aqueles com maior risco de desenvolver complicações cardiovasculares. Biomarcadores cardíacos elevados e surgimento de arritmia estão associados ao desenvolvimento de doença grave e à necessidade de internação em terapia intensiva.[988]
Prognóstico: a lesão miocárdica está associada a desfechos e sobrevida desfavoráveis. Uma troponina elevada prediz um desfecho desfavorável e maior risco de mortalidade.[982] Uma taxa de letalidade global de 9.6% foi relatada.[979] A infecção pode ter implicações de longo prazo para a saúde cardiovascular geral.[989] Problemas cardiovasculares foram relatados até 1 ano após a infecção, inclusive naqueles que não foram hospitalizados pela infecção aguda.[990]
A lesão renal aguda é comum, principalmente nos pacientes críticos. Pode se desenvolver a qualquer momento antes, durante ou após a internação hospitalar.[405] O risco nos pacientes em estado crítico com COVID-19 parece ser menor em comparação a pacientes com gripe (influenza).[991]
Epidemiologia: a incidência conjunta de lesão renal aguda foi estimada em 19.45%; no entanto, a incidência varia entre os estudos. Os pacientes têm um risco significativamente aumentado de mortalidade intra-hospitalar (54.2%).[992] Os fatores de risco independentes incluíram sexo masculino, idade avançada, história de tabagismo, obesidade, hipertensão, diabetes, pneumopatia, doença cardiovascular, câncer, doença renal crônica, ventilação mecânica e uso de vasopressores.[993]
Etiologia: as causas incluem alterações hemodinâmicas, hipovolemia, infecção viral causando diretamente lesão tubular renal, processos vasculares trombóticos, patologia glomerular ou rabdomiólise. Ela pode estar associada a hematúria, proteinúria e níveis anormais de eletrólitos séricos (por exemplo, potássio, sódio).[405]
Diagnóstico: monitore os pacientes quanto a sinais ou sintomas sugestivos de lesão renal aguda e proceda de acordo com os protocolos hospitalares para diagnóstico.
Manejo: siga as diretrizes locais para o manejo da lesão renal aguda. São necessárias medidas de suporte e manejo hídrico.[992] Os aglutinantes de potássio podem ser usados como opções juntamente com o padrão de cuidados para o manejo de emergência da hipercalemia aguda com risco de vida.[405] A terapia renal substitutiva pode ser necessária.
Monitoramento: monitore os pacientes com doença renal crônica por pelo menos 2 anos após a lesão renal aguda.[405]
Sintomas prolongados são comuns após muitas infecções virais e bacterianas, incluindo a infecção por SARS-CoV-2.[994] As definições de caso variam, mas a Organização Mundial da Saúde (OMS) define a COVID longa como uma afecção que ocorre em adultos com história de infecção por SARS-CoV-2 provável ou confirmada, geralmente ocorrendo 3 meses após o início dos sintomas e durando pelo menos 2 meses, a qual não pode ser explicada por um diagnóstico alternativo.[995]
Os sintomas variam amplamente, podem recidivar e remitir ou flutuar, podem mudar de maneira imprevisível e podem ocorrer nas pessoas com doença leve apenas. Os sintomas de longa duração comuns podem incluir tosse persistente, febre baixa, dispneia, fadiga, dor/constrição torácica, palpitações, mialgia, artralgia, cefaleias, alterações na visão, perda auditiva, zumbido, faringite, perda de paladar/olfato, neuropatia periférica, tontura, tremores, alterações de humor, erupções cutâneas, queda de cabelos, disfunção sexual, sintomas gastrointestinais, dificuldades neurocognitivas, perturbação do sono, delirium (idosos) e problemas de saúde mental.[996][997][998] Os sintomas mais comuns no acompanhamento a 1 ano foram fadiga, sudorese, constrição torácica, ansiedade e mialgia.[999] Adapte as investigações ao quadro clínico, e para descartar complicações agudas ou com risco à vida e diagnósticos alternativos.
Há uma falta de evidências para as intervenções farmacológicas. Um plano de reabilitação multidisciplinar personalizado que cubra os aspectos físicos, psicológicos e psiquiátricos da reabilitação é uma parte importante do tratamento. Dê conselhos e informações sobre automanejo, incluindo formas de automanejo dos sintomas. O encaminhamento para um especialista pode ser necessário nos pacientes em que houver preocupação clínica.[997] A OMS faz várias recomendações para a reabilitação de adultos com síndrome pós-COVID-19.[444] Os pacientes devem ser rigorosamente monitorados durante o tratamento. O tempo de recuperação varia, mas os sintomas geralmente desaparecem em 12 semanas na maioria das pessoas.
Pode ocorrer miocardite ou pericardite após a vacinação com vacinas de RNAm.[1000] Foi postulado que as vacinas de RNAm podem aumentar a inflamação no endotélio e a infiltração de células T do músculo cardíaco, mas são necessárias pesquisas adicionais, pois foram feitas várias hipóteses para explicar os mecanismos.[1001][1002] Existe uma grande probabilidade de uma associação causal, com base em estudos de autópsias.[1003] Também foram relatados casos com vacinas de vetor adenovírus e vacinas de subunidade de proteínas, embora mais raramente.[1004][1005]
Epidemiologia: a incidência de miocardite pode chegar a 140 a 200 casos por milhão de doses, dependendo da idade, do sexo e da vacina. Os adolescentes e adultos jovens do sexo masculino estão em maior risco; a incidência é mais elevada nos homens com idades entre os 12 e os 29 anos. A miocardite é mais provável com a vacina da Moderna em comparação com a vacina da Pfizer/BioNTech, e há maior probabilidade após a segunda dose (os dados para taxas de incidência após uma terceira dose são limitados, embora o fabricante afirme que o perfil de risco é semelhante após a segunda e a terceiras doses). Em média, o início dos sintomas foi de 2 a 4 dias após a dose da vacina, embora tenham sido relatados intervalos de até 20 dias (ou mais). A incidência após a segunda dose pode ser menor quando administrada ≥31 dias após a primeira dose em comparação com ≤30 dias entre as faixas etárias mais jovens. Para a pericardite, os dados foram limitados, mas mais variação do que a miocardite foi relatada com relação a idade do paciente, sexo, tempo de início e taxa de internações hospitalares.[1002][1006] Dados preliminares do mundo real ainda não detectaram nenhum aumento do risco de miocardite em crianças de 5-11 anos de idade.[1007][1008] As taxas relatadas em pessoas imunocomprometidas foram semelhantes às da população em geral.[1009] Indivíduos vacinados tiveram duas vezes mais probabilidade de desenvolverem miocardite/pericardite na ausência de infecção por SARS-CoV-2 em comparação com indivíduos não vacinados dentro de um período de acompanhamento de 30 dias.[1010]
Diagnóstico: considerar o diagnóstico em crianças, adolescentes ou adultos com um novo episódio de dor torácica significativa e inexplicável, taquicardia ou taquipneia, dispneia, palpitações, tontura ou síncope, ou preocupação clínica geral, em até 10 dias após a vacinação (observação: os pacientes também podem se apresentar >10 dias após a vacinação).[1011] O sintoma de apresentação mais comum foi a dor torácica (34.5%).[1012]
Investigações: solicite um ECG de 12 derivações, marcadores inflamatórios sanguíneos, hemograma completo e troponina. Se o ECG ou a troponina estiverem anormais, discuta o plano de tratamento com a equipe de cardiologia. As investigações (por exemplo, imagem cardíaca e monitoramento do ritmo) e o acompanhamento adicionais devem ser conduzidos pela equipe de cardiologia.[1011] Os achados mais comuns foram alterações relacionadas ao segmento ST no eletrocardiograma (58.7%) e hipocinesia na ressonância nuclear magnética cardíaca ou ecocardiografia (50.7%). Os achados laboratoriais incluíram níveis elevados de troponina I (81.7%) e proteína C-reativa elevada (71.5%).[1012]
Manejo: a atividade física extenuante deve ser evitada até que os sintomas melhorem.[1011] Os pacientes devem ser encaminhados a um cardiologista, pois o tratamento depende do quadro clínico e a terapia orientada por diretrizes é necessária para casos complicados.[1013]
Prognóstico: até 93% dos adolescentes e adultos jovens necessitaram de internação hospitalar, sendo necessária internação em unidade de terapia intensiva em até 25% dos pacientes. O intervalo mediano desde o início até a aprovação para todas as atividades físicas foi de 98 dias. Aproximadamente 81% dos pacientes que preencheram uma pesquisa de acompanhamento com profissionais da saúde foram considerados recuperados no acompanhamento pelo menos 90 dias desde o início. No entanto, aproximadamente metade dos pacientes continuou a relatar sintomas (por exemplo, dor torácica) e 25% receberam prescrição de medicamentos cardíacos diários.[1014] A miocardite grave e potencialmente fatal foi relatada em 19.8% de todos os casos de miocardite relacionados a vacinas em um estudo nacional coreano, sendo que alguns pacientes necessitaram de internação em unidade de terapia intensiva, terapia de oxigenação por membrana extracorpórea e transplante cardíaco.[1015]
Consulte a autoridade de saúde pública local para obter orientação sobre a administração de doses adicionais de uma vacina contra a COVID-19. Alguns países implementaram restrições de prescrição relacionadas à idade para vacinas de RNAm devido ao risco de miocardite/pericardite. A modificação dos programas de vacinas de RNAm para incorporar considerações para os produtos com base na idade e nos intervalos entre doses mais longos pode reduzir o risco de miocardite/pericardite.[1016]
A lesão hepática pode estar associada a doença hepática preexistente, infecção viral, toxicidade medicamentosa, inflamação sistêmica, hipóxia ou problemas hemodinâmicos; no entanto, o mecanismo subjacente não está claro. A prevalência global foi relatada como sendo de 25%, embora não haja uma definição uniforme de lesão hepática nesses pacientes e a prevalência dependa da definição usada nos estudos. A prevalência geral pode ser tão baixa quanto 9% quando critérios diagnósticos rigorosos são usados. As prevalências de elevação da alanina aminotransferase e da aspartato aminotransferase foram de 19% e 22%, respectivamente. A prevalência de hipertransaminasemia foi maior nos pacientes com doença grave em comparação com os pacientes com doença não grave.[1017] Testes da função hepática anormais estão associados a mortalidade, internação em unidade de terapia intensiva e necessidade de ventilação mecânica significativamente maiores.[1018] Outra metanálise concluiu que os achados das evidências disponíveis até o momento de estudos observacionais e relatos de casos indicam que os níveis de transaminases e de bilirrubina total parecem não mudar significativamente nos pacientes com COVID-19.[1019]
Os fatores de risco associados à lesão hepática grave incluem idade avançada, doença hepática preexistente e doença grave.[1020] Os medicamentos utilizados no tratamento da COVID-19 (por exemplo, remdesivir, tocilizumabe) podem ter um efeito prejudicial sobre a lesão hepática.[1021] Foram publicadas diretrizes sobre o manejo da disfunção hepática em pacientes com COVID-19.[1022]
As complicações neurológicas incluem doença cerebrovascular aguda, comprometimento da consciência, ataxia, convulsões, estado de mal epiléptico, encefalopatia, encefalite e meningoencefalite, encefalomielite disseminada aguda, sinais do trato corticoespinhal, lesões desmielinizantes, neuropatias periféricas, parkinsonismo, trombose venosa cerebral, miopatia, síndrome de Guillain-Barré, demência e achados anormais à ressonância nuclear magnética cerebral.[1023][1024][1025] A síndrome da boca ardente e a síndrome dos olhos ardentes foram relatadas.[1026]
Os pacientes geralmente apresentam complicações neurológicas centrais ou periféricas, possivelmente devido à invasão viral do sistema nervoso central, à resposta inflamatória ou à desregulação imunológica.[1027] Complicações neurológicas ocorrem ao longo da vida no contexto de infecção, com e sem comorbidades conhecidas, e com todas as gravidades da doença (incluindo pacientes assintomáticos).[1028] Os pacientes podem apresentar essas manifestações ou desenvolvê-las durante a evolução da doença. (geralmente 1 a 2 semanas após o início da doença respiratória).[1029] Os pacientes com distúrbios neurológicos preexistentes podem desenvolver uma exacerbação de seus sintomas neurológicos.[1030] Sequelas em longo prazo podem ser possíveis.[1031][1032]
Epidemiologia: relatado em 22% a 35% dos pacientes. As manifestações do sistema nervoso central foram mais comuns que as do sistema nervoso periférico.[1023] O envolvimento neurológico é comum em crianças e adolescentes (22% em pacientes com idade <21 anos).[1033]
Doença cerebrovascular aguda: (incluindo AVC isquêmico, AVC hemorrágico, trombose venosa cerebral e ataque isquêmico transitório) foi relatada em 0.5% a 5.9% dos pacientes. O tipo mais comum foi o AVC isquêmico (0.4% a 4.9%).[1027] No entanto, a incidência absoluta geral de AVC em pacientes hospitalizados foi relatada como 0.175%, inferior à relatada em estudos observacionais anteriores.[1034] Os pacientes com doença grave apresentam aumento do risco de AVC isquêmico em comparação com pacientes com doença não grave.[1035] O AVC é relativamente frequente nos pacientes hospitalizados em relação a outras infecções respiratórias virais, e apresenta alto risco de mortalidade intra-hospitalar. Os fatores de risco incluem a idade avançada e o sexo masculino. O tempo mediano desde o início dos sintomas da COVID-19 até o AVC foi de 8 dias.[1036][1037] O AVC se apresenta posteriormente na doença grave, e mais precocemente na doença leve a moderada.[1038] Os pacientes podem apresentar AVC isquêmico durante a fase de convalescença da infecção, incluindo pessoas mais jovens <50 anos de idade com COVID-19 assintomática ou pauci-sintomática.[1039] O AVC isquêmico parece ser mais grave e resultar em piores desfechos (incapacidade grave) nos pacientes com COVID-19, com um escore mediano na NIH Stroke Scale maior entre aqueles com COVID-19 em comparação com aqueles sem.[1040] Diretrizes para o tratamento de AVC isquêmico agudo em pacientes com infecção por COVID-19 foram publicadas.[1041]
Síndrome de Guillain-Barré: padrões pós-infecciosos e pré-infecciosos foram relatados.[1027] A prevalência combinada entre pacientes hospitalizados e não hospitalizados foi de 0.15%.[1042] A idade média dos pacientes foi de 55 anos com predomínio do sexo masculino. A maioria dos pacientes apresentou sintomas respiratórios e/ou graves de COVID-19, embora também ela tenha sido relatada em pacientes assintomáticos. Foi relatada uma prevalência mais alta da forma motora e sensorial clássica e da polineuropatia desmielinizante inflamatória aguda, embora variantes raras também tenham sido observadas.[1043] Os pacientes tiveram uma chance aumentada de subtipos desmielinizantes. Os desfechos clínicos foram comparáveis aos de controles contemporâneos ou históricos não infectados com SARS-CoV-2.[1042] A síndrome de Guillain-Barré também foi associada à administração de vacinas contra a COVID-19.[1044]
Encefalite: foi relatada em <1% dos pacientes em geral, mas aumenta até 6.7% nos pacientes gravemente enfermos. A encefalite está associada a desfechos mais desfavoráveis, incluindo internação em unidade de terapia intensiva, necessidade de ventilação mecânica e aumento da taxa de mortalidade (13.4%) em comparação com a população geral de pacientes com COVID-19.[1045] Raros casos de encefalite autoimune foram relatados.[1046]
A chave para o manejo das complicações neurológicas é uma história e exame detalhados, juntamente com a interpretação adequada dos dados laboratoriais e radiológicos. Na maioria dos casos, o manejo destas condições deve seguir as orientações pré-COVID-19.[1047]
A parada cardíaca intra-hospitalar é comum nos pacientes criticamente enfermos, e está associada a baixa sobrevida, particularmente entre os pacientes idosos. Entre 5019 pacientes criticamente enfermos com COVID-19, 14% tiveram uma parada cardíaca intra-hospitalar. Os fatores de risco incluíram idade avançada, sexo masculino, presença de comorbidades e internação em um hospital com um menor número de leitos na unidade de terapia intensiva. Aproximadamente 57% dos pacientes receberam ressuscitação cardiopulmonar. Os ritmos mais comuns no momento da ressuscitação foram atividade elétrica sem pulso (49.8%) e assistolia (23.8%). Daqueles que receberam reanimação, 12% sobreviveram até a alta hospitalar, com a maioria desses pacientes tendo menos de 45 anos de idade.[1048]
[Figure caption and citation for the preceding image starts]: Parada cardíaca com COVID-19BMJ. 2020;371:m3513 [Citation ends].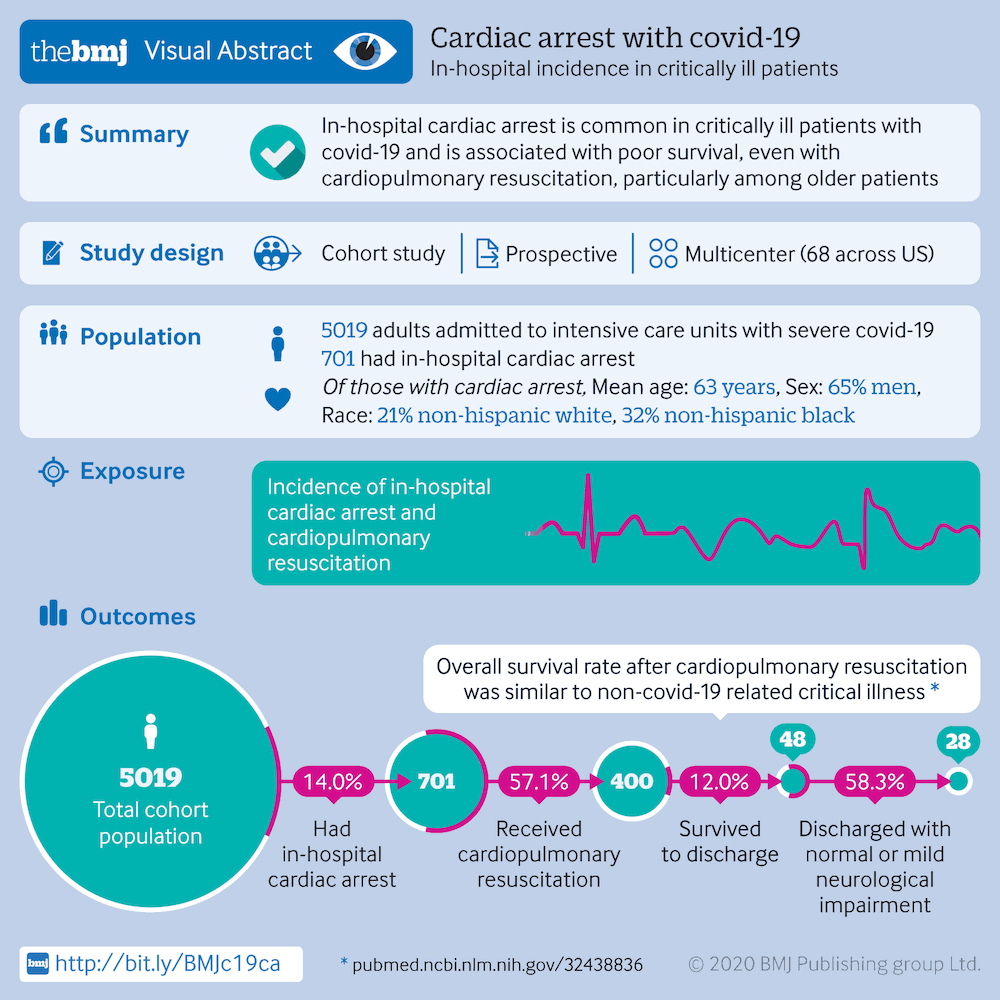
O desfecho da gestação geralmente é bom, embora existam poucos dados sobre a exposição durante o início da gravidez.[220] O risco de complicações foi maior nas gestantes que estavam sintomáticas.[1049] O risco de complicações maternas e neonatais parece ser substancialmente menor durante o período dominante da Ômicron em comparação com o período pré-Ômicron.[1050] Os países de baixa renda relataram taxas mais altas de internação em unidades de terapia intensiva e mortalidade maternas, e natimortos, em comparação com os países de renda mais alta.[1051]
Desfechos maternos:as chances de internação em unidade de terapia intensiva, ventilação invasiva e necessidade de oxigenação por membrana extracorpórea foram maiores em gestantes e gestantes recentes em comparação com mulheres não gestantes em idade reprodutiva. As gestantes também podem ter um aumento do risco de morte materna. Os fatores de risco para complicações graves incluem comorbidades preexistentes (por exemplo, hipertensão crônica, diabetes), alta idade materna, etnia não branca, presença de condições específicas da gravidez (por exemplo, diabetes gestacional, pré-eclâmpsia) e alto índice de massa corporal.[218][219][1052] Um maior risco estatisticamente significativo de diabetes gestacional, hipertensão gestacional, baixo crescimento fetal e pré-eclâmpsia foi relatado em gestantes durante o período de pandemia em comparação com o período pré-pandêmico.[1053]
Aborto espontâneo:não há evidências de que a infecção no primeiro ou segundo trimestres aumente o risco de aborto espontâneo. No entanto, são necessárias pesquisas adicionais.[1054]
Nascimento pré-termo: o nascimento pré-termo foi mais comum nas gestantes com COVID-19 em comparação com gestantes sem a doença. No entanto, as taxas globais de nascimentos pré-termo espontâneos em gestantes com COVID-19 foram amplamente semelhantes àquelas observadas no período pré-pandemia, de modo que esses nascimentos pré-termo podem ter sido clinicamente indicados.[218][219][1052]
Natimortos e morte neonatal: as taxas globais de natimortos e mortes neonatais não parecem ser mais altas que as taxas históricas.[218][219][1055][1056] No entanto, os dados são conflitantes. Na Inglaterra, não houve evidências de um aumento de natimortos em nível regional ou nacional durante a pandemia quando comparado com os mesmos meses do ano anterior e apesar de taxas variáveis de infecção comunitária em diferentes regiões.[1057] No entanto, nos EUA, as mulheres com COVID-19 apresentaram um aumento do risco de natimortalidade em comparação com as mulheres sem COVID-19 durante o período de março de 2020 a setembro de 2021, com a magnitude da associação sendo maior durante a predominância da variante Delta.[1058] Um estudo de registros escandinavos também encontrou um aumento do risco de natimorto após 22 semanas de gestação, particularmente em mulheres infectadas com a variante Delta.[1059] Uma metanálise de dados de participantes individuais não encontrou nenhuma ligação entre infecção durante a gravidez com risco aumentado de natimorto a partir de 28 semanas de gestação ou com restrição do crescimento intrauterino.[1060] Outra metanálise constatou um aumento do risco de natimorto.[1061]
Infecção neonatal: evidências limitadas de baixa qualidade sugerem que o risco de infecção nos neonatos é extremamente baixo. A maioria das infecções é adquirida no período pós-parto, embora a infecção adquirida de maneira congênita tenha sido relatada. Ao contrário das crianças que geralmente têm infecção assintomática, dois terços dos casos neonatais são sintomáticos e uma proporção significativa requer cuidados intensivos, embora o prognóstico geral pareça ser excelente.[218][219][1052][1062][1063]
Desfechos neonatais: há evidências limitadas e conflitantes de um risco aumentado de morbidade neonatal em curto ou longo prazos (por exemplo, doença respiratória), e mais pesquisas são necessárias.[1056] Há algumas evidências de que a infecção materna e a transmissão perinatal têm o potencial de afetar o sistema auditivo do neonato, especialmente durante o segundo e terceiro trimestres de gestação. No entanto, os dados são limitados e inconsistentes, e pesquisas adicionais são necessárias.[1064] Um estudo nórdico baseado em registros revelou que a infecção durante o primeiro trimestre não esteve associada a um risco de anomalias congênitas importantes entre bebês.[1065]
Sepse (diagnosticada de acordo com o Sepse-3 ou de acordo com a presença de disfunção orgânica relacionada à infecção com necessidade de suporte/substituição orgânicos) foi relatada em 78% dos pacientes da unidade de terapia intensiva e 33% dos pacientes hospitalizados.[1066]
As diretrizes para o manejo do choque em pacientes em estado crítico com COVID-19 recomendam uma estratégia conservadora para os fluidos e um agente vasoativo. A noradrenalina é o agente de primeira linha de escolha nos adultos (a adrenalina ou a noradrenalina podem ser usadas nas crianças). A vasopressina ou a adrenalina podem ser adicionadas à noradrenalina nos adultos se a pressão arterial média alvo não puder ser alcançada com a noradrenalina somente.[710] Consulte as diretrizes locais para obter mais informações.
A coagulação intravascular disseminada (CIVD) é uma manifestação de falha na coagulação e um elo intermediário no desenvolvimento da insuficiência de múltiplos órgãos. Os pacientes podem apresentar alto risco de sangramento/hemorragia ou tromboembolismo venoso.[1067] A incidência combinada de CIVD é de 3% e está associada a um prognóstico desfavorável. A incidência foi maior nos pacientes com doença grave e naqueles internados em unidades de terapia intensiva, e nos não sobreviventes em comparação com os sobreviventes.[1068] A coagulopatia associada à COVID-19 parece ser distinta da CIVD, embora a CIVD tenha sido relatada em pacientes gravemente afetados. As alterações de coagulação em pacientes com COVID-19 mimetizam a, mas não são idênticas à, CIVD, e a grande maioria dos pacientes não atende aos critérios para as formas usuais de CIVD.[1069]
A coagulopatia se manifesta pela elevação do fibrinogênio, elevação do dímero D e alteração mínima no tempo de protrombina, tempo de tromboplastina parcial e contagem plaquetária nos estágios iniciais da infecção. O aumento dos níveis de interleucina (IL)-6 está correlacionado ao aumento dos níveis de fibrinogênio. A coagulopatia parece estar relacionada com a gravidade da doença e com a tromboinflamação resultante. Monitore o nível do dímero D de maneira estrita.[1070]
A terapia anticoagulante com heparina de baixo peso molecular ou heparina não fracionada tem sido associada a um melhor prognóstico em pacientes com COVID-19 grave que apresentam escore de coagulopatia induzida por sepse (CIS) ≥4 ou um nível de dímero D acentuadamente elevado.[1071] Nox pacientes com trombocitopenia induzida por heparina (ou uma história dela), recomenda-se argatrobana ou bivalirudina.[1067]
As orientações padrão para o tratamento das manifestações hemorrágicas associadas à CIVD ou à coagulopatia séptica devem ser seguidas se ocorrer sangramento; no entanto, manifestações hemorrágicas sem outros fatores associados são raras.[1070][1072]
A principal causa de morte é a insuficiência respiratória causada por síndrome do desconforto respiratório agudo.[882] A prevalência geral combinada da síndrome do desconforto respiratório agudo induzida pela COVID-19 foi de 32% globalmente.[1073] As crianças podem evoluir para insuficiência respiratória rapidamente.[1074] Os pacientes com COVID-19 podem ter um risco maior de evolução para pneumonia associada a ventilação mecânica em comparação com pacientes sem COVID-19. No geral, a pneumonia associada à ventilação mecânica foi relatada em 48.2% dos pacientes ventilados mecanicamente e a taxa de mortalidade foi de 51.4%.[1075]
O escape aéreo (pneumotórax, pneumomediastino e enfisema subcutâneo) está associado a maior mortalidade e maior tempo de internação, principalmente em idosos, podendo ocorrer mesmo sem ventilação por pressão positiva. Ele é principalmente devido à progressão da doença resultando em insulto inflamatório ao parênquima pulmonar e dano alveolar induzido por estresse ventilatório. A incidência varia amplamente entre os estudos e aumenta com a gravidade da doença. A média de idade dos pacientes foi de 58 anos e 75% eram do sexo masculino. A hipertensão foi a comorbidade mais comum, seguida do diabetes. O pneumotórax isolado foi o tipo mais comum de escape aéreo (48.5%), com 17% dos pacientes desenvolvendo pneumotórax espontâneo. A mortalidade foi de 40%. Pesquisas adicionais são necessárias.[1076]
Alguns pacientes com doença grave apresentam evidências laboratoriais de uma resposta inflamatória desregulada semelhante à síndrome de liberação de citocinas, caracterizada por extravasamento de plasma, aumento da permeabilidade vascular, coagulação intravascular difusa e imunodeficiência. Esses pacientes têm um prognóstico desfavorável. Níveis séricos elevados de citocinas pró-inflamatórias, particularmente interleucina (IL)-6, foram identificados nesses pacientes. Podem estar presentes características de linfo-histiocitose hemofagocítica secundária. As opções de tratamento incluem inibidores da IL-6 (por exemplo, tocilizumabe), inibidores da Janus quinase (JAK; por exemplo, baricitinibe) e anakinra.[1077]
Veja também Síndrome multissistêmica inflamatória pediátrica, uma doença semelhante à síndrome de liberação de citocinas em crianças, abaixo.
Também conhecida como síndrome multissistêmica inflamatória pediátrica (SIM-P), síndrome multissistêmica inflamatória pediátrica temporariamente associada ao SARS-CoV-2 (SIM-TS), bem como outras variações. Há também relatos de síndrome inflamatória multissistêmica em adultos (SIM-A), embora mais raros.[1078]
Definição: uma complicação tardia rara, mas grave, que pode se desenvolver em crianças e adolescentes aproximadamente 3 a 4 semanas (ou mais) após o início da infecção aguda, provavelmente devido a um processo inflamatório pós-infeccioso. A síndrome se assemelha, mas é distinta da doença de Kawasaki, e também compartilha características comuns com a síndrome do choque tóxico. Ela tem uma forte associação temporal com a infecção por SARS-CoV-2.[1079] A definição de caso geralmente inclui a presença de febre, marcadores inflamatórios elevados, disfunção de múltiplos órgãos, história de teste positivo para SARS-CoV-2 (ou contato próximo com um caso confirmado) e nenhum diagnóstico alternativo plausível. No entanto, as definições de caso variam.[438][1080] Três subtipos fenotípicos distintos foram observados.[1081] Pode ocorrer raramente após uma vacinação contra COVID-19.[1082][1083]
Epidemiologia: o risco de SIM-C até 2 meses após a infecção confirmada foi de 0.05% em um estudo de coorte dinamarquês.[1084] O risco diminuiu no segundo ano da pandemia e com a evolução das variantes do SARS-CoV-2.[1085] A SIM-C continuou a ocorrer em 2023, mas a taxas baixas em comparação com o início da pandemia.[1086] Uma revisão sistemática constatou que a idade mediana dos pacientes foi de 7.8 anos, e 60% dos pacientes foram do sexo masculino. A obesidade foi a comorbidade mais comum, seguida por doenças respiratórias, prematuridade e asma.[1087] Os fatores de risco para o desenvolvimento de SIM-C incluem sexo masculino, idade de 5 a 11 anos, pais nascidos no exterior, asma, obesidade e doenças que limitem a vida.[1088] Os fatores associados a desfechos mais graves incluíram idade >5 anos; etnia negra não hispânica; sintomas de dispneia ou dor abdominal; proteína C-reativa elevada, troponina, ferritina, dímero D, peptídeo natriurético do tipo B ou interleucina (IL)-6; e contagens reduzidas de linfócitos ou plaquetas.[1089] Casos foram raramente relatados em neonatos (temporalmente associados à exposição pré-natal), e pode haver um risco maior de mortalidade nos neonatos em comparação com crianças mais velhas.[1090] Parece haver um risco menor de SIM-C com a variante Ômicron.[1091]
Diagnóstico: os pacientes geralmente apresentam predominantemente disfunção cardíaca e sintomas gastrointestinais. As manifestações mais comuns foram febre (99%), sintomas gastrointestinais (77%) e sintomas dermatológicos (63%).[1087] A prevalência combinada de disfunção ventricular esquerda significativa foi de 38%, a de aneurisma ou dilatação coronariana foi de 20%, e a de anormalidades eletrocardiográficas/arritmias cardíacas foi de 28%.[1092] Os neonatos comumente apresentam comprometimento cardiorrespiratório.[1090] Aproximadamente 20% das crianças desenvolvem lesão renal aguda.[1093] Três tipos de manifestações clínicas foram reconhecidos: febre persistente e sintomas gastrointestinais (o tipo mais comum); choque com disfunção cardíaca; e sintomas coincidentes com os critérios diagnósticos para doença de Kawasaki.[1094] Os pacientes com SIM-C apresentaram mais frequentemente sintomas respiratórios e gastrointestinais, e choque, em comparação com pacientes com doença de Kawasaki; no entanto, eles tiveram uma menor incidência de conjuntivite.[1095] A doença pode ser menos grave após a infecção com a variante Ômicron em comparação com as variantes Alfa e Delta.[1096]
Investigações: marcadores inflamatórios, de coagulação e cardíacos estavam elevados na maioria dos pacientes.[1087] Um aumento do nível de troponina sérica foi relatado em 33% dos pacientes, e um aumento do nível de peptídeo natriurético do tipo B (pró-BNP)/BNP foi relatado em 44% dos pacientes.[1092]
Manejo: o tratamento é principalmente de suporte, e envolve uma equipe multidisciplinar. Aproximadamente 53% dos pacientes necessitaram de internação em terapia intensiva.[1087] A escolha e a combinação ideais de terapias imunomoduladoras não foram estabelecidas de maneira definitiva. A Organização Mundial da Saúde (OMS) recomenda corticosteroides além dos cuidados de suporte (em vez de imunoglobulina intravenosa associada a cuidados de suporte ou cuidados de suporte isolados) nas crianças hospitalizadas de 0 a 18 anos que atendam a definição de caso padrão. Ela também recomenda corticosteroides além dos cuidados de suporte para aqueles que atendam a uma definição de caso padrão para SIM-C e aos critérios de diagnóstico para doença de Kawasaki.[444] Nos EUA, a Infectious Diseases Society of America (IDSA) recomenda a terapia inicial com imunoglobulina intravenosa e/ou um corticosteroide. Anakinra, tocilizumabe ou infliximabe podem ser usados nos casos refratários.[401] As orientações também foram publicadas pelo American College of Rheumatology.[1097] Consulte as diretrizes locais para obter mais informações.
Prognóstico: a maioria dos pacientes apresentou bons desfechos, sem sequelas significativas de médio ou longo prazos no acompanhamento a 1 ano.[1098] O acompanhamento a 6 meses revelou que, embora os desfechos cardíacos, gastrointestinais, renais, hematológicos e otorrinolaringológicos tenham se resolvido amplamente a 6 meses, a fadiga muscular e a labilidade emocional foram comuns.[1099] A taxa de mortalidade foi de 3.9%.[1087]
Vacinação futura contra a COVID-19: há dados limitados sobre a segurança das vacinas contra a COVID-19 em pessoas que tiveram SIM-C ou SIM-A e que ainda não receberam a vacina. Qualquer história de SIM-C ou SIM-A pode ser uma precaução contra a vacinação. Consulte as diretrizes locais para obter mais informações.
A TTIV também é conhecida como trombose com síndrome de trombocitopenia (TST) e trombocitopenia imune protrombótica induzida por vacina (TIPIV). As vacinas de vetor adenovírus, a causa da TTIV, não estão mais disponíveis na maioria dos países.
Definição: distúrbio pró-trombótico de trombose com trombocitopenia concomitantes e desenvolvimento de anticorpos antifator plaquetário 4 (anti-FP4) ocorrendo após a vacinação com uma vacina contra COVID-19 baseada em vetor adenovírus. A trombose ocorre em sítios incomuns (por exemplo, trombose venosa cerebral, trombose de veia esplâncnica, trombose arterial) e pode ser multifocal. A síndrome se assemelha clinicamente à trombocitopenia induzida por heparina. A fisiopatologia exata permanece desconhecida, mas existem várias hipóteses. Ela pode ser rapidamente progressiva e fatal.[1100][1101] Casos também foram relatados com vacinas de RNAm, embora mais raramente.[1102][1103][1104]
Epidemiologia: dados observacionais do Reino Unido sugerem que o risco de um evento trombótico foi maior em pessoas com menos de 40 anos, em 16.1 e 36.3 por milhão de doses, respectivamente, para trombose venosa cerebral ou outro evento de trombose, com o maior risco elevado dentro de 4 a 13 dias após a vacinação.[1105] Nos EUA, o risco global com a vacina da Janssen foi estimado em 3.83 casos por milhão de pessoas que receberam a vacina, com a taxa de relatos mais alta entre mulheres de 30 a 39 anos (10.6 casos por milhão de doses) e de 40 a 49 anos (9.02 casos por milhão de doses), e uma taxa de letalidade de 15%.[1106] Foram relatados casos até 48 dias após a vacinação.[1107]
Diagnóstico: aconselhe os receptores de vacinas de vetor adenovírus que apresentarem quaisquer sintomas graves de 4 a 20 dias (ou mais) após a vacinação a procurarem atendimento médico urgente.[1108] Aproximadamente metade dos pacientes apresenta trombose do seio venoso cerebral.[1109] A cefaleia é o sintoma manifesto mais comum, e pode preceder a TTIV em vários dias.[1110][1111] Os pacientes podem apresentar raramente um AVC isquêmico.[1112][1113] Relate todos os casos às autoridades de saúde locais e por meio dos sistemas locais de relatórios de eventos adversos por vacinas.
Investigações: solicite um hemograma completo (com plaquetas), coagulograma (incluindo fibrinogênio e dímero D), esfregaço de sangue periférico e ensaio de imunoadsorção enzimática do fator plaquetário 4 para qualquer paciente com trombose aguda ou novo episódio de trombocitopenia em até 42 dias após o recebimento de uma vacinação contra a COVID-19. As características laboratoriais típicas incluem trombocitopenia, níveis elevados de dímero D acima do nível esperado para tromboembolismo venoso e fibrinogênio baixo ou normal. Anticorpos contra o fator plaquetário 4 também foram identificados. Solicite estudos de imagem no mesmo dia com base na localização dos sintomas para confirmar o sítio da trombose. A repetição dos exames de imagem pode ser necessária nos pacientes cujos exames de sangue sugiram TTIV provável, mas em quem nenhuma trombose tiver sido observada nos exames de imagem iniciais ou houver suspeita clínica ou laboratorial de progressão.[1114][1115][1116]
Diferencial: as outras causas possíveis de trombocitopenia com trombose incluem câncer, síndrome antifosfolipídica, trombocitopenia induzida por heparina, púrpura trombocitopênica trombótica e hemoglobinúria paroxística noturna. Considere diagnósticos alternativos nas pessoas cujos exames de sangue indicarem que é improvável que tenham TTIV.
Manejo: trate os pacientes prontamente. Consulte um hematologista ao tomar decisões sobre como iniciar ou adicionar tratamentos. As informações sobre o tratamento ideal para essa afecção são limitadas; no entanto, o tratamento é semelhante à trombocitopenia induzida por heparina. O tratamento de primeira linha é a administração urgente de imunoglobulina intravenosa. Uma segunda dose pode ser considerada se houver uma resposta inadequada após 2 a 3 dias. Alguns especialistas também recomendam o uso de corticosteroides, especialmente se o tratamento com imunoglobulina intravenosa for insuficiente. Anticoagule com uma terapia não baseada em heparina, como um anticoagulante oral direto, fondaparinux, danaparoide ou argatrobana, dependendo do quadro clínico, assim que o benefício superar o risco de sangramento. Revise a resposta à anticoagulação se a condição clínica do paciente se alterar, e ajuste o tratamento se necessário. Evite transfusões de plaquetas (salvo em situações de emergência), heparina (incluindo solução de lavagem com heparina), heparina de baixo peso molecular e antagonistas da vitamina K (por exemplo, varfarina). A heparina pode ser usada se anticoagulantes não heparinizados não estiverem disponíveis. Considere plasmaférese, reposição de fibrinogênio ou rituximabe em pacientes selecionados. Alguns pacientes podem necessitar de cirurgia para tratar a trombose.[1114][1115][1116][1117]
Prognóstico: relatou-se a mortalidade por complicações como sendo de 39%.[1110] Os níveis de fibrinogênio, a idade, a contagem plaquetária e a presença de hemorragia intracerebral ou trombose venosa cerebral estão significativamente associados a um aumento do risco de mortalidade.[1118] Consulte as diretrizes locais para aconselhamento sobre vacinação após um episódio de TTIV.
Eventos tromboembólicos distintos da TTIV podem ocorrer após a vacinação com qualquer vacina contra COVID-19, mas eles ocorrem mais comumente após a vacinação com vacinas de vetor adenovírus. A trombose venosa foi mais comum que a trombose arterial. A trombose venosa cerebral foi a manifestação mais comum em pacientes com trombose venosa, seguida pela trombose venosa profunda. O infarto do miocárdio foi comum nos pacientes com trombose arterial, seguido pelo AVC isquêmico.[1119] As vacinas com vetor adenovírus podem estar associadas a um aumento da incidência de embolia pulmonar e infarto do miocárdio na segunda semana após a vacinação.[1120]
A aspergilose associada à COVID-19 (CAPA) pode ocorrer em pessoas gravemente doentes. Ela é uma causa reconhecida da condição clínica de um paciente que não melhore apesar do tratamento.[405]
Epidemiologia: relatada em 10.2% dos pacientes internados na unidade de terapia intensiva em um estudo.[1121] Os fatores de risco incluem idade avançada, doença pulmonar crônica (incluindo DPOC preexistente), doença hepática crônica, neoplasias hematológicas, doença cerebrovascular, terapia renal substitutiva, ventilação mecânica, imunossupressão, uso de inibidores de interleucina (IL)-6 e uso de corticosteroides em altas doses.[405][1122][1123][1124]
Diagnóstico: considere o diagnóstico nos pacientes que se agravem apesar dos cuidados de suporte ideais ou que apresentem outras características radiológicas ou clínicas suspeitas.[405][1122] Não há sinais ou sintomas específicos. Baseie suas decisões em fatores de risco individuais e na condição clínica da pessoa e envolva uma equipe multidisciplinar (incluindo um especialista em doenças infecciosas).[405] Frequentemente se manifesta como pneumonia por COVID-19 sem as anormalidades comuns à tomografia computadorizada da aspergilose pulmonar.[1125] Consulte os protocolos locais sobre o diagnóstico da CAPA.
Investigações: use uma variedade de testes para aumentar a probabilidade de um diagnóstico confiável; inclua lavagem broncoalveolar, se possível. Teste para resistência a antifúngicos se um isolado de Aspergillus for cultivado. Não solicite exames se houver baixa suspeita clínica.[405]
Manejo: a terapia antifúngica é recomendada. Use apenas terapia antifúngica se as investigações apoiarem um diagnóstico de CAPA ou houver suspeita de CAPA, mas os resultados das investigações ainda não estiverem disponíveis. Não há evidências suficientes para recomendar antifúngicos específicos. Discuta as opções de tratamento com uma equipe multidisciplinar (incluindo um especialista em doenças infecciosas). Interrompa o tratamento se os resultados das investigações não derem suporte ao diagnóstico.[405] Consulte seus protocolos locais sobre o manejo da CAPA.
Prognóstico: foi relatada uma taxa de mortalidade de aproximadamente 55%.[1121][1123]
A mucormicose (também conhecida como "fungo preto") tem sido relatada raramente, particularmente em países de baixa e média rendas, predominantemente na Índia.[1126] A mucormicose pulmonar associada à COVID-19 é diagnosticada simultaneamente com a COVID-19 confirmada virologicamente ou até 3 meses depois. As definições de caso para doença pulmonar comprovada, provável ou possível foram publicadas. A coinfecção com aspergilose é possível.[1127]
Epidemiologia: aproximadamente 88% dos casos foram relatados em países de baixa ou média rendas.[1128] Os casos na Índia aumentaram significativamente durante sua segunda onda no início de 2021.[1129] Casos foram relatados em outros países, incluindo os EUA.[1130] Os fatores de risco incluem sexo masculino, diabetes não controlado e imunossupressão (por exemplo, devida a terapia com corticosteroides).[1131][1132]
Diagnóstico: ter um baixo limiar de suspeição para o diagnóstico. É importante não ignorar os sinais e sintomas de alerta (por exemplo, congestão nasal; secreção nasal enegrecida/sanguinolenta; sinusite ou dor facial; dor de dente ou afrouxamento dos dentes; distúrbios da visão; hemoptise; escara necrótica na pele, palato ou cornetos nasais). Não hesite em solicitar as investigações apropriadas.[1133] O tempo mediano de intervalo entre o diagnóstico de COVID-19 e a evidência de mucormicose foi de 15 dias. A mucormicose rino-orbitária foi a mais comum (42%), seguida da mucormicose rinorbito-cerebral (24%) e da mucormicose pulmonar (10%).[1131] Casos de mucormicose em sítio atípico foram relatados, bem como casos em pacientes recuperados de COVID-19.[1134][1135] Não hesite em solicitar investigações agressivas conforme apropriadas para detectar a etiologia fúngica.[1133] A broncoscopia flexível e exames de imagem torácica são recomendados para permitir o diagnóstico precoce da mucormicose pulmonar.[1127]
Manejo: as estratégias de manejo incluem: controle da hiperglicemia, diabetes ou cetoacidose diabética; redução da dose de corticosteroides com o objetivo de descontinuar rapidamente; descontinuação de medicamentos imunomoduladores; desbridamento cirúrgico extenso para remoção de todo o material necrótico; terapia antifúngica (por exemplo, anfotericina B como terapia inicial, seguida de terapia de manutenção com posaconazol ou isavuconazol ou terapia de resgate) por 4 a 6 semanas; e cuidados de suporte e monitoramento apropriados. Os pacientes devem estar sob os cuidados de uma equipe multidisciplinar que inclua um especialista em doenças infecciosas, um intensivista, um neurologista, um dentista, um oftalmologista, um otorrinolaringologista e um cirurgião.[1127][1133]
Prevenção: a prevenção envolve o controle da hiperglicemia; monitorar o nível glicêmico nos pacientes com COVID-19 após a alta (sejam eles diabéticos ou não); e uso criterioso de corticosteroides, antibióticos e antifúngicos.[1133]
Complicações: casos raros de pseudoaneurisma da artéria pulmonar foram relatados com mucormicose pulmonar associada à COVID-19.[1136]
Prognóstico: a taxa de mortalidade geral relatada é de 39%.[1128] A mortalidade global na Índia (36.5%) foi menor que a dos casos relatados mundialmente (61.9%), provavelmente por causa da predominância da mucormicose rino-orbital na Índia.[1129] Os fatores de risco para aumento da mortalidade incluem idade avançada, comorbidades específicas, co-infecção por aspergillus e uso de tocilizumabe.[1128] Uma proporção significativa de sobreviventes teve morbidades que causam mudanças na vida (por exemplo, perda da visão).[1126] Os pacientes com mucormicose pulmonar e rino-órbito-cerebral e aqueles que recebem apenas tratamento clínico apresentam aumento do risco de mortalidade.[1137]
A incidência global da candidemia varia de 0.7% a 23.5%, com a maioria dos casos ocorrendo na unidade de terapia intensiva nos pacientes ventilados mecanicamente.[1138] Casos de candidemia devido a Candida auris, um novo patógeno multirresistente, foram relatados.[1139] As razões para o aumento da incidência nesta população são pouco compreendidas; no entanto, os pacientes estão expostos a múltiplos fatores de risco para candidemia, incluindo corticoterapia, terapia imunossupressora, antibióticos e longa permanência na unidade de terapia intensiva. Uma alta taxa de mortalidade foi relatada.[1140]
Lesões pancreáticas leves (definidas como níveis séricos elevados de amilase ou lipase) foram relatadas em 17% dos pacientes em uma série de casos.[1141] Não se sabe se este é um efeito viral direto ou devido à resposta imune prejudicial que ocorre em alguns pacientes. Os pacientes apresentaram um aumento do risco de pancreatite grave e pancreatite necrosante, e um tempo de internação mais longo.[1142] Pacientes com pancreatite aguda tiveram uma alta mortalidade combinada (18.5%) e desfechos clínicos significativamente piores.[1143] O sintoma de apresentação mais comum foi a dor abdominal.[1144] A história prévia de pancreatite não parece ser um fator de risco para inflamação pancreática nos pacientes com COVID-19.[1145] Não foi estabelecida uma relação causal entre infecção por SARS-CoV-2 e pancreatite aguda.[1146]
A trombocitopenia imune foi raramente relatada. A maioria dos casos ocorreu em pacientes com >50 anos de idade, sendo apenas 7% dos casos relatados em crianças. A maioria dos casos ocorreu em pacientes com COVID-19 moderada a grave; no entanto, 7% dos casos ocorreram em pacientes assintomáticos com COVID-19. Em 20% dos casos, o início ocorreu 3 semanas após o início dos sintomas de COVID-19, sendo a maioria dos casos relatados após a recuperação clínica. Sangramento grave com risco de vida foi incomum. O tratamento envolveu o uso de corticosteroides, imunoglobulina intravenosa e agonistas dos receptores de trombopoetina.[1147]
A tireoidite subaguda é uma doença tireoidiana de origem viral ou pós-viral. Evidências sugerem que a infecção por SARS-CoV-2 pode desencadear tireoidite subaguda, com base em relatos de casos e estudos de casos.[1148] Uma revisão de 21 casos revelou uma predominância do sexo feminino, sendo o número médio de dias entre o início da doença COVID-19 e o aparecimento dos sintomas de tireoidite subaguda de 25 dias. A infecção estava resolvida na maioria dos pacientes antes do início dos sintomas de tireoidite subaguda. Febre e dor cervical foram as queixas de apresentação mais comuns. Os sintomas desapareceram em todos os pacientes após o tratamento; no entanto, 5 pacientes relataram ter hipotireoidismo ao acompanhamento.[1149]
A COVID-19 pode também causar doença tireoidiana autoimune ou exacerbar uma doença tireoidiana subjacente em remissão. Casos de doença de Graves, tireoidite de Hashimoto e tireoidite pós-parto foram relatados.[1150]
Os pacientes gravemente enfermos podem desenvolver complicações gastrointestinais; no entanto, não se sabe ao certo se esta é uma manifestação da doença crítica em geral ou se é específica da COVID-19. Um estudo revelou que pacientes com COVID-19 tiveram maior probabilidade de desenvolver complicações gastrointestinais em comparação com aqueles sem COVID-19, especificamente a transaminite, o íleo paralítico grave e a isquemia mesentérica.[1151] Em pacientes com isquemia mesentérica aguda, a isquemia do intestino delgado foi o achado mais prevalente na tomografia computadorizada abdominal, seguida pela colite isquêmica. A isquemia mesentérica não oclusiva foi o padrão mais comum de envolvimento intestinal.[1152]
A trombose arterial/venosa macrovascular foi identificada em quase 50% dos pacientes com isquemia intestinal. A mortalidade geral em pacientes com COVID-19 com isquemia gastrointestinal e oclusão trombótica mesentérica radiologicamente evidente foi de 38.7% e 40%, retrospectivamente.[1153] Os pacientes com isquemia intestinal geralmente apresentam dor abdominal e vômitos. O tratamento inclui descompressão gástrica, fluidos, suporte hemodinâmico e cirurgia.[1154]
Os pacientes podem ter um aumento do risco de hemorragia digestiva em comparação com a população geral; no entanto, as evidências são limitadas. A taxa global de hemorragia digestiva foi relatada como de 2%.[1155] Os fatores de risco para hemorragia digestiva em pacientes com COVID-19 incluem história de hemorragia digestiva e uso de anticoagulante.[1156]
Eflúvio telógeno agudo, um tipo de queda de cabelos difusa, foi relatado em pacientes em recuperação da infecção. A idade mediana dos pacientes foi de 44 anos, e a maioria dos pacientes era do sexo feminino. A duração média do início dos sintomas de COVID-19 até o aparecimento do eflúvio telógeno foi de 74 dias. A maioria dos pacientes se recuperou; entretanto, uma minoria de pacientes apresentou queda de cabelos persistente. O estresse pode ser um fator contribuinte.[1157] Casos de alopecia areata inicial, bem como recorrências ou exacerbações, também foram relatados após a infecção.[1158]
Existem evidências de que os pacientes raramente apresentam sinais, sintomas e características radiológicas e laboratoriais indicativas de envolvimento do trato urinário inferior e do sistema genital masculino. Eles podem incluir desconforto, inchaço ou dor escrotais (orquite aguda, epididimite ou orquiepididimite); priapismo de baixo fluxo; comprometimento da espermatogênese (incluindo redução na contagem de espermatozoides, na concentração de espermatozoides, na motilidade espermática e na morfologia normal dos espermatozoides, redução no nível de testosterona circulante); hemorragia vesical; retenção urinária aguda; e agravamento de sintomas do trato urinário inferior existentes (incluindo exacerbação de hiperplasia prostática benigna). Os parâmetros do sêmen parecem voltar ao normal à medida que os pacientes se recuperam. São necessárias pesquisas adicionais.[1159][1160][1161][1162][1163][1164]
A parosmia (percepção errônea de um odor) é um sintoma de início tardio que pode se desenvolver aproximadamente 3 meses após a infecção. Ela pode ocorrer sem qualquer perda anterior aparente do olfato, ou pode seguir um curto período de recuperação da anosmia inicial. Não há tratamentos eficazes e baseados em evidências disponíveis; no entanto, o paciente deve receber dicas úteis sobre como viver com parosmia até a recuperação.[586]
O uso deste conteúdo está sujeito ao nosso aviso legal
