Etiología
Virologia
A síndrome respiratória aguda grave por coronavírus 2 (SARS-CoV-2) é um betacoronavírus antes desconhecido, que foi descoberto em amostras de lavagem broncoalveolar obtida nos núcleos de pacientes com pneumonia de causa desconhecida na cidade de Wuhan, província de Hubei, China, em dezembro de 2019.[26]
Os coronavírus constituem uma grande família de vírus de RNA envelopados, inclusive alguns que causam doenças em humanos (por exemplo, resfriado comum, síndrome respiratória aguda grave [SARS], síndrome respiratória do Oriente Médio [MERS]) e outros que circulam entre mamíferos e aves. Raramente, os coronavírus de animais podem se disseminar para humanos e, em seguida, se disseminam na população, como foi o caso da SARS e da MERS.
SARS-CoV-2 pertence ao subgênero Sarbecovirus da família Coronaviridae e é o sétimo coronavírus a infectar seres humanos. Descobriu-se que o vírus é similar aos coronavírus do tipo SARS de morcegos, mas é diferente do SARS-CoV e do MERS-CoV.[27][28]
Consulte a seção Classificação abaixo para obter informações sobre as variantes do SARS-CoV-2.
[Figure caption and citation for the preceding image starts]: Ilustração mostrando a morfologia ultraestrutural apresentada pela síndrome respiratória aguda grave por coronavírus 2 (SARS-CoV-2) quando observada por microscopia eletrônica.Centros de Controle e Prevenção de Doenças [Citation ends].
Origem do vírus
A maioria dos pacientes no estágio inicial desse surto relatou uma relação com o Mercado de peixe de Huanan no Sul da China , um mercado de animais vivos ou "úmido", o que sugere que o vírus tenha origem zoonótica.[29][30][31] Uma avaliação inicial da dinâmica de transmissão nos primeiros 425 casos confirmados constatou que 55% dos casos antes de 01 de janeiro de 2020 estiveram associados ao mercado; por outro lado, apenas 8.6% dos casos após essa data estiveram associados ao mercado. Isso sugere que a disseminação entre pessoas esteve ocorrendo entre contatos próximos desde meados de dezembro de 2019.[31] Outros estudos sugerem que o vírus pode ter surgido antes do que se pensava em outros países.[32][33]
Não se confirmou uma origem zoonótica. Alguns estudos sugeriram que o SARS-CoV-2 pode ser um vírus recombinante entre um coronavírus de morcego e um coronavírus de origem desconhecida, sugerindo-se que pangolins e martas sejam possíveis hospedeiros intermediários. No entanto, atualmente, não há evidências que demonstrem a possível via de transmissão de um morcego reservatório para o homem por meio de uma ou de várias espécies animais intermediárias.[34]
Uma avaliação independente das origens do SARS-CoV-2 concluiu que há lacunas de dados que impedem determinar com qualquer certeza como o vírus entrou na população humana inicialmente.[35]
Dinâmica da transmissão
A transmissão respiratória é o modo de transmissão dominante, com a proximidade e a ventilação sendo os principais determinantes do risco de transmissão.[36] As evidências disponíveis sugerem que a transmissão entre pessoas ocorre principalmente quando uma pessoa infectada está em contato próximo com outra pessoa. O vírus pode se disseminar da boca ou nariz de uma pessoa infectada a partir de pequenas partículas líquidas (variando em tamanho de gotículas maiores a aerossóis menores) quando a pessoa tosse, espirra, canta, respira pesadamente ou fala. O contato a curta distância pode resultar na inalação ou na inoculação do vírus pela boca, nariz ou olhos.[37]
A transmissão pelo ar pode ocorrer nos ambientes de assistência médica durante procedimentos que gerem aerossóis. Existem também alguns relatos de surtos que sugerem que a transmissão por aerossol é possível na comunidade sob certas condições; no entanto, esses relatos se referem a espaços fechados e lotados com ventilação insuficiente, onde a pessoa infectada pode ter respirado pesadamente (por exemplo, restaurantes, prática de coral, aulas de ginástica).[37][38] Uma investigação detalhada desses grupos sugere que a transmissão por gotículas e fômites também poderia explicar a transmissão nesses relatos.[37] Embora o ar próximo e distante dos pacientes estivesse frequentemente contaminado com o RNA do SARS-CoV-2, poucas dessas amostras continham vírus viáveis.[39] O risco de transmissão é muito menor ao ar livre em comparação com ambientes internos, com um número limitado de estudos estimando uma taxa de transmissão de <1%.[40][41] As evidências de que os tratamentos com nebulizador aumentam o risco de transmissão de coronavírus semelhantes ao SARS-CoV-2 são inconclusivas, e há evidências diretas mínimas sobre o risco de transmissão do SARS-CoV-2.[42]
A transmissão através de fômites (a partir do contato direto com fômites) pode ser possível, mas atualmente não há evidências conclusivas para este modo de transmissão. Nos poucos casos em que a transmissão através de fômites foi presumida, a transmissão respiratória não foi completamente descartada.[36] Enquanto a maioria dos estudos relata a identificação de vírus em superfícies inanimadas, faltam evidências que demonstrem a recuperação de vírus viável.[43] Os vírus replicantes têm maior probabilidade de serem identificados quando o limiar do ciclo da reação em cadeia da polimerase para amostras clínicas de indivíduos infectados é <30 (ou seja, alta carga viral).[44]
A transmissão fecal-oral (ou a transmissão respiratória através de fezes aerossolizadas) pode ser possível, mas há apenas evidências circunstanciais limitadas para embasar este modo de transmissão.[36]
A transmissão por meio de outros fluidos corporais (incluindo a transmissão sexual ou a transmissão hemogênica) não foi relatada.[36][45] Embora o vírus tenha sido detectado em fluidos corporais (por exemplo, sêmen, urina, líquido cefalorraquidiano, fluidos oculares), a presença de vírus ou de componentes virais não equivale a infectividade.[46] Existem dados limitados sobre o risco de transmissão de doadores de órgãos. No entanto, parece haver um baixo risco de transmissão com órgãos não pulmonares (ou seja, rim, fígado, coração) de doadores positivos para SARS-CoV-2, independentemente de o doador estar sintomático no momento da aquisição.[47]
A transmissão perinatal (vertical) ocorre de maneira rara, e a transmissão transplacentária já foi documentada. Há evidências limitadas sobre a extensão da transmissão vertical e o seu momento.[48] São necessários mais estudos de alta qualidade para se estabelecer se ocorre transmissão perinatal.[49] Fragmentos virais foram detectados no leite materno; no entanto, esse achado é incomum e, quando ocorre, foi associado a sintomas leves em bebês.[50]
A transmissão nosocomial foi relatada em 44% dos pacientes em uma revisão sistemática; no entanto, esta revisão foi limitada a séries de casos conduzidas no início do surto em Wuhan, antes da instituição das medidas de prevenção e controle de infecção apropriadas.[51] As infecções hospitalares foram responsáveis por aproximadamente 11.3% das infecções no Reino Unido entre fevereiro e agosto de 2020 (foram relatadas taxas de até 25%). As taxas foram notavelmente mais altas nos hospitais comunitários residenciais (61.9%) e nos hospitais de saúde mental (67.5%) em comparação com hospitais gerais e de assistência aguda (9.7%).[52][53] Estudos de profissionais da saúde expostos a casos índice (não na presença de procedimentos geradores de aerossóis) encontraram pouca ou nenhuma transmissão nosocomial quando foram usadas precauções contra contato e gotículas.[54] O risco para os profissionais da saúde que realizam ou auxiliam uma traqueostomia parece ser baixo.[55]
BMJ: visualising SARS-CoV-2 transmission routes and mitigations Abre em uma nova janela
Dinâmica da transmissão em relação aos sintomas
A transmissão será mais provável se os contatos forem expostos pouco antes ou depois do início dos sintomas no paciente índice.
Em um estudo, o risco de transmissão para contatos próximos se mostrou maior se a exposição ocorreu entre -2 e 3 dias após o início dos sintomas no paciente-índice. Entre os contatos que se infectaram, a infecção assintomática foi mais comum se eles foram expostos a um paciente-índice assintomático, o que sugere que a gravidade da doença no paciente-índice pode estar associada à apresentação clínica da doença.[56]
Em um estudo, a duração mediana da infectividade em pacientes com doença leve, em um cenário comunitário da vida real (variante pré-Ômicron) foi de, aproximadamente, 5 dias (de 3 a 7 dias). O início dos sintomas ocorreu, em média, 3 dias antes do pico de RNA viral e da carga viral infecciosa. Menos de 25% dos casos disseminaram vírus infeccioso antes do início dos sintomas. Dois terços dos casos ainda estavam infecciosos 5 dias após o início dos sintomas, e um terço ainda estava infeccioso após 7 dias.[57]
A transmissão posterior varia de acordo com o hospedeiro específico e os fatores de contato, e a natureza da exposição. Os fatores associados a maior transmissão incluem:[58]
Fatores ambientais: ambiente interno, ventilação deficiente, aglomeração, proximidade, instalações compartilhadas, temperatura ambiente fria, baixa umidade
Fatores do hospedeiro: infecção recente, carga viral alta, doença grave, idade, presença de comorbidades, imunocomprometimento
Fatores comportamentais: cantar/gritar, tossir/espirrar, abraçar/beijar, etiqueta de uso de máscara, higiene das mãos, duração do contato
Fatores virais: alterações no genoma viral ligadas a aumento da transmissibilidade.
Transmissão sintomática
A transmissão ocorre principalmente através de gotículas respiratórias ou aerossóis durante o contato próximo com um caso sintomático infectado. A transmissibilidade depende da quantidade de vírus viável que estiver sendo eliminado e expelido por uma pessoa, o tipo de contato, o ambiente e quais medidas de prevenção e controle de infecção estiverem em vigor.[37]
Transmissão pré-sintomática
A transmissão pode ocorrer durante o período de incubação antes do início dos sintomas.
Embora haja evidências de transmissão de pessoas pré-sintomáticas, há evidências limitadas sobre a frequência com que isso pode ocorrer e as taxas de transmissão estimadas são altamente variáveis.[59][60]
Apenas 7% das pessoas expostas a um caso índice pré-sintomático foram infectadas em uma revisão sistemática.[61] Após a inoculação experimental controlada com o vírus SARS-CoV-2, ocorreram apenas 7% das emissões do vírus no ar e no ambiente antes do primeiro sintoma relatado, o que sugere que a transmissão pré-sintomática é responsável por uma pequena fração das infecções.[62]
Pessoas sem sintomas podem ser pré-sintomáticas, ou podem permanecer persistentemente assintomáticas.
Transmissão assintomática
Foi relatada a transmissão de casos assintomáticos (casos confirmados por laboratório que nunca desenvolveram sintomas); no entanto, a maioria das evidências é baseada em dados iniciais da China e tem limitações (por exemplo, pequeno número de casos, casos que podem ter sido pré-sintomáticos).[63][64][65][66][67][68] Numerosos estudos não relataram evidências de transmissão assintomática de portadores do SARS-CoV-2, incluindo um grande estudo em quase 10 milhões de residentes em Wuhan.[69][70][71][72] Apenas 1% das pessoas expostas a um caso índice assintomático foram infectadas em uma revisão sistemática, sugerindo uma infecciosidade limitada.[61]
As evidências sobre as dinâmicas de transmissão associadas com a variante Ômicron são mistas, e alguns estudos sugerem que os casos sintomáticos tiveram maior probabilidade de transmitir a infecção, em comparação com os casos assintomáticos, e outros estudos não encontraram diferenças.[73]
Estimar a prevalência dos casos assintomáticos na população é difícil. Uma revisão sistemática e metanálise viva revelou que o intervalo interquartil para a proporção de casos persistentemente assintomáticos foi de 14% a 50% entre os estudos; no entanto, a heterogeneidade foi alta, de modo que o estudo não estimou uma proporção média de infecções assintomáticas em geral.[74] Uma metanálise de mais de 130,000 pessoas revelou que 21.7% permaneceram assintomáticos durante a evolução da infecção (após exclusão dos casos pré-sintomáticos). A análise de subgrupos mostrou que a taxa global de infecções assintomáticas foi maior nas gestantes (48.8%) e crianças (32.1%). Os estudos africanos relataram a maior taxa de infecção assintomática, enquanto os estudos asiáticos relataram a menor.[75] Estimou-se que a porcentagem combinada de infecções assintomáticas seja de 25.5% a 32.4% entre pacientes infectados com a variante Ômicron.[76]
Os profissionais da saúde podem desempenhar um papel na transmissão assintomática. Cerca de 7.6% dos profissionais da saúde que trabalharam em unidades hospitalares com pacientes infectados apresentaram resultados positivos para anticorpos contra SARS-CoV-2; no entanto, apenas 58% desses profissionais relataram sintomas prévios.[77]
Embora haja algumas evidências de que as crianças mais velhas apresentam taxas mais altas de doença assintomática do que bebês com <1 ano de idade, a maioria das crianças apresenta doença sintomática e não parecem ser disseminadoras silenciosas de infecção.[20]
Eventos de super-disseminação
Eventos de superdisseminação estão associados ao crescimento explosivo no início de um surto e à sustentação da transmissão nos estágios posteriores. Os exemplos incluem reuniões religiosas/em igrejas, reuniões familiares ou sociais, práticas de coral, atividades esportivas recreativas em ambientes fechados, boates, restaurantes, conferências de negócios e trabalho em call centers. A disseminação generalizada também foi relatada em unidades de cuidados de longa permanência, abrigos, prisões e instalações de processamento de carnes e aves, bem como a bordo de navios de cruzeiro.[78]
A transmissão limitada foi relatada em creches, escolas e universidades.[79][80] Há evidências de alta qualidade limitadas para quantificar a extensão da transmissão nas escolas ou para compará-la com a transmissão na comunidade. No entanto, as evidências sugerem uma menor taxa global de ataques da infecção em funcionários de escolas (1.18%) em comparação com os alunos (1.66%). Evidências sugerem que a taxa global de ataques da infecção e a taxa de positividade para SARS-CoV-2 em ambientes escolares são baixas.[81][82] Durante os períodos de baixa incidência de infecção na população local em escolas com intervenções não farmacêuticas, o risco para a equipe escolar não é geralmente maior que o da população geral e não é comparável a outras profissões de alto risco (por exemplo, profissionais de saúde). Os períodos de relatórios de estudos de alta incidência de infecção são limitados, mas mostram um risco maior para os funcionários de escolas nessas circunstâncias.[83] Em um estudo, a infecção em contatos próximos em escolas secundárias e faculdades na Inglaterra foi incomum (aproximadamente 2%).[84]
Alguns indivíduos são superconcentradores do vírus, mas os motivos subjacentes aos eventos de super-disseminação costumam ser mais complexos que apenas o excesso de eliminação de partículas virais e podem incluir uma variedade de fatores comportamentais, do hospedeiro e ambientais.[85]
Fatores de transmissão viral
Período de incubação
O período médio de incubação foi estimado entre 5 e 7 dias, e pode variar a depender da variante.[86] O período médio de incubação diminuiu gradualmente do vírus selvagem (5,2 dias) para a variante Ômicron (3,42 dias). O período de incubação combinado geral foi de 6.57 dias (variando de 1.8 a 18.87 dias), e foi maior nos idosos (7.43 dias) e nas crianças (8.82 dias).[87]
Número reprodutivo (R₀)
Uma revisão sistemática e metanálise estimou o número de reprodução em 2.69 (com base na literatura publicada de janeiro a agosto de 2020). No entanto, o R₀ difere dependendo de vários fatores.[88]
Taxa de ataque secundário
A taxa de ataques secundários combinada entre todos os contatos próximos de um caso índice foi estimada em 7%, com base em dados do início da pandemia.[89] No entanto, a taxa variou entre os cenários de contato, com uma taxa estimada de 18.9% a 37.3% em ambientes domésticos, 42% entre residentes de instituições asilares, 3.6% em serviços de saúde, 1.2% a 5.9% em ambientes sociais e 1.9% em locais de trabalho. A taxa é maior para os casos índice sintomáticos em comparação com casos assintomáticos e para os adultos em comparação com as crianças.[74][90][91][92][93][94] A taxa em crianças e jovens foi maior nos ambientes domésticos em comparação com ambientes escolares.[95] A taxa de ataques secundários em ambientes domiciliares devido à transmissão a partir de um caso índice pediátrico variou de 0% a 75% entre os estudos.[96] A taxa de ataques secundários para a variante Ômicron é maior em comparação com outras variantes do SARS-CoV-2.[93][97]
Carga viral
A carga viral parece ser o principal fator de transmissão do vírus; cargas virais mais altas estão associadas a taxas aumentadas de ataques secundários e a um maior risco de desenvolvimento de doença sintomática.[98] A carga viral é mais elevada no trato respiratório superior (nasofaringe e orofaringe) no início da evolução da infecção (em geral, atinge a intensidade máxima na primeira semana da doença) e, em seguida, aumenta no trato respiratório inferior (escarro). A carga viral diminui após o início dos sintomas. Os pacientes com doença grave têm cargas virais mais altas em comparação com aqueles com doença leve. A carga viral no trato respiratório superior é comparável em pacientes assintomáticos e sintomáticos; entretanto, a maioria dos estudos demonstra eliminação viral mais rápida entre pessoas assintomáticas em comparação com pessoas sintomáticas.[99]
Eliminação de partículas virais
A duração média da eliminação de partículas virais depende da amostra: 17 dias no trato respiratório superior (máximo de 83 dias); 14.6 dias no trato respiratório inferior (máximo de 59 dias); e 17.2 dias nas fezes (máximo de 126 dias). A duração da disseminação de partículas virais foi maior nos pacientes sintomáticos em comparação com pacientes assintomáticos, em crianças em comparação com adultos, e nos pacientes com doença grave em comparação com aqueles com doença não grave.[99][100] Os pacientes imunocomprometidos podem eliminar partículas virais por pelo menos 2 meses.[101] Há relatos de super espalhadores de partículas virais que liberaram o vírus por períodos prolongados (o mais longo foi um caso que testou positivo por 505 dias).[102] Não há evidências convincentes de que a duração da eliminação de partículas virais se correlacione com a duração da infectividade.[103] Nenhum vírus viável foi isolado em pacientes com doença leve ou moderada após 10 dias de sintomas, ou após 20 dias naqueles com doença grave ou crítica, apesar da eliminação de partículas virais continuada.[36] As pessoas totalmente vacinadas podem ter uma duração mais curta de eliminação viável de partículas virais em comparação com pessoas parcialmente vacinadas ou não vacinadas.[104]
A duração combinada de eliminação de partículas virais viáveis foi de 5.2 dias para a variante Ômicron; a duração foi ligeiramente superior nos pacientes sintomáticos, em comparação com pacientes assintomáticos (embora a diferença não tenha sido significativa).[105]
Fisiopatología
A fisiopatologia exata é desconhecida, em parte devido à escassez de estudos post-mortem.[106] A fisiopatologia se assemelha à de outras infecções por coronavírus. No entanto, algumas evidências indicam que a COVID-19 tem características fisiopatológicas distintas que a distinguem da insuficiência respiratória de outras origens.[107]
O SARS-CoV-2 se liga ao receptor da enzima conversora de angiotensina-2 (ECA2) nas células hospedeiras alvo, o que é seguido pela internalização e replicação do vírus. Os receptores ECA2 são altamente expressos nas células dos tratos respiratórios superior e inferior, mas também são expressos nas células do miocárdio, células epiteliais renais, enterócitos e células endoteliais em múltiplos órgãos, o que pode explicar as manifestações extrapulmonares associadas com a doença.[108] O RNA viral foi identificado em muitos órgãos em estudos post-mortem.[106]
[Figure caption and citation for the preceding image starts]: Complicações da COVID-19 em múltiplos órgãos e COVID longa. O vírus SARS-CoV-2 consegue entrar nas células de vários órgãos por meio do receptor ECA2BMJ. 2021;374:n1648 [Citation ends].
O vírus utiliza a serino-protease transmembrana 2 (TMPRSS2) do hospedeiro para a iniciação da proteína da espícula (spike) e a fusão do vírus com as membranas celulares do hospedeiro.[109] A proteína da espícula (spike) do SARS-CoV-2 desempenha um papel fundamental no reconhecimento do receptor ECA2 e no processo de fusão à membrana celular. Uma característica estrutural única do domínio de ligação ao receptor de glicoproteína da espícula confere afinidade de ligação potencialmente maior para o ECA2 nas células hospedeiras em comparação com o SARS-CoV-1.[110] Este sítio de clivagem semelhante à furina não parece existir em outros coronavírus.[111] A energia de ligação entre a proteína da espícula (spike) e o receptor ECA2 foi a mais elevada para os seres humanos dentre todas as espécies testadas em um estudo, o que sugere que a proteína da espícula (spike) evoluiu de maneira exclusiva para se ligar e infectar células humanas que expressam o ECA2.[112] As evidências sugerem que a proteína da espícula (spike) pode por si só danificar as células endoteliais pela regulação negativa de ECA2 e, consequentemente, inibir a função mitocondrial. Pesquisas adicionais são necessárias para se saber se a proteína da espícula (spike) pode, por si só, desencadear a sinalização celular que pode levar a vários processos biológicos.[113][114] As variantes do SARS-CoV-2 podem ser mais transmissíveis, pelo menos em parte, devido à maior afinidade de ligação da proteína da espícula (spike) para o receptor da ECA2.[115]
[Figure caption and citation for the preceding image starts]: Ciclo de replicação viralBMJ. 2020;371:m3862 [Citation ends].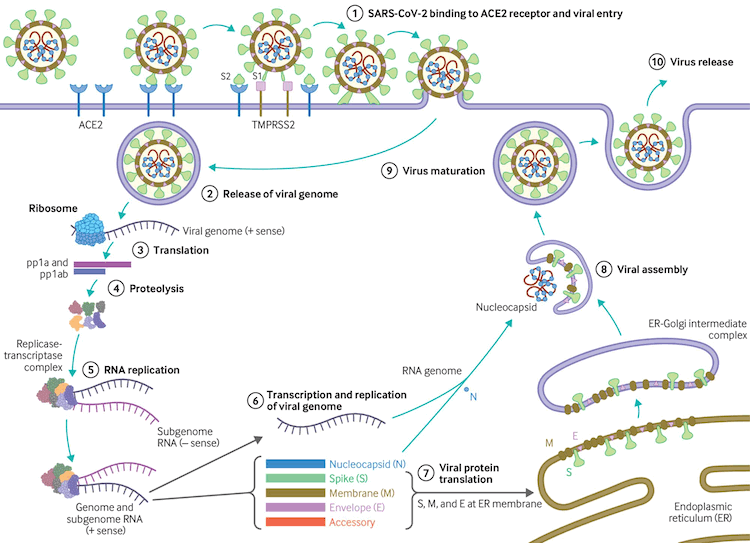
Além da lesão citopática viral direta, a doença grave é frequentemente complicada por uma microangiopatia ou um estado hipercoagulável induzido pela infecção que causa trombose capilar, venosa e/ou arterial, que pode causar danos em órgãos-alvo devido a doença trombótica ou embólica distante. Microtrombos disseminados foram identificados em quase todos os órgãos em estudos post-mortem. Os achados patológicos predominantes nos casos fatais foram dano alveolar difuso, coagulopatia e comprometimento hemodinâmico. O envolvimento de órgãos não pulmonares foi limitado a inflamação leve do parênquima (por exemplo, miocardite, hepatite, encefalite). A lesão citopática viral direta dos órgãos extrapulmonares em geral não foi considerada como causa de insuficiência orgânica.[106][108][116] A maioria dos achados em órgãos não pulmonares foi relacionada a doenças crônicas.[117] A endotelite induzida pelo SARS-CoV-2 pode desempenhar um papel nas manifestações respiratórias e não respiratórias.[118]
Três principais fenótipos de tecido surgiram no tecido pulmonar após a morte: um fenótipo clássico caracterizado por dano alveolar difuso progressivo; broncopneumonia por infecção secundária; e trombose tecidual. Esses fenótipos não são mutuamente exclusivos e podem se sobrepor.[119] A doença pulmonar grave é consequência do remodelamento fibrótico e da microisquemia lobular secundária, resultando em uma forma distinta de doença pulmonar intersticial fibrótica.[120]
A placentite por SARS-CoV-2 é uma entidade patológica distinta que tem sido relatada em gestantes e é caracterizada por deposição maciça de fibrina perivilosa e intervilosite crônica histiocítica. Ela está associada a aumento do risco de perda gestacional.[121]
Fatores genéticos podem desempenhar um papel na suscetibilidade à infecção e na gravidade da doença; no entanto, pesquisas adicionais são necessárias.[122][123]
Clasificación
Classificação da variante do coronavírus da síndrome respiratória aguda grave 2 (SARS-CoV-2)
Todos os vírus, incluindo o SARS-CoV-2, mudam ao longo do tempo. A maioria das mudanças tem pouco ou nenhum impacto sobre as propriedades do vírus; no entanto, algumas alterações podem afetar a transmissão do vírus, a gravidade da doença e o desempenho de testes diagnósticos, terapêuticas ou vacinas.
Variantes do SARS-CoV-2 têm surgido e circulado em todo o mundo desde o início da pandemia, e são rotineiramente monitoradas e classificadas pela Organização Mundial da Saúde (OMS) como variantes em monitoramento, variantes de interesse ou variantes preocupantes.[2] Esses sistemas de classificação podem variar entre os países.
A OMS atribui rótulos simples para as variantes preocupantes usando letras do alfabeto grego. Anteriormente, os rótulos com alfabeto grego também eram usados para dar nome às variantes de interesse, mas esse não é mais o caso. Esses rótulos não substituem os nomes científicos existentes (por exemplo, Pango, Nextstrain, GISAID), que continuam a ser usados nas pesquisas.[2]
Variante em monitoramento
A OMS define variante em monitoramento como a variante com alterações genéticas suspeitas de afetarem as características do vírus e com sinais precoces de vantagem de crescimento em relação às outras variantes em circulação (por exemplo, vantagem de crescimento que pode ocorrer globalmente ou em apenas uma região da OMS), mas para a qual as evidências de impacto fenotípico ou epidemiológico continuam não claras, requerendo monitoramento mais rigoroso e reavaliação de novas evidências. Se uma variante tiver um número incomumente grande de mutações em sítios antigênicos conhecidos, mas com muito poucas sequências, e não for possível estimar a sua vantagem de crescimento relativa, tal variante também pode ser designada como variante sob monitoramento se também houver evidência de transmissão na comunidade em dois ou mais países em um período de 2 a 4 semanas.[3]
Variante de interesse
A OMS define uma variante de interesse como uma variante com alterações genéticas que são preditas ou conhecidas por afetar as características do vírus, como transmissibilidade, virulência, evasão de anticorpos, suscetibilidade à terapêutica e detectabilidade; e identificada como tendo vantagem de crescimento sobre as variantes em circulação em mais de uma região da OMS com prevalência relativa crescente juntamente com um número crescente de casos ao longo do tempo, ou outros impactos epidemiológicos aparentes para sugerir um risco emergente para a saúde pública global.[3]
Variante preocupante
A OMS define uma variante preocupante como uma variante que cumpre com a definição de variante de interesse (veja acima) e que está associada a um nível moderado ou alto de confiança (por meio de uma avaliação de risco realizada pela OMS), e que atende a pelo menos um dos critérios a seguir, em comparação com outras variantes:[3]
Alteração prejudicial na gravidade da doença clínica, ou
Alteração na epidemiologia, gerando impacto substancial sobre a capacidade dos sistemas de saúde de fornecer assistência a pacientes com COVID-19 ou outras doenças, necessitando, assim, de grandes intervenções de saúde pública, ou
Redução significativa da efetividade das vacinas disponíveis para proteger contra a doença grave.
Variantes preocupantes anteriores
As variantes preocupantes do SARS-CoV-2 estão extintas, sendo as variantes de interesse atualmente em circulação e as variantes sob monitoramento as diversas subvariantes da Ômicron (veja abaixo). As variantes substituíram umas às outras de maneira sequencial desde o início da pandemia, e as variantes de maior destaque foram a Alfa (B.1.1.7), a Delta (B.1.617.2) e a Ômicron (B.1.1.529). A Alfa e a Delta surgiram no fim de 2020, e a Ômicron surgiu no fim de 2021. A Beta (B.1.351) e a Gama (P.1) também são variantes preocupantes.[4]
A variante Alfa foi mais transmissível que o vírus do tipo selvagem, e foi associada a um aumento dos riscos de hospitalização e internação em unidade de terapia intensiva (sugerindo doença mais grave), mas não de mortalidade, em comparação com o vírus do tipo selvagem, embora os dados sejam conflitantes. Ela não foi associada a alterações nos sintomas relatados ou na sua duração.[5][6][7][8]
A variante Delta foi mais transmissível que o vírus do tipo selvagem e que a variante Alfa, e foi associada a um aumento do risco de hospitalização (o que sugere doença mais grave) em comparação com casos da Alfa e da Beta contemporâneos. No entanto, os achados tiveram um alto nível de incerteza. A taxa de letalidade bruta foi menor que a da variante Alfa.[9]
Variante Ômicron
A variante Ômicron compreende a linhagem parental B.1.1.529 e suas linhagens descendentes (ou subvariantes) BA.1, BA.2, BA.3, BA.4 e BA.5, bem como suas várias sublinhagens. Subvariantes da Ômicron estão em circulação no momento.
A OMS considera a classificação das sublinhagens da Ômicron de maneira independente, como variantes em monitoramento, variantes de interesse e variantes preocupantes. Anteriormente, as sublinhagens da Ômicron eram todas classificadas como partes da variante preocupante Ômicron. Essa classificação não tinha a granularidade necessária para comparar novas linhagens descendentes com fenótipos alterados com as linhagens parentais da Ômicron BA.1, BA.2, BA.3, BA4 e BA.5.[10]
A Ômicron é uma variante altamente divergente com um grande número de mutações. Não há via de transmissão ligando a Ômicron às suas antecessoras (Alfa, Delta), e estima-se que sua ancestral genética mais próxima provavelmente remonta a algum momento após meados de 2020.[11] Relataram-se casos pela primeira vez na África do Sul em novembro de 2021. A Ômicron demonstrou ter uma vantagem substancial de crescimento sobre a Delta e, rapidamente, substituiu a Delta mundialmente. A variante Ômicron se tornou a variante dominante em muitos países, e foi responsável por mais de 98% das sequências publicamente disponíveis desde fevereiro de 2022.[10]
Evidências sugerem menor gravidade e mortalidade mais baixa para a variante Ômicron em comparação com a variante Delta, após o ajuste para os efeitos confundidores de idade, sexo, etnia, infecção prévia, status de vacinação, comorbidades e efeito das províncias e efeito dos setores público/privado.[12][13] A maioria das mortes ocorreu em adultos ≥65 anos e em pacientes com ≥3 doenças subjacentes.[14] Evidências de estudos em animais e de culturas ex vivo dos tratos respiratórios inferior e superior de seres humanos sugerem que a Ômicron não infecta as células profundas do pulmão tão prontamente quanto as células das vias aéreas superiores.[15][16] A transmissão, a gravidade da doença/taxa de hospitalizações e a eficácia da vacina podem diferir de acordo com a sublinhagem específica da Ômicron. As variantes recentes não parecem causar uma doença mais grave em comparação com as variantes anteriores.[2]
Diversas variantes recombinantes do SARS-CoV-2 têm sido identificadas ao longo da pandemia, e a grande maioria não parece conferir nenhuma vantagem ao vírus.
Variantes atualmente em circulação
Atualmente não há variantes preocupantes em circulação, mas há variantes de interesse e variantes sob monitoramento. Consulte a autoridade de saúde pública local para obter as informações mais atualizadas sobre as variantes em circulação na sua região. Os seguintes recursos estão disponíveis:
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad
