Complicaciones
Los pacientes tratados en la unidad de cuidados intensivos pueden presentar el síndrome de postcuidados intensivos, un espectro de discapacidad psiquiátrica, cognitiva y/o física (p. ej., debilidad muscular, disfunción cognitiva, insomnio, depresión, ansiedad, trastorno de estrés postraumático, delirio, encefalopatía) que afecta a los supervivientes de enfermedades críticas y que persiste después de que el paciente haya sido dado de alta de la unidad de cuidados intensivos. El riesgo puede minimizarse con el manejo de la medicación, la rehabilitación física, el apoyo familiar y las clínicas de seguimiento. Los síntomas físicos, mentales o cognitivos se informaron frecuentemente en los pacientes que sobrevivieron 1 año después de la unidad de cuidados intensivos.[960]
El estado de hipercoagulabilidad es uno de los rasgos distintivos de la enfermedad, especialmente en los pacientes críticos y a menudo se manifiesta como tromboembolismo venoso y arterial. La coagulopatía en COVID-19 presenta un carácter protrombótico, con aumentos de dímero D, fibrina, productos de degradación de la fibrina y fibrinógeno.[961] Se han detectado anticuerpos antifosfolípidos en pacientes con enfermedad grave y crítica; sin embargo, actualmente no parece haber ninguna asociación entre este hallazgo y los resultados de la enfermedad (p. ej., trombosis, mortalidad).[962]
Epidemiología: la incidencia conjunta de tromboembolismo venoso, trombosis venosa profunda y embolia pulmonar entre los pacientes hospitalizados fue del 14.7%, 11.2% y 7.8%, respectivamente. La prevalencia fue significativamente mayor en los pacientes ingresados en la unidad de cuidados intensivos, a pesar de la tromboprofilaxis. La prevalencia del tromboembolismo arterial parece ser menor, con un 3.9%; sin embargo, la evidencia es limitada.[963] Los eventos tromboembólicos son infrecuentes en los niños.[964] Los factores de riesgo con mayor evidencia para predecir el tromboembolismo venoso son la edad avanzada y los niveles elevados de dímeros D.[965] También se han identificado como factores de riesgo el sexo masculino, la obesidad, la ventilación mecánica, el ingreso en la unidad de cuidados intensivos, las anomalías parenquimatosas graves y la elevación de los leucocitos.[966] La incidencia acumulada de embolia pulmonar aguda y trombosis venosa profunda entre los pacientes recuperados tras el alta hospitalaria fue del 1.2% y el 2.3%, respectivamente, mucho menor en comparación con la incidencia intrahospitalaria.[967] Los pacientes no hospitalizados también pueden correr un mayor riesgo de sufrir episodios tromboembólicos.[968]
Etiología: la patogénesis no se conoce completamente. Se ha planteado la hipótesis de que los trombos locales se forman debido a un proceso inflamatorio local, en lugar de los clásicos émbolos procedentes de otra parte del cuerpo.[969][970] Los pacientes pueden estar predispuestos al tromboembolismo debido a los efectos directos de la infección, o a los efectos indirectos de la misma (p. ej., respuesta inflamatoria grave, enfermedad crítica, factores de riesgo tradicionales).[971] Los eventos trombóticos pueden deberse a una tormenta de citoquinas, lesiones hipóxicas, disfunción endotelial, hipercoagulabilidad y/o aumento de la actividad plaquetaria.[972]
Diagnóstico: monitorice a los pacientes en busca de signos o síntomas sugestivos de tromboembolismo venoso o arterial, y proceder según los protocolos hospitalarios para el diagnóstico.[86] El nivel de dímero D al ingreso se ha asociado con el diagnóstico de tromboembolia venosa durante el ingreso hospitalario; sin embargo, no existen umbrales óptimos para orientar las medidas de profilaxis.[973] Evalúe a los pacientes hospitalizados que experimentan un rápido deterioro de la función pulmonar, cardíaca o neurológica, o una pérdida súbita localizada de la perfusión periférica para detectar una enfermedad tromboembólica.
Manejo: trate con anticoagulación terapéutica a los pacientes con un evento tromboembólico (o que presenten una alta sospecha de enfermedad tromboembólica si no es posible obtener imágenes). Siga los protocolos institucionales locales.
Monitorización: los parámetros hematológicos y de coagulación se miden por lo general en los pacientes hospitalizados; sin embargo, actualmente no hay evidencia suficiente para recomendar a favor o en contra del uso de estos datos para guiar las decisiones de manejo. Los pacientes con niveles muy altos del dímero D presentan el mayor riesgo de trombosis y pueden beneficiarse de la monitorización activa.[629][630]
Pronóstico: los pacientes con eventos tromboembólicos tienen 1.93 veces más probabilidades de morir que los pacientes sin tromboembolismo venoso.[974]
Véase también Coagulación intravascular diseminada a continuación.
Las complicaciones cardiovasculares incluyen arritmias, lesiones miocárdicas, síndrome coronario agudo e insuficiencia cardíaca.[975] Mientras que la infección aguda se asoció con un aumento de seis veces en los diagnósticos cardiovasculares en general, el riesgo comenzó a disminuir 5 semanas después de la infección y regresó a los niveles de referencia o por debajo de 12 semanas a 1 año.[976]
Epidemiología: se han informado complicaciones cardiovasculares en el 14.1% de los pacientes durante el ingreso hospitalario.[975] La incidencia global agrupada de infarto agudo de miocardio, insuficiencia cardíaca, arritmias, parada cardíaca y síndrome coronario agudo fue del 21%, 14%, 16%, 3,45% y 1,3%, respectivamente.[977] Se han informado tasas más elevadas de lesiones miocárdicas en Estados Unidos (del 9% al 52%) en comparación con China (del 7% al 28%).[978] Una revisión de la Cochrane encontró que las complicaciones cardiovasculares más comunes eran las arritmias, la insuficiencia cardíaca y los eventos oclusivos arteriales y venosos.[176] Con menos frecuencia, se han informado casos de miocarditis fulminante, pericarditis, taponamiento cardíaco, cor pulmonale y síndrome de takotsubo.[979] Los factores de riesgo son la edad avanzada, la hipertensión, la enfermedad cardiovascular subyacente y la enfermedad renal crónica.[978]
Etiología: el COVID-19 está asociado a una alta carga inflamatoria. La inflamación del miocardio puede provocar miocarditis, insuficiencia cardíaca, arritmias, síndrome coronario agudo, deterioro rápido y muerte súbita.[980][981]
Diagnóstico: realizar un ECG y solicitar los niveles de troponina I de alta sensibilidad (hs-cTnI) o T (hs-cTnT) y de pro-péptido natriurético cerebral N-terminal (NT-proBNP) en pacientes con síntomas o signos que sugieran una lesión miocárdica aguda para realizar el diagnóstico. Los siguientes resultados de las pruebas pueden ayudar a informar del diagnóstico: cambios evolutivos en el ECG que sugieran isquemia miocárdica; nivel de NT-proBNP >400 nanogramos/l; niveles elevados de hs-cTnI o hs-cTnT, en particular niveles que aumenten con el tiempo. Los niveles elevados de troponina pueden reflejar una respuesta inflamatoria cardíaca a una enfermedad grave más que un síndrome coronario agudo. Busque el consejo de un especialista en cardiología para que le hagan más pruebas y estudios por imágenes.[406]
Manejo: busque el consejo de un especialista en cardiología sobre el tratamiento y siga los protocolos locales de tratamiento.[406] El tratamiento de las arritmias debe basarse en las guías de práctica clínica actuales para la arritmia respectiva.[982] Hay datos limitados para recomendar cualquier tratamiento farmacológico específico para estos pacientes. Implicar a un equipo multidisciplinar que incluya a especialistas en cuidados intensivos, cardiólogos y especialistas en enfermedades infecciosas.[983]
Monitorización: monitorice la presión arterial, la frecuencia cardíaca y el balance de fluidos, y realice una monitorización continua del ECG en todos los pacientes con sospecha o confirmación de lesión miocárdica aguda. Lleve a cabo la monitorización en un entorno en el que se pueda identificar rápidamente el deterioro cardíaco o respiratorio.[406] Los biomarcadores de laboratorio pueden ayudar a identificar a las personas con mayor riesgo de desarrollar complicaciones cardiovasculares. El aumento de los biomarcadores cardíacos y de las arritmias emergentes se asocian con el desarrollo de enfermedad grave y la necesidad de ingreso en la unidad de cuidados intensivos.[984]
Pronóstico: la lesión miocárdica se asocia a un desenlace desfavorable y escasa supervivencia. Una troponina elevada predice un desenlace desfavorable y un mayor riesgo de mortalidad.[978] Se ha informado una tasa global de letalidad del 9.6%.[975] La infección puede presentar implicaciones a largo plazo para la salud cardiovascular en general.[985] Se han informado problemas cardiovasculares hasta un año después de la infección, incluso en personas que no recibieron ingreso hospitalario por la infección aguda.[986]
La lesión renal aguda es frecuente, especialmente en los pacientes críticos. Puede desarrollarse en cualquier momento antes, durante o después del ingreso hospitalario.[406] El riesgo en pacientes en estado crítico con COVID-19 parece ser menor en comparación con los pacientes con gripe.[987]
Epidemiología: la incidencia conjunta de la lesión renal aguda se ha estimado en un 19.45%; Sin embargo, la incidencia varía según los estudios. Los pacientes presentan un riesgo significativamente mayor de mortalidad intrahospitalaria (54.2%).[988] Los factores de riesgo independientes fueron el sexo masculino, la edad avanzada, los antecedentes de tabaquismo, la obesidad, la hipertensión, la diabetes, la neumopatía, las enfermedades cardiovasculares, el cáncer, la enfermedad renal crónica, la ventilación mecánica y el uso de vasopresores.[989]
Etiología: las causas incluyen cambios hemodinámicos, hipovolemia, infección viral que conduce directamente a una lesión tubular renal, procesos vasculares trombóticos, patología glomerular o rabdomiólisis. Puede asociarse con hematuria, proteinuria y niveles anormales de electrolitos séricos (p. ej., potasio, sodio).[406]
Diagnóstico: monitorice a los pacientes en busca de signos o síntomas sugestivos de daño renal agudo y proceda según los protocolos hospitalarios para el diagnóstico.
Manejo: siga las guías de práctica clínica locales para el manejo del daño renal agudo. Se requieren medidas de soporte y fluidoterapia.[988] Los aglutinantes de potasio pueden utilizarse como opciones junto con la atención estándar para el tratamiento de emergencia de la hiperpotasemia aguda potencialmente mortal.[406] Puede requerir diálisis.
Monitorización: monitorice a los pacientes con enfermedad renal crónica durante al menos 2 años después del daño renal agudo.[406]
Los síntomas prolongados son frecuentes después de muchas infecciones virales y bacterianas, incluida la infección por SARS-CoV-2.[990] Las definiciones de los casos varían, pero la Organización Mundial de la Salud (OMS) define el COVID persistente como una afección que se produce en personas con antecedentes de infección probable o confirmada por el SARS-CoV-2, que suele presentarse a los 3 meses del inicio de los síntomas y que se prolonga al menos 2 meses y que no puede explicarse por un diagnóstico alternativo.[991]
Los síntomas varían mucho, puede producirse recidiva y remitir o fluctuar, pueden cambiar de manera impredecible y pueden producirse solo en personas que presentan una enfermedad leve. Los síntomas frecuentes a largo plazo pueden incluir tos persistente, febrícula, dificultad para respirar, fatiga, dolor/opresión en el pecho, palpitaciones, mialgia, artralgia, cefaleas, cambios en la visión, pérdida de la audición, acúfenos, dolor de garganta, pérdida del gusto/olfato, neuropatía periférica, mareos, temblores, cambios en el estado de ánimo, erupciones cutáneas, pérdida de cabello, disfunción sexual, síntomas gastrointestinales, dificultades neurocognitivas, alteraciones del sueño, delirio (personas de edad avanzada) y afecciones de salud mental.[992][993][994] Los síntomas más frecuentes en el seguimiento de un año fueron fatiga, sudoración, opresión en el pecho, ansiedad y mialgia.[995] Adapte las pruebas diagnósticas a la presentación clínica y descarte cualquier complicación aguda o que ponga en peligro la vida y diagnósticos alternativos.
Hay una falta de evidencia para las intervenciones farmacológicas. Un plan de rehabilitación personalizado y multidisciplinario que cubre los aspectos físicos, psicológicos y psiquiátricos de la rehabilitación es una parte importante del manejo. Dar consejos e información sobre el autocontrol, incluidas las formas de autocontrolar los síntomas. Es posible que se requiera la derivación a un especialista en pacientes en los que exista preocupación clínica.[993] La OMS ha emitido varias recomendaciones para la rehabilitación de los adultos con el síndrome post-COVID-19.[86] Durante el tratamiento, debe monitorizarse estrechamente a los pacientes. El tiempo de recuperación difiere, pero los síntomas generalmente se resuelven a las 12 semanas en la mayoría de las personas.
Pueden producirse miocarditis o pericarditis tras la vacunación con vacunas de ARNm.[996] Se ha postulado que las vacunas de ARNm pueden aumentar la inflamación en el endotelio y la infiltración de células T en el músculo cardíaco, pero es necesario seguir investigando, ya que se han planteado varias hipótesis.[997][998] Existe una alta probabilidad de que exista una relación causal, según los estudios de autopsia.[999] También se han informado casos con vacunas de vectores de adenovirus y vacunas de subunidades proteicas, aunque más raramente.[1000][1001]
Epidemiología: la incidencia de la miocarditis puede llegar a ser de 140 a 200 casos por millón de dosis según la edad, el sexo y la vacuna. Los adolescentes y los adultos jóvenes presentan el mayor riesgo; la incidencia es más alta en los varones de 12 a 29 años. La miocarditis es más probable con la vacuna Moderna en comparación con la de Pfizer/BioNTech, y es más probable después de la segunda dosis (los datos sobre las tasas de incidencia después de una tercera dosis son limitados, aunque el fabricante afirma que el perfil de riesgo es similar después de la segunda y la tercera dosis). Por término medio, el inicio de los síntomas se produjo entre 2 y 4 días después de la dosis de la vacuna, aunque se han informado intervalos de hasta 20 días (o más). La incidencia después de la segunda dosis puede ser menor cuando se administra ≥31 días después de la primera dosis, en comparación con ≤30 días entre los grupos de edad más jóvenes. En el caso de la pericarditis, los datos eran limitados, pero se han informado más variaciones que en el caso de la miocarditis en cuanto a la edad de los pacientes, el sexo, el momento de inicio y la tasa de ingreso en el hospital.[998][1002] Los datos preliminares en la práctica aún no han detectado un aumento del riesgo de miocarditis en niños de 5 a 11 años.[1003][1004] Las tasas informadas en personas inmunodeprimidas fueron similares a las de la población general.[1005] Los individuos vacunados presentaban el doble de probabilidades de desarrollar miocarditis/pericarditis en ausencia de infección por SARS-CoV-2 en comparación con los individuos no vacunados en un periodo de seguimiento de 30 días.[1006]
Diagnóstico: considere el diagnóstico en niños, adolescentes o adultos con dolor torácico significativo de inicio reciente e inexplicable, taquicardia o taquipnea, disnea, palpitaciones, mareo o síncope, o preocupación clínica general, dentro de los 10 días posteriores a la vacunación (nota: los pacientes también pueden presentar >10 días después de la vacunación).[1007] El síntoma de presentación más frecuente fue el dolor torácico (34.5%).[1008]
Pruebas diagnósticas: solicitar un ECG de 12 derivaciones, marcadores inflamatorios en sangre, hemograma completo y troponina. Si el ECG o la troponina son anormales, discuta el plan de tratamiento con el equipo de cardiología. Las pruebas diagnósticas adicionales (p. ej., pruebas de imagen cardiaca y monitorización del ritmo) y el seguimiento las debe dirigir el equipo de cardiología.[1007] Los hallazgos más frecuentes fueron los cambios relacionados con el ST en el electrocardiograma (58.7%) y la hipocinesia en la resonancia magnética cardíaca o la ecocardiografía (50.7%). Los hallazgos de laboratorio incluyeron niveles elevados de troponina I (81.7%) y proteína C-reactiva elevada (71.5%).[1008]
Manejo: debe evitarse la actividad física extenuante hasta que mejoren los síntomas.[1007] Los pacientes deben ser remitidos a un cardiólogo, ya que el manejo depende de la presentación clínica y se requiere una terapia dirigida por las guías de práctica clínica para casos complicados.[1009]
Pronóstico: hasta el 93% de los adolescentes y adultos jóvenes requirieron ingreso hospitalario, siendo necesario el ingreso en la unidad de cuidados intensivos hasta en el 25% de los pacientes. La mediana del intervalo desde el inicio hasta la aprobación de toda la actividad física fue de 98 días. Aproximadamente, el 81% de los pacientes que completaron una encuesta de seguimiento del proveedor de atención médica se consideraron recuperados en el seguimiento de al menos 90 días desde el inicio. Sin embargo, aproximadamente la mitad de los pacientes siguieron informando por sí mismos de los síntomas (p. ej., dolor en el pecho), y al 25% se le recetaron medicamentos cardíacos diarios.[1010] En un estudio nacional coreano se informó de miocarditis grave y potencialmente mortal en el 19.8% de todos los casos de miocarditis relacionada con vacunas, y algunos pacientes requirieron ingreso en la unidad de cuidados intensivos, terapia de oxigenación por membrana extracorpórea y trasplante de corazón.[1011]
Consulte a su autoridad local de salud pública para obtener orientación sobre la administración de más dosis de la vacuna frente al COVID-19. Algunos países han implementado restricciones de prescripción relacionadas con la edad para las vacunas de ARNm debido al riesgo de miocarditis/pericarditis. La modificación de los programas de vacunas de ARNm para incorporar consideraciones sobre el producto en función de la edad e intervalos más largos entre las dosis puede reducir el riesgo de miocarditis/pericarditis.[1012]
La lesión hepática puede estar asociada a una enfermedad hepática preexistente, a una infección vírica, a una toxicidad farmacológica, a una inflamación sistémica, a la hipoxia o a problemas hemodinámicos; sin embargo, el mecanismo subyacente no está claro. La prevalencia global es del 25%, aunque no existe una definición uniforme de lesión hepática en estos pacientes y la prevalencia depende de la definición utilizada en los estudios. La prevalencia global puede ser tan baja como el 9% cuando se utilizan criterios estrictos para el diagnóstico. La prevalencia del aumento de la alanina aminotransferasa y la aspartato aminotransferasa es del 19% y el 22%, respectivamente. La prevalencia de la hipertransaminasemia es mayor en los pacientes con enfermedad grave, en comparación con los pacientes con enfermedad no grave.[1013] Las pruebas de función hepática anormales se asocian a una mortalidad significativamente mayor, al ingreso en la unidad de cuidados intensivos y a la necesidad de ventilación mecánica.[1014] Otro metanálisis concluyó que los resultados de la evidencia disponible hasta la fecha de estudios observacionales e informes de casos indican que los niveles de transaminasas y bilirrubina total no parecen cambiar significativamente en los pacientes con COVID-19.[1015]
Los factores de riesgo asociados a las lesiones hepáticas graves son la edad avanzada, la enfermedad hepática preexistente y la enfermedad grave.[1016] Los medicamentos utilizados en el tratamiento del COVID-19 (p. ej., remdesivir, tocilizumab) pueden tener un efecto perjudicial sobre la lesión hepática.[1017] Se han publicado guías de práctica clínica sobre el tratamiento del trastorno hepático en pacientes con COVID-19.[1018]
Las complicaciones neurológicas incluyen la enfermedad cerebrovascular aguda, el deterioro de la conciencia, la ataxia, las convulsiones, el estado epiléptico, la encefalopatía, la encefalitis y la meningoencefalitis, la encefalomielitis aguda diseminada, los signos del tracto corticoespinal, las lesiones desmielinizantes, las neuropatías periféricas, la trombosis de los senos venosos cerebrales, la miopatía, el síndrome de Guillain-Barré, la demencia y los hallazgos anormales en la resonancia magnética cerebral.[1019][1020][1021] Se han informado casos de síndrome de boca ardiente y síndrome de ojo ardiente.[1022]
Los pacientes suelen presentar complicaciones neurológicas centrales o periféricas, posiblemente debidas a la invasión viral del sistema nervioso central, a la respuesta inflamatoria o a la desregulación inmunológica.[1023] Las complicaciones neurológicas se producen a lo largo de la vida en el contexto de la infección, con y sin comorbilidades conocidas, y con todas las gravedades de la enfermedad (incluidos los pacientes asintomáticos).[1024] Los pacientes pueden presentarse con estas manifestaciones, o pueden desarrollarlas durante el curso de la enfermedad (por lo general, entre 1 y 2 semanas después del inicio de la enfermedad respiratoria).[1025] Los pacientes con trastornos neurológicos preexistentes pueden desarrollar una exacerbación de sus síntomas neurológicos.[1026] Pueden producirse secuelas a largo plazo.[1027][1028]
Epidemiología: se ha informado en el 22% al 35% de los pacientes. Las manifestaciones del sistema nervioso central eran más frecuentes que las del sistema nervioso periférico.[1019] La afectación neurológica es frecuente en niños y adolescentes (22% en pacientes de <21 años).[1029]
La enfermedad cerebrovascular aguda: (que incluye el accidente cerebrovascular isquémico, el accidente isquémico hemorrágico, la trombosis venosa cerebral y el accidente isquémico transitorio) se ha notificado en el 0.5% al 5.9% de los pacientes. El tipo más frecuente fue el accidente cerebrovascular isquémico (0.4% a 4.9%).[1023] Sin embargo, la incidencia absoluta global de los accidentes cerebrovasculares en los pacientes hospitalizados se ha informado como un 0.175%, inferior a la informada en estudios observacionales anteriores.[1030] Los pacientes con enfermedad grave presentan un mayor riesgo de sufrir un accidente cerebrovascular isquémico, en comparación con los pacientes con enfermedad no grave.[1031] El accidente cerebrovascular es relativamente frecuente entre los pacientes hospitalizados en relación con otras infecciones respiratorias virales y presenta un alto riesgo de mortalidad intrahospitalaria. Los factores de riesgo incluyen la edad avanzada y el sexo masculino. La mediana de tiempo desde el inicio de los síntomas de COVID-19 hasta el accidente cerebrovascular fue de 8 días.[1032][1033] El accidente cerebrovascular se presenta más tarde en la enfermedad grave y más temprano en la enfermedad leve a moderada.[1034] Los pacientes pueden presentar un accidente cerebrovascular isquémico durante la fase de convalecencia de la infección, incluidos los más jóvenes <50 años de edad con COVID-19 asintomático o paucisintomático.[1035] El accidente cerebrovascular isquémico parece ser más grave y dar lugar a peores resultados (discapacidad grave) en los pacientes con COVID-19, siendo la puntuación media de la NIH Stroke Scale más elevada entre las personas que presentan COVID-19 en comparación con los que no.[1036] Se han publicado guías de práctica clínica para el tratamiento del accidente cerebrovascular isquémico agudo en pacientes con infección por COVID-19.[1037]
Síndrome de Guillain-Barre: se han informado patrones tanto posinfecciosos como pre-infecciosos.[1023] La prevalencia agrupada entre los pacientes hospitalizados y no hospitalizados fue del 0.15%.[1038] La edad media de los pacientes era de 55 años con predominio de pacientes hombres. La mayoría de los pacientes presentaban síntomas respiratorios y/o graves de COVID-19, aunque también se ha informado en pacientes asintomáticos. Se ha informado una mayor prevalencia de la forma sensoriomotora clásica y de la polineuropatía desmielinizante inflamatoria aguda, aunque también se han observado variantes poco frecuentes.[1039] Los pacientes presentaban una mayor probabilidad de presentar subtipos desmielinizantes. Los resultados clínicos fueron comparables a los de los controles contemporáneos o históricos no infectados por el SARS-CoV-2.[1038] El síndrome de Guillain-Barré también se ha asociado con la administración de vacunas contra el COVID-19.[1040]
Encefalitis: se ha notificado en <1% de los pacientes en general, pero aumenta hasta el 6.7% en los pacientes críticos. La encefalitis se asocia con peores resultados, incluyendo el ingreso en la unidad de cuidados intensivos, la necesidad de ventilación mecánica y una mayor tasa de mortalidad (13.4%), en comparación con la población general de pacientes de COVID-19.[1041] Se han informado casos poco frecuentes de encefalitis autoinmunitaria.[1042]
El aspecto fundamental para el manejo de las complicaciones neurológicas es una anamnesis y exploración detalladas, junto con la interpretación adecuada de los datos de laboratorio y radiológicos. En la mayoría de los casos, el manejo de estas afecciones debe seguir las orientaciones anteriores a la pandemia de COVID-19.[1043]
La parada cardíaca intrahospitalaria es frecuente en los pacientes críticos y se asocia a una escasa supervivencia, sobre todo entre los pacientes de edad avanzada. De los 5019 pacientes en estado crítico con COVID-19, el 14% presentó un paro cardíaco en el hospital. Los factores de riesgo incluían la edad más avanzada, el sexo masculino, la presencia de comorbilidades y el ingreso en un hospital con un número menor de camas en la unidad de cuidados intensivos. Aproximadamente, el 57% de los pacientes recibieron resucitación cardiopulmonar. Los ritmos más frecuentes en el momento de la reanimación fueron la actividad eléctrica sin pulso (49.8%) y la asistolia (23.8%). De los que recibieron reanimación, el 12% sobrevivió hasta el alta hospitalaria, siendo la mayoría de estos pacientes menores de 45 años.[1044]
[Figure caption and citation for the preceding image starts]: Paro cardíaco con COVID-19BMJ. 2020;371:m3513 [Citation ends].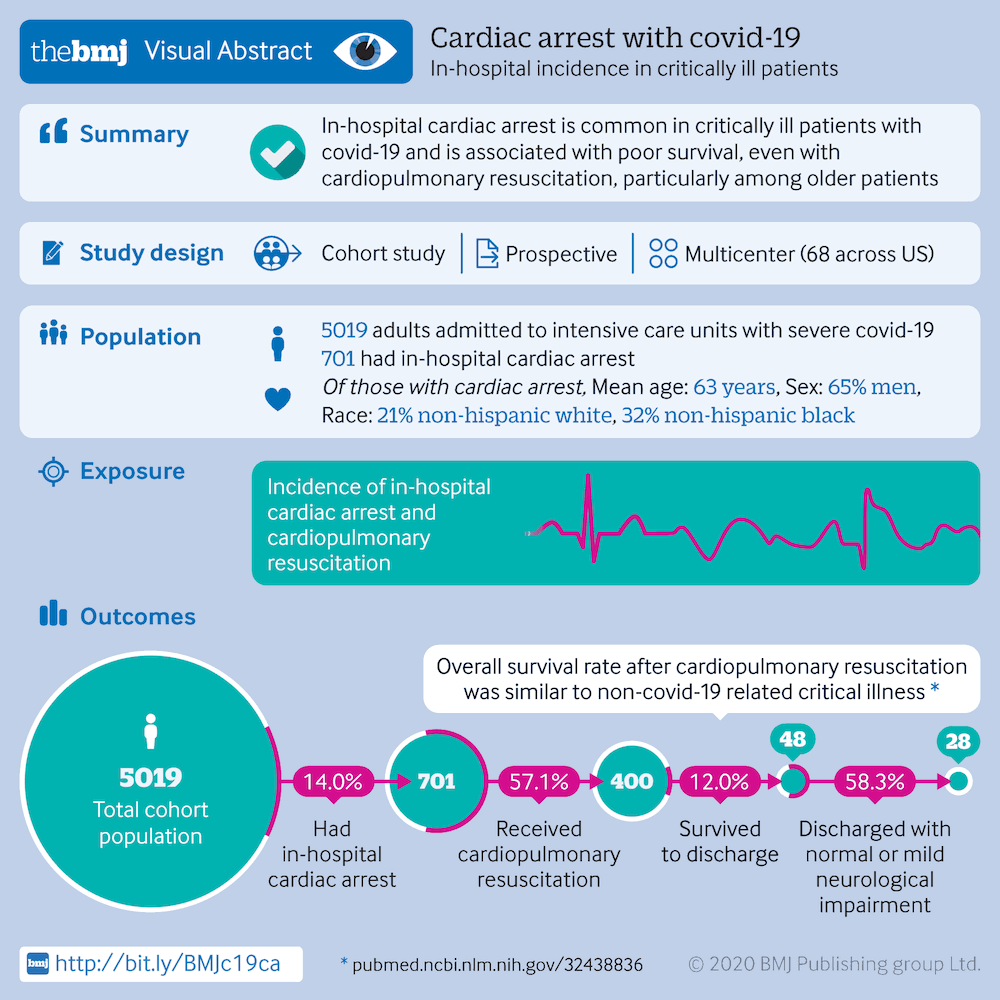
El resultado del embarazo suele ser bueno, aunque hay pocos datos sobre la exposición durante las primeras etapas del embarazo.[222] El riesgo de complicaciones fue mayor en las embarazadas sintomáticas.[1045] El riesgo de complicaciones maternas y neonatales parecía ser sustancialmente menor durante el periodo de predominio ómicron, en comparación con el periodo preomicrón.[1046] Los países de ingresos más bajos han informado tasas más elevadas de ingreso y mortalidad materna en unidades de cuidados intensivos, así como de mortinatos, en comparación con los países de ingresos más altos.[1047]
Resultados en la madre: las probabilidades de ingreso en la unidad de cuidados intensivos, la ventilación invasiva y la necesidad de oxigenación por membrana extracorpórea fueron mayores en las mujeres embarazadas y recientemente embarazadas en comparación con las mujeres en edad reproductiva que no estaban embarazadas. Las mujeres embarazadas también pueden presentar un mayor riesgo de muerte materna. Los factores de riesgo de complicaciones graves incluyen comorbilidades preexistentes (p. ej., hipertensión crónica, diabetes), edad materna elevada, etnia de raza distinta de la blanca, presencia de enfermedades específicas del embarazo (p. ej., diabetes gestacional, preeclampsia) y un índice de masa corporal elevado.[220][221][1048] Se informó un mayor riesgo estadísticamente significativo de diabetes gestacional, hipertensión gestacional, crecimiento fetal deficiente y preeclampsia en las mujeres embarazadas durante el periodo pandémico en comparación con el periodo prepandémico.[1049]
Aborto espontáneo:no hay evidencia de que la infección en el primer o segundo trimestre aumente el riesgo de aborto espontáneo. Sin embargo, es necesario seguir investigando.[1050]
Parto prematuro: el nacimiento prematuro fue más frecuente en las mujeres embarazadas con COVID-19 en comparación con las mujeres embarazadas sin la enfermedad. Sin embargo, las tasas globales de partos prematuros espontáneos en las mujeres embarazadas con COVID-19 fueron en general similares a las observadas en el periodo prepandémico, por lo que estos partos prematuros podrían haber tenido una indicación médica.[220][221][1048]
Muerte fetal y neonatal: las tasas globales de muerte fetal y neonatal no parecen ser superiores a las de los antecedentes.[220][221][1051][1052] Sin embargo, los datos son contradictorios. En Inglaterra, no hubo evidencias de un aumento de los nacimientos de bebés muertos a nivel regional o nacional durante la pandemia en comparación con los mismos meses del año anterior y a pesar de las tasas variables de infección comunitaria en las diferentes regiones.[1053] Sin embargo, en los EE.UU., las mujeres con COVID-19 presentaron un mayor riesgo de mortinatalidad en comparación con las mujeres sin COVID-19 durante el período de marzo de 2020 a septiembre de 2021, siendo la magnitud de la asociación mayor durante el predominio de la variante delta.[1054] Un estudio de registro escandinavo también encontró un mayor riesgo de muerte fetal después de las 22 semanas de gestación, particularmente en mujeres infectadas por la variante Delta.[1055] Un metanálisis de datos de participantes individuales no halló relación entre la infección durante el embarazo con un mayor riesgo de mortinatalidad a las 28 semanas de gestación o más, o con la restricción del crecimiento intrauterino.[1056] Otro metanálisis encontró un mayor riesgo de mortinatalidad.[1057]
Infección neonatal: la limitada evidencia de baja calidad sugiere que el riesgo de infección en los neonatos es extremadamente bajo. La mayoría de las infecciones se adquieren en el período postnatal, aunque se ha informado de infecciones adquiridas congénitamente. A diferencia de los niños que generalmente tienen una infección asintomática, dos tercios de los casos neonatales son sintomáticos y una proporción significativa requiere cuidados intensivos, aunque el pronóstico general parece ser excelente.[220][221][1048][1058][1059]
Resultados neonatales: existen evidencias limitadas y contradictorias de un mayor riesgo de morbilidad neonatal a corto o largo plazo (p. ej., enfermedades respiratorias), y es necesario seguir investigando.[1052] Existen algunas evidencias de que la infección materna y la transmisión perinatal pueden afectar al sistema auditivo del recién nacido, especialmente durante el segundo y tercer trimestre del embarazo. Sin embargo, los datos son limitados e inconsistentes y se requiere más estudio.[1060] Un estudio nórdico basado en un registro encontró que la infección durante el primer trimestre no se asoció con un riesgo de anomalías congénitas importantes entre los bebés.[1061]
La sepsis (diagnosticada según Sepsis-3 o según la presencia de una disfunción orgánica relacionada con la infección que requiere soporte/reemplazo de órganos) se ha notificado en el 78% de los pacientes de la unidad de cuidados intensivos y en el 33% de los pacientes hospitalizados.[1062]
Las guías de práctica clínica para el manejo del shock en pacientes en estado crítico con COVID-19 recomiendan una estrategia conservadora de líquidos y un fármaco vasoactivo. La noradrenalina (norepinefrina) es el fármaco de primera línea de elección en adultos (la adrenalina [epinefrina] o la noradrenalina pueden utilizarse en niños). La vasopresina o la adrenalina (epinefrina) pueden añadirse a la noradrenalina en los adultos si la presión arterial media objetivo no puede alcanzarse con la noradrenalina sola.[708] Consulte las guías de práctica clínica locales para obtener más información.
La coagulación intravascular diseminada (CID) es una manifestación del fallo de la coagulación, y un vínculo intermedio en el desarrollo del fallo multiorgánico. Los pacientes pueden presentar un alto riesgo de sangrado/hemorragia o tromboembolismo venoso.[1063] La incidencia conjunta de la CID es del 3% y se asocia a un mal pronóstico. La incidencia fue mayor en los pacientes con enfermedad grave y en los ingresados en la unidad de cuidados intensivos, y en los no supervivientes, en comparación con los supervivientes.[1064] La coagulopatía asociada a COVID-19 parece ser distinta de la CID, aunque se ha informado coagulación intravascular diseminada (CID) en pacientes gravemente afectados. Los cambios en la coagulación de los pacientes con COVID-19 imitan, pero no son idénticos, a la CID, y la gran mayoría de los pacientes no cumplen los criterios de las formas habituales de CID.[1065]
La coagulopatía se manifiesta como un aumento de fibrinógeno, un aumento del dímero D y un cambio mínimo en el tiempo de protrombina, tiempo parcial de tromboplastina y recuento de plaquetas en las primeras etapas de la infección. El aumento de los niveles de interleucina (IL)-6 se correlaciona con el aumento de los niveles de fibrinógeno. La coagulopatía parece estar relacionada con la gravedad de la enfermedad y la consiguiente tromboinflamación. Se debe monitorizar estrechamente el nivel de Dímero D.[1066]
El tratamiento anticoagulante con heparina de bajo peso molecular o heparina no fraccionada se ha asociado con un mejor pronóstico en pacientes con COVID-19 grave que tienen una puntuación de coagulopatía inducida por sepsis (SIC) de ≥4 o un aumento del dímero D marcadamente elevado.[1067] En los pacientes con trombocitopenia inducida por la heparina (o con antecedentes de esta), se recomienda el argatroban o la bivalirudina.[1063]
Si se produce sangrado, se deben seguir la orientación estándar para el manejo de manifestaciones de sangrado asociadas con la CID o la coagulopatía séptica; sin embargo, las manifestaciones hemorrágicas sin otros factores asociados son poco frecuentes.[1066][1068]
La principal causa de muerte es la insuficiencia respiratoria por síndrome de dificultad respiratoria aguda.[878] La prevalencia global combinada del síndrome de dificultad respiratoria aguda inducido por COVID-19 fue del 32% a nivel mundial.[1069] Los niños pueden evolucionar rápidamente hacia la insuficiencia respiratoria.[1070] Los pacientes con COVID-19 pueden presentar un mayor riesgo de desarrollar neumonía asociada a la ventilación en comparación con los pacientes sin COVID-19. En general, la neumonía asociada a la ventilación se registró en el 48.2% de los pacientes con ventilación mecánica y la tasa de mortalidad fue del 51.4%.[1071]
Las filtraciones de aire (neumotórax, neumomediastino y enfisema subcutáneo) se asocian a una mayor mortalidad y a una estadía hospitalaria más prolongada, especialmente en las personas de edad avanzada y pueden presentarse incluso sin ventilación con presión positiva. Se debe principalmente al avance de la enfermedad que da lugar a una lesión inflamatoria del parénquima pulmonar y a un daño alveolar inducido por el estrés ventilatorio. La incidencia varía mucho según los estudios y aumenta con la gravedad de la enfermedad. La edad media de los pacientes era de 58 años y el 75% eran hombres. La hipertensión fue la comorbilidad más frecuente, seguida de la diabetes. El neumotórax aislado fue el tipo más frecuente de filtración de aire (48.5%), y el 17% de los pacientes desarrollaron un neumotórax espontáneo. La mortalidad fue del 40%. Se requieren más estudios sobre este tema.[1072]
Algunos pacientes con enfermedad grave presentan evidencias de laboratorio de una respuesta inflamatoria no regulada similar al síndrome de liberación de citocinas, caracterizada por extravasación de plasma, aumento de la permeabilidad vascular, coagulación intravascular difusa e inmunodeficiencia. Estos pacientes presentan un mal pronóstico. En estos pacientes se han identificado aumento de los niveles séricos de citocinas proinflamatorias, en particular de interleucina (IL)-6. Puede haber rasgos de linfohistiocitosis hemofagocítica secundaria. Las opciones de tratamiento incluyen los inhibidores de IL-6 (p. ej., el tocilizumab), los inhibidores de la cinasa Janus (JAK) (p. ej., el baricitinib) y la anakinra.[1073]
Véase también Síndrome inflamatorio multisistémico pediátrico, una enfermedad similar al síndrome de liberación de citocinas en niños, más abajo.
También conocido como síndrome multisistémico inflamatorio pediátrico (PIMS), síndrome multisistémico inflamatorio pediátrico temporalmente asociado al SRAS-CoV-2 (PIMS-TS), así como otras variantes. También se ha informado el síndrome inflamatorio multisistémico en adultos (MIS-A), aunque con mucha menos frecuencia.[1074]
Definición: complicación retardada, poco frecuente pero grave, que puede desarrollarse en niños y adolescentes aproximadamente 3 a 4 semanas (o más) después del inicio de la infección aguda, probablemente debido a un proceso inflamatorio posinfeccioso. El síndrome se asemeja a la enfermedad de Kawasaki, pero se diferencia de este y también comparte características comunes con el síndrome de shock tóxico. Presenta una fuerte asociación temporal con la infección por el SARS-CoV-2.[1075] La definición de caso generalmente incluye la presencia de fiebre, marcadores inflamatorios elevados, disfunción multiorgánica, antecedentes de una prueba positiva de SARS-CoV-2 (o contacto cercano con un caso confirmado) y ningún diagnóstico alternativo plausible. Sin embargo, las definiciones de los casos varían.[439][1076] Se han observado tres subtipos fenotípicos distintos.[1077] Puede producirse con escasa frecuencia después de la vacunación contra COVID-19.[1078][1079]
Epidemiología: el riesgo de MIS-C en los 2 meses siguientes a la infección confirmada fue del 0.05% en un estudio de cohorte danés.[1080] El riesgo disminuyó en el segundo año de la pandemia y se redujo con la evolución de la variante SARS-CoV-2.[1081] El MIS-C continuó dándose en 2023, pero a tasas bajas en comparación con principios de la pandemia.[1082] Una revisión sistemática encontró que la mediana de edad de los pacientes era de 7.8 años y que el 60% de los pacientes eran hombres. La obesidad fue la comorbilidad más frecuente, seguida de las enfermedades respiratorias, la prematuridad y el asma.[1083] Los factores de riesgo para el desarrollo del MIS-C incluyen el sexo masculino, la edad de 5 a 11 años, los padres nacidos en el extranjero, el asma, la obesidad y las enfermedades que limitan la vida.[1084] Los factores asociados a resultados más graves fueron: edad superior a 5 años; etnia de raza negra no hispana; síntomas de disnea o dolor abdominal; elevación de la proteína C reactiva, la troponina, la ferritina, el dímero D, el péptido natriurético cerebral o la interleucina (IL)-6; y recuento reducido de linfocitos o plaquetas.[1085] Se han informado con poca frecuencia casos en neonatos (asociados temporalmente a la exposición prenatal) y puede haber un mayor riesgo de mortalidad en los neonatos en comparación con los niños mayores.[1086] Parece existir un menor riesgo de MIS-C con la variante ómicron.[1087]
Diagnóstico: los pacientes suelen presentar una disfunción cardíaca predominante y síntomas gastrointestinales. Las manifestaciones más frecuentes fueron fiebre (99%), síntomas gastrointestinales (77%) y síntomas dermatológicos (63%).[1083] La prevalencia conjunta de disfunción ventricular izquierda significativa fue del 38%, la de aneurisma o dilatación coronaria del 20% y la de alteraciones en el ECG/arritmias cardíacas del 28%.[1088] Los neonatos suelen presentar un compromiso cardiorrespiratorio.[1086] Aproximadamente el 20% de los niños desarrollan un daño renal agudo.[1089] Se han reconocido tres tipos de manifestaciones clínicas: fiebre persistente y síntomas gastrointestinales (el tipo más frecuente); shock con disfunción cardíaca; y síntomas coincidentes con los criterios de diagnóstico de la enfermedad de Kawasaki.[1090] Los pacientes con MIS-C presentaron con mayor frecuencia síntomas respiratorios y gastrointestinales y shock, en comparación con los pacientes con enfermedad de Kawasaki; sin embargo, presentaron una menor incidencia de conjuntivitis.[1091] La enfermedad puede ser menos grave tras la infección con la variante ómicron en comparación con las variantes Alfa y Delta.[1092]
Investigaciones: los marcadores de inflamación, de coagulación y cardíacos estaban elevados en la mayoría de los pacientes.[1083] En el 33% de los pacientes se registró un aumento del nivel de troponina sérica y en el 44% se registró un aumento del nivel de péptido natriurético tipo B (proBNP)/BNP.[1088]
Manejo: el manejo es principalmente de soporte e implica a un equipo multidisciplinar. Aproximadamente el 53% de los pacientes requirieron ingreso en la unidad de cuidados intensivos.[1083] La elección y la combinación óptimas de los tratamientos inmunomoduladores no se han establecido definitivamente. La Organización Mundial de la Salud (OMS) recomienda los corticosteroides además de los cuidados de soporte (en lugar de la inmunoglobulina intravenosa más los cuidados de soporte, o los cuidados de soporte en solitario) en los niños hospitalizados de 0 a 18 años que cumplen la definición de caso estándar. También recomienda los corticosteroides, además de los cuidados de soporte en aquellos que cumplen tanto la definición de caso estándar para MIS-C como los criterios de diagnóstico de la enfermedad de Kawasaki.[86] En Estados Unidos, la Sociedad Estadounidense de Enfermedades Infecciosas (IDSA) recomienda el tratamiento inicial con inmunoglobulina intravenosa y/o un corticosteroide. Anakinra, tocilizumab o infliximab pueden usarse en casos refractarios.[402] El American College of Rheumatology también ha publicado orientaciones al respecto.[1093] Consulte las guías de práctica clínica locales para obtener más información.
Pronóstico: la mayoría de los pacientes presentaron buenos resultados sin secuelas significativas a medio o largo plazo en el seguimiento de 1 año.[1094] En el seguimiento a los 6 meses se observó que, si bien los resultados cardíacos, gastrointestinales, renales, hematológicos y otorrinolaringológicos se resolvieron en gran medida a los 6 meses, la fatiga muscular y la labilidad emocional fueron frecuentes.[1095] La tasa de mortalidad fue del 3.9%.[1083]
Vacunación futura de COVID-19: existen datos limitados sobre la seguridad de las vacunas de COVID-19 en personas que han presentado MIS-C o MIS-A y que aún no han recibido ninguna vacuna. Una anamnesis de MIS-C o MIS-A puede ser una precaución para la vacunación. Consulte las guías de práctica clínica locales para obtener más información.
El VITT también se conoce como síndrome de trombosis con trombocitopenia (TTS) y trombocitopenia inmune protrombótica inducida por vacunas (VIPIT). Las vacunas de vectores de adenovirus, la causa de la VITT, ya no están disponibles en la mayoría de los países.
Definición: trastorno protrombótico de la trombosis con trombocitopenia concurrente y desarrollo de anticuerpos contra el factor 4 plaquetario (anti-PF4) que se produce tras la vacunación con una vacuna COVID-19 basada en un vector adenoviral. La trombosis se produce en lugares poco frecuentes (p. ej., trombosis del seno venoso cerebral, trombosis de la vena esplácnica, trombosis arterial) y puede ser multifocal. El síndrome se parece clínicamente a la trombocitopenia inducida por heparina. La fisiopatología exacta sigue siendo desconocida, pero existen varias hipótesis. Puede ser rápidamente progresiva y fatal.[1096][1097] También se han informado casos con vacunas de ARNm, aunque con menos frecuencia.[1098][1099][1100]
Epidemiología: los datos observacionales del Reino Unido sugieren que el riesgo de un evento trombótico fue mayor en las personas de <40 años, con 16.1 y 36.3 por millón de dosis, respectivamente, para la trombosis venosa cerebral u otro evento trombótico, con el mayor riesgo elevado dentro de los 4 a 13 días después de la vacunación.[1101] En Estados Unidos, el riesgo global con la vacuna de Janssen se estimó actualmente en 3.83 casos por millón de personas que recibieron la vacuna, siendo la tasa de información más alta entre las mujeres de 30 a 39 años (10.6 casos por millón de dosis) y de 40 a 49 años (9,02 casos por millón de dosis), con una tasa de letalidad del 15%.[1102] Se han informado casos hasta 48 días después de la vacunación.[1103]
Diagnóstico: aconsejar a los receptores de la vacuna de vectores de adenovirus que experimenten cualquier síntoma grave entre 4 y 20 días (o más) después de la vacunación que busquen atención médica urgente.[1104] Aproximadamente, la mitad de los pacientes presentan trombosis del seno venoso cerebral.[1105] La cefalea es el síntoma de presentación más frecuente y puede preceder a la trombocitopenia trombótica inmunitaria inducida por la vacuna en varios días.[1106][1107] En raras ocasiones, los pacientes pueden presentar un accidente cerebrovascular isquémico.[1108][1109] Informar de todos los casos a las autoridades sanitarias locales y a través de los sistemas locales de notificación de eventos adversos de las vacunas.
Pruebas diagnósticas: solicite un hemograma completo (con plaquetas), un análisis de coagulación (incluyendo fibrinógeno y dímero D), una placa de sangre/un frotis periférico y un ensayo inmunoenzimático del factor plaquetario 4 para cualquier paciente que presente una trombosis aguda o una trombocitopenia de inicio reciente en un plazo de 42 días después de recibir la vacuna del COVID-19. Las características típicas de laboratorio incluyen trombocitopenia, niveles elevados de dímero D por encima del nivel esperado para el tromboembolismo venoso y fibrinógeno bajo o normal. También se han identificado anticuerpos contra el factor 4 de las plaquetas. Solicite estudios por imágenes el mismo día según la localización de los signos y síntomas para confirmar el lugar de la trombosis. Puede que sea necesario repetir el diagnóstico mediante estudios por imágenes en los pacientes cuyos análisis de sangre sugieren una probable trombocitopenia y trombosis inmunitaria inducida por la vacuna (VITT), pero no se observa trombosis en el diagnóstico por imagen inicial o hay sospecha clínica o de laboratorio de que hay avance de la enfermedad.[1110][1111][1112]
Diferencial: Otras posibles causas de trombocitopenia con trombosis son el cáncer, el síndrome antifosfolípido, la trombocitopenia inducida por heparina, la púrpura trombótica trombocitopénica y la hemoglobinuria paroxística nocturna. Considerar diagnósticos alternativos en personas cuyos análisis de sangre indican que es poco probable que tengan VITT.
Manejo: tratar a pacientes de manera temprana. Consultar a un hematólogo a la hora de tomar decisiones sobre el inicio o al agregado de tratamientos. Hay escasa información sobre el tratamiento óptimo de esta afección; sin embargo, el manejo es similar al de la trombocitopenia inducida por heparina. El tratamiento de primera línea es la administración urgente de inmunoglobulina intravenosa. Se puede considerar una segunda dosis si la respuesta es inadecuada después de 2 o 3 días. Algunos expertos también recomiendan el uso de corticosteroides, especialmente si el tratamiento con inmunoglobulina intravenosa es insuficiente. Se debe iniciar un tratamiento anticoagulante con una terapia no basada en heparina, como un anticoagulante oral directo, fondaparinux, danaparoid o argatroban, según el cuadro clínico, tan pronto como el beneficio supere el riesgo de sangrado. Revisar la respuesta a la anticoagulación si el estado clínico del paciente cambia, y ajustar el tratamiento si es necesario. Evite las transfusiones de plaquetas (salvo en situaciones de emergencia), la heparina (incluida la solución de enjuague de heparina), la heparina de bajo peso molecular y los antagonistas de la vitamina K (p. ej. la warfarina). Puede utilizarse heparina si no se dispone de anticoagulantes no basados en heparina. Considerar el uso de plasmaféresis, la sustitución de fibrinógeno o el rituximab en determinados pacientes. Algunos pacientes pueden requerir cirugía para tratar la trombosis.[1110][1111][1112][1113]
Pronóstico: se ha informado que la mortalidad por complicaciones es del 39%.[1106] Los niveles de fibrinógeno, la edad, el recuento de plaquetas y la presencia de hemorragia intracerebral o trombosis venosa cerebral se asocian significativamente con un mayor riesgo de mortalidad.[1114] Consulte las guías de práctica clínica locales para obtener consejos sobre la vacunación posterior después de un episodio de VITT.
Pueden producirse eventos tromboembólicos distintos de la VITT después de la vacunación con cualquier vacuna COVID-19, pero se producen con mayor frecuencia después de la vacunación con vacunas con vectores de adenovirus. La trombosis venosa fue más frecuente que la arterial. La trombosis venosa cerebral fue la manifestación más frecuente en los pacientes con trombosis venosa, seguida de la trombosis venosa profunda. El infarto de miocardio fue frecuente en los pacientes con trombosis arterial, seguido del accidente cerebrovascular isquémico.[1115] Las vacunas con vectores de adenovirus pueden estar asociadas a una mayor incidencia de embolia pulmonar e infarto de miocardio en la segunda semana tras la vacunación.[1116]
La aspergilosis asociada a COVID-19 (CAPA) puede presentarse en personas que están en estado crítico. Es una causa reconocida de que el estado clínico del paciente no mejore a pesar del tratamiento.[406]
Epidemiología: en un estudio se informó el 10.2% de los pacientes ingresados en la unidad de cuidados intensivos.[1117] Los factores de riesgo incluyen la edad avanzada, la enfermedad pulmonar crónica (incluida la EPOC preexistente), la hepatopatía crónica, las neoplasias malignas hematológicas, la enfermedad cerebrovascular, la diálisis, la ventilación mecánica, la inmunosupresión, la administración de inhibidores de la interleucina (IL)-6 y el uso de corticosteroides en dosis altas.[406][1118][1119][1120]
Diagnóstico: considere el diagnóstico en pacientes que se deterioran a pesar de los cuidados de soporte óptimos o que presentan otras características radiológicas o clínicas sospechosas.[406][1118] No hay signos, ni síntomas específicos. Base sus decisiones en los factores de riesgo individuales y en el estado clínico de la persona, e implique a un equipo multidisciplinar (incluyendo un especialista en enfermedades infecciosas).[406] Se manifiesta frecuentemente como una neumonía por COVID-19 sin las alteraciones comunes de la tomografía computarizada de la aspergilosis pulmonar.[1121] Consulte los protocolos locales sobre el diagnóstico de la aspergilosis asociada a COVID-19 (CAPA).
Pruebas diagnósticas: utilice una serie de pruebas para aumentar la probabilidad de un diagnóstico seguro; incluir un lavado broncoalveolar, si es posible. Pruebe la resistencia a los antifúngicos si se cultiva un aislado de Aspergillus. No solicite pruebas si hay una baja sospecha clínica.[406]
Manejo: se recomienda tratamiento antimicótico. Solo utilice el tratamiento antimicótico si las pruebas diagnósticas respaldan un diagnóstico de CAPA, o si se sospecha de CAPA pero los resultados de las pruebas diagnósticas aún no están disponibles. No hay suficiente evidencia para recomendar antimicóticos específicos. Comente las opciones de tratamiento con un equipo multidisciplinar (incluyendo un especialista en enfermedades infecciosas). Interrumpa el tratamiento si los resultados de las pruebas diagnósticas no respaldan el diagnóstico.[406] Consulte los protocolos locales sobre la gestión de la CAPA.
Pronóstico: se ha descrito una tasa de mortalidad de aproximadamente el 55%.[1117][1119]
La mucormicosis (también conocida como "hongo negro") se ha notificado en contadas ocasiones, sobre todo en países de ingresos bajos y medios, principalmente en la India.[1122] La mucormicosis pulmonar asociada a COVID-19 se diagnostica simultáneamente o en los 3 meses siguientes a la confirmación virológica de COVID-19. Se han publicado definiciones de casos de enfermedad pulmonar probada, probable o posible. Es posible la coinfección con la aspergilosis.[1123]
Epidemiología: aproximadamente el 88% de los casos se informaron en países de renta baja o media.[1124] En la India aumentaron significativamente los casos durante su segunda ola a principios de 2021.[1125] Se han informado casos en otros países, incluido Estados Unidos.[1126] Los factores de riesgo son el sexo masculino, la diabetes no controlada y la inmunosupresión (p. ej., debido a la terapia con corticosteroides).[1127][1128]
Diagnóstico: presentar un bajo umbral de sospecha para el diagnóstico. Es importante no pasar por alto los signos y síntomas de alerta (p. ej., congestión nasal; secreción nasal negruzca/sangrienta; dolor sinusal o facial; dolor de muelas o aflojamiento de dientes; trastornos de la visión; hemoptisis; escaras necróticas en la piel, el paladar o los cornetes nasales). No dude en solicitar las pruebas diagnósticas adecuadas.[1129] La mediana del tiempo transcurrido entre el diagnóstico de COVID-19 y la evidencia de mucormicosis fue de 15 días. La mucormicosis rinorbital fue la más frecuente (42%), seguida de la mucormicosis rinorbitocerebral (24%) y la mucormicosis pulmonar (10%).[1127] Se han informado casos de mucormicosis en sitios atípicos, así como casos en pacientes recuperados de COVID-19.[1130][1131] No dude en solicitar enérgicamente las pruebas diagnósticas que correspondan para detectar la etiología fúngica.[1129] Se recomienda la broncoscopia flexible y el diagnóstico por imagen del tórax para poder diagnosticar precozmente la mucormicosis pulmonar.[1123]
Manejo: las estrategias de manejo incluyen: el manejo de la hiperglucemia, la diabetes o la cetoacidosis diabética; la reducción de la dosis de corticosteroides con el objetivo de interrumpirla rápidamente; la interrupción de los fármacos inmunomoduladores; el desbridamiento quirúrgico extenso para eliminar todo el material necrótico; el tratamiento antimicótico (p. ej., anfotericina-B como terapia inicial, seguido de tratamiento de mantenimiento con posaconazol o isavuconazol o terapia de rescate) durante 4 a 6 semanas; y los cuidados de soporte y la monitorización adecuados. Los pacientes deben estar bajo el cuidado de un equipo multidisciplinar que incluya un especialista en enfermedades infecciosas; un intensivista; un neurólogo; un dentista; un oftalmólogo; un otorrinolaringólogo; y un cirujano.[1123][1129]
Prevención: la prevención pasa por el control de la hiperglucemia; el seguimiento del nivel de glucemia en los pacientes con COVID-19 tras el alta (sean o no diabéticos); y el uso juicioso de corticoides, antibióticos y antifúngicos.[1129]
Complicaciones: se han informado casos infrecuentes de pseudoaneurisma de la arteria pulmonar con mucormicosis pulmonar asociada a COVID-19.[1132]
Pronóstico: la tasa de mortalidad global es del 39%.[1124] La mortalidad global en India (36.5%) fue inferior a la de los casos informados en todo el mundo (61.9%), probablemente debido al predominio de la mucormicosis rino-orbitaria en India.[1125] Entre los factores de riesgo de aumento de la mortalidad figuran la edad avanzada, las comorbilidades específicas, la coinfección por aspergillus y el uso de tocilizumab.[1124] Una proporción significativa de los supervivientes presentó morbilidades que cambiaron su vida (p. ej., pérdida de visión).[1122] Los pacientes con mucormicosis pulmonar y rino-orbito-cerebral (MROC) y los que solo reciben tratamiento médico presentan un mayor riesgo de mortalidad.[1133]
La incidencia global de la candidemia oscila entre el 0.7% y el 23.5%, y la mayoría de los casos se producen en la unidad de cuidados intensivos en pacientes con ventilación mecánica.[1134] Se han informado casos de candidemia por Candida auris, un patógeno emergente multirresistente.[1135] Las razones del aumento de la incidencia en esta población no se conocen bien; sin embargo, los pacientes están expuestos a múltiples factores de riesgo de candidemia, como el tratamiento con corticosteroides, el tratamiento inmunosupresor, los antibióticos y las largas estancias en la unidad de cuidados intensivos. Se ha informado una alta tasa de mortalidad.[1136]
Se ha informado de una lesión pancreática leve (definida como niveles elevados de amilasa o lipasa sérica) en el 17% de los pacientes de una serie de casos.[1137] Se desconoce si se trata de un efecto viral directo o se debe a la respuesta inmunológica perjudicial que se produce en algunos pacientes. Los pacientes tenían un mayor riesgo de pancreatitis grave y pancreatitis necrosante y una mayor duración de la estancia hospitalaria.[1138] Los pacientes con pancreatitis aguda tuvieron una elevada mortalidad conjunta (18.5%) y resultados clínicos significativamente peores.[1139] El síntoma de presentación más común fue el dolor abdominal.[1140] Los antecedentes de pancreatitis no parecen ser un factor de riesgo para la inflamación del páncreas en pacientes con COVID-19.[1141] No se ha establecido una relación causal entre la infección por SARS-CoV-2 y la pancreatitis aguda.[1142]
Se ha informado con poca frecuencia trombocitopenia inmune. La mayoría de los casos fueron en pacientes de más de 50 años de edad, con solo el 7% de los casos informados en niños. La mayoría de los casos se observaron en pacientes con COVID-19 moderado a grave; sin embargo, el 7% de los casos fueron en pacientes COVID-19 asintomáticos. El inicio se produjo en el 20% de los casos 3 semanas después del inicio de los síntomas de COVID-19, con la mayoría de los casos informados después de la recuperación clínica. Los sangrados graves que amenazan la vida son poco frecuentes. El tratamiento consistía en el uso de corticosteroides, inmunoglobulina intravenosa y agonistas de los receptores de trombopoyetina.[1143]
La tiroiditis subaguda es una enfermedad tiroidea de origen viral o posviral. La evidencia sugiere que la infección por SARS-CoV-2 puede desencadenar tiroiditis subaguda, basándose en informes de casos y estudios de casos.[1144] Una revisión de 21 casos encontró un predominio del sexo femenino, siendo la media de días entre el inicio de la enfermedad COVID-19 y el inicio de los síntomas de tiroiditis subaguda de 25 días. La infección se había resuelto en la mayoría de los pacientes antes del inicio de los síntomas de tiroiditis subaguda. La fiebre y el dolor de cuello fueron las quejas más frecuentes. Los síntomas se resolvieron en todos los pacientes después del tratamiento; sin embargo, 5 pacientes declararon tener una enfermedad hipotiroidea en el seguimiento.[1145]
El COVID-19 también puede causar una enfermedad tiroidea autoinmune o exacerbar una enfermedad tiroidea subyacente en remisión. Se han informado casos de enfermedad de Grave, tiroiditis de Hashimoto y tiroiditis postnatal.[1146]
Los pacientes en estado crítico pueden desarrollar complicaciones gastrointestinales; sin embargo, no está claro si se trata de una manifestación de una enfermedad crítica en general, o si es específica de la COVID-19. Un estudio encontró que los pacientes con COVID-19 presentaban más probabilidades de desarrollar complicaciones gastrointestinales en comparación con los que no presentaban COVID-19, específicamente transaminitis, íleo grave e isquemia mesentérica.[1147] En los pacientes con isquemia mesentérica aguda, la isquemia del intestino delgado fue el hallazgo más frecuente en la tomografía computarizada abdominal, seguido de la colitis isquémica. La isquemia mesentérica no oclusiva fue el patrón más común de afectación intestinal.[1148]
Se ha identificado trombosis macrovascular arterial/venosa en casi el 50% de los pacientes con isquemia intestinal. La mortalidad general en los pacientes de COVID-19 con isquemia gastrointestinal y oclusión trombótica mesentérica radiológicamente evidente fue del 38.7% y del 40%, retrospectivamente.[1149] Los pacientes con isquemia intestinal suelen presentar dolor abdominal y vómitos. El manejo incluye descompresión gástrica, fluidos, soporte hemodinámico y cirugía.[1150]
Los pacientes pueden tener un mayor riesgo de sangrado gastrointestinal en comparación con la población general; sin embargo, la evidencia es limitada. La tasa global de sangrado gastrointestinal es del 2%.[1151] Los factores de riesgo de hemorragia gastrointestinal en los pacientes de COVID-19 incluyen los antecedentes de sangrado gastrointestinal y el uso de anticoagulantes.[1152]
El efluvio telógeno agudo, un tipo de pérdida de cabello difusa, se ha informado en pacientes que se recuperan de una infección. La edad media de los pacientes era de 44 años, y la mayoría eran mujeres. La duración media desde el inicio de los síntomas de COVID-19 hasta la aparición del efluvio telógeno fue de 74 días. La mayoría de los pacientes se recuperaron; sin embargo, una minoría de pacientes tuvo una caída de cabello persistente. El estrés puede ser un factor que contribuya.[1153] También se han informado casos de alopecia areata de inicio reciente, así como recidivas o exacerbaciones, tras la infección.[1154]
Hay evidencia de que los pacientes pueden presentar infrecuentes signos, síntomas y características radiológicas y de laboratorio indicativas de la afectación de las vías urinarias inferiores y del sistema genital masculino. Esto puede incluir molestias, hinchazón o dolor escrotal (orquitis aguda, epididimitis o epididimoorquitis); priapismo de bajo flujo; alteración de la espermatogénesis (incluida la disminución del recuento de espermatozoides, la concentración de espermatozoides, la motilidad de los mismos y la morfología normal de los espermatozoides; disminución del nivel de testosterona circulante); hemorragia vesical; retención urinaria aguda; y empeoramiento de los síntomas existentes de las vías urinarias inferiores (incluida la exacerbación de la hiperplasia prostática benigna). Los parámetros del semen parecen volver a la normalidad a medida que los pacientes se recuperan. Se requieren más estudios sobre este tema.[1155][1156][1157][1158][1159][1160]
La parosmia (percepción errónea de un olor) es un síntoma de aparición tardía que puede desarrollarse aproximadamente 3 meses después de la infección. Puede ocurrir sin ninguna pérdida de olor aparente precedente, o puede seguir a un corto período de recuperación de la anosmia inicial. No existen tratamientos eficaces basados en la evidencia; sin embargo, se debe ofrecer al paciente consejos útiles para vivir con la parosmia hasta su recuperación.[586]
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad
