Etiología
virología
El coronavirus del síndrome respiratorio agudo grave 2 (SARS-CoV-2) es un betacoronavirus previamente desconocido que se descubrió en muestras de lavado broncoalveolar tomadas de grupos de pacientes que presentaron neumonía de causa desconocida en la ciudad de Wuhan, provincia de Hubei (China), en diciembre de 2019.[26]
Los coronavirus son una familia numerosa de virus del ácido ribonucleico (RNA) con envoltura, algunos de los cuales causan enfermedades en las personas (p. ej., el resfriado común, el síndrome respiratorio agudo severo [SARS], el síndrome respiratorio de Oriente Medio [MERS]), y otros que se propagan entre mamíferos y aves. Con escasa frecuencia, los coronavirus de animales pueden transmitirse a los seres humanos y posteriormente entre seres humanos, como fue el caso del SRAG y el MERS.
El SARS-CoV-2 pertenece al subgénero de Sarbecovirus de la familia coronaviridae y es el séptimo coronavirus del cual se conoce y que infecta a seres humanos. Se ha encontrado que el virus presenta características similares a las del coronavirus del SARS proveniente de los murciélagos, pero se diferencia del SARS-CoV y del MERS-CoV.[27][28]
Véase la sección Clasificación para obtener información sobre las variantes del SARS-CoV-2.
[Figure caption and citation for the preceding image starts]: Ilustración que revela la morfología ultraestructural que muestra el coronavirus 2 del síndrome respiratorio agudo grave (SARS-CoV-2) cuando se observa bajo el microscopio electrónicoCenters for Disease Control and Prevention [Citation ends].
Origen del virus
La mayoría de los pacientes que se encontraban en las fases iniciales de este brote informaron de un vínculo con el mercado de mariscos de Huanan en el sur de China, un mercado de animales vivos o "mercado mojado", lo que sugiere un origen zoonótico del virus.[29][30][31] Una evaluación inicial de la dinámica de la transmisión en los primeros 425 casos confirmados determinó que el 55% de los casos anteriores al 1 de enero de 2020 estaban vinculados al mercado, mientras que solo el 8.6% de los casos posteriores a esa fecha tenían alguna vinculación con el mercado. Esto sugiere que la propagación de persona a persona se estaba produciendo entre contactos cercanos desde mediados de diciembre de 2019.[31] Otros estudios sugieren que el virus puede haber surgido antes de lo que se pensaba en otros países.[32][33]
No se ha confirmado un origen zoonótico. Algunos estudios sugieren que el SARS-CoV-2 puede ser un virus recombinante entre un coronavirus de murciélago y un coronavirus de origen desconocido, sugiriéndose como posibles huéspedes intermedios los pangolines y los visones. Sin embargo, en la actualidad no hay evidencias que demuestren la posible vía de transmisión de un reservorio de murciélagos al hombre a través de una o varias especies animales intermediarias.[34]
Una evaluación independiente de los orígenes del SARS-CoV-2 concluyó que existen lagunas de datos que impiden determinar con certeza cómo el virus ingresó inicialmente a la población humana.[35]
Dinámica de transmisión
La transmisión respiratoria es el modo de transmisión dominante, siendo la proximidad y la ventilación los principales determinantes del riesgo de transmisión.[36] Las evidencias disponibles sugieren que la transmisión entre personas se produce principalmente cuando una persona infectada está en estrecho contacto con otra. El virus puede propagarse desde la boca o la nariz de una persona infectada en pequeñas partículas líquidas (que varían en tamaño desde gotas más grandes hasta aerosoles más pequeños) cuando la persona tose, estornuda, canta, respira fuertemente o habla. El contacto cercano puede provocar la inhalación o la inoculación del virus a través de la boca, la nariz o los ojos.[37]
La transmisión de aerosoles puede producirse en los entornos sanitarios durante los procedimientos que generan aerosoles. También hay algunos informes de brotes que sugieren que la transmisión por aerosol es posible en la comunidad en determinadas condiciones; sin embargo, esos informes se refieren a espacios cerrados y abarrotados con escasa ventilación en los que la persona infectada puede haber estado respirando fuertemente (p. ej., restaurantes, coros, clases de gimnasia).[37][38] Una prueba diagnóstica detallada de estos grupos sugiere que la transmisión por gotitas y fómites también podría explicar la transmisión en estos informes.[37] Aunque se ha descubierto que el aire cercano y lejano a los pacientes está frecuentemente contaminado con el ARN del SARS-CoV-2, pocas de estas muestras contenían virus viables.[39] El riesgo de transmisión es mucho menor en el exterior que en el interior, con un número limitado de estudios que estiman una tasa de transmisión de <1%.[40][41] Las evidencias de que los tratamientos con nebulizadores aumentan el riesgo de transmisión de coronavirus similares al SARS-CoV-2 no son concluyentes, y las evidencias directas sobre el riesgo de transmisión del SARS-CoV-2 son mínimas.[42]
La transmisión por fómites (por contacto directo con fómites) podría ser posible, pero actualmente no hay evidencias concluyentes de este modo de transmisión. En los pocos casos en que se ha presumido la transmisión del fómites, no se ha descartado completamente la transmisión respiratoria.[36] Aunque la mayoría de los estudios informan de la identificación del virus en superficies inanimadas, faltan evidencias que demuestren la recuperación del virus viable.[43] Es más probable que se identifique el virus competente para la replicación cuando el umbral del ciclo de la reacción en cadena de la polimerasa para las muestras clínicas de los individuos infectados es <30 (es decir, una carga viral alta).[44]
La transmisión fecal-oral (o la transmisión respiratoria a través de las heces en aerosol) puede ser posible, pero solo hay evidencias circunstanciales limitadas que respalden este modo de transmisión.[36]
No se ha informado detransmisión a través de otros fluidos corporales (incluida la transmisión sexual o la transmisión sanguínea).[36][45] Aunque el virus se ha detectado en fluidos corporales (p. ej., semen, orina, líquido cefalorraquídeo, fluidos oculares), la presencia de virus o componentes virales no equivale a infectividad.[46] Existen datos limitados sobre el riesgo de transmisión de los donantes de órganos. Sin embargo, parece haber un bajo riesgo de transmisión con órganos no pulmonares (es decir, riñón, hígado, corazón) procedentes de donantes positivos al SARS-CoV-2, independientemente de que el donante sea sintomático en el momento de la obtención.[47]
La transmisión perinatal (vertical) se produce con escasa frecuencia y se ha documentado la transmisión transplacentaria. Existen escasas evidencias sobre el alcance de la transmisión vertical y sus tiempos de transmisión.[48] Se necesitan más estudios de alta calidad para establecer si se produce la transmisión perinatal.[49] Se han detectado fragmentos virales en la leche materna; sin embargo, este hallazgo es infrecuente y, cuando ocurre, se ha asociado con síntomas leves en los lactantes.[50]
En una revisión se informó la transmisión nosocomialen el 44% de los pacientes; sin embargo, esta revisión se limitó a las series de casos realizadas al principio del brote en Wuhan antes de la toma de medidas adecuadas de prevención y control de la infección.[51] Las infecciones intrahospitalarias representaron aproximadamente el 11.3% de las infecciones en el Reino Unido entre febrero y agosto de 2020 (se informaron tasas de hasta el 25%). Las tasas fueron notablemente más altas en los hospitales residenciales de atención comunitaria (61.9%) y en los hospitales de salud mental (67.5%) en comparación con los hospitales de agudos y de atención general (9.7%).[52][53] En los estudios de los profesionales de salud expuestos a casos iniciales (no en presencia de procedimientos que generen aerosoles) se encontró escasa o ninguna transmisión nosocomial cuando se tomaron precauciones con respecto al contacto y las gotas.[54] El riesgo para el personal sanitario que realiza o asiste una traqueotomía parece ser bajo.[55]
BMJ: visualising SARS-CoV-2 transmission routes and mitigations Opens in new window
Dinámica de la transmisión en relación con los síntomas
La transmisión es más probable si los contactos se exponen poco antes o después del inicio de los síntomas en el paciente índice.
El riesgo de transmisión a los contactos cercanos era mayor si la exposición se producía entre 2 y 3 días desde el inicio de los síntomas en el paciente índice en un estudio. Entre los contactos que se infectaron, la infección asintomática era más frecuente si estaban expuestos a un paciente índice asintomático, lo que sugiere que la gravedad de la enfermedad en el paciente índice puede estar asociada con la presentación clínica de la enfermedad.[56]
La duración media de la infecciosidad en pacientes con enfermedad leve en un entorno comunitario del mundo real (variante preómicron) fue de aproximadamente 5 días (rango de 3 a 7 días) en un estudio. El inicio de los síntomas fue una mediana de 3 días antes del pico de ARN viral y de la carga viral infecciosa. Menos del 25% de los casos eliminan el virus infeccioso antes del inicio de los síntomas. Dos tercios de los casos seguían siendo infecciosos 5 días después del inicio de los síntomas, y un tercio seguía siendo infeccioso a los 7 días.[57]
La transmisión hacia adelante varía según los factores específicos del huésped y del contacto, y la naturaleza de la exposición. Los factores asociados con el aumento de la transmisión incluyen:[58]
Factores ambientales: interior, mala ventilación, hacinamiento, proximidad, instalaciones compartidas, temperatura ambiente fría, baja humedad
Factores del huésped: infección reciente, carga viral elevada, enfermedad grave, edad, presencia de comorbilidades, inmunocomprometidos
Factores de comportamiento: cantar/gritar, toser/estornudar, abrazar/besar, etiqueta de la máscara, higiene de manos, duración del contacto
Factores virales: cambios en el genoma viral vinculados a una mayor transmisibilidad.
Transmisión sintomáticas
La transmisión se produce principalmente a través de gotitas respiratorias o aerosoles durante el contacto cercano con un caso sintomático infectado. La transmisibilidad depende de la cantidad de virus viable que expulsa una persona, del tipo de contacto, del entorno y de las medidas de prevención y control de la infección.[37]
Transmisión presintomática
La transmisión puede producirse durante el periodo de incubación antes de la aparición de los síntomas.
Aunque existen evidencias de la transmisión a partir de personas presintomáticas, hay pocas evidencias sobre la frecuencia con la que esto puede ocurrir y las tasas de transmisión estimadas son muy variables.[59][60]
Solo el 7% de las personas expuestas a un caso índice presintomático se infectaron en una revisión sistemática.[61] Tras la inoculación experimental controlada con el virus SARS-CoV-2, solo el 7% de las emisiones de virus al aire y al medio ambiente se produjeron antes del primer síntoma declarado, lo que sugiere que la transmisión presintomática es responsable de una pequeña fracción de las infecciones.[62]
Las personas que no presentan síntomas pueden ser presintomáticas o pueden permanecer asintomáticas de manera persistente.
Transmisión asintomática
Se ha informado la transmisión de casos asintomáticos (casos confirmados en el laboratorio que nunca presentan síntomas); sin embargo, la mayor parte de las evidencias se basan en los primeros datos de China y tienen limitaciones (p. ej., un pequeño número de casos, los casos pueden haber sido presintomáticos).[63][64][65][66][67][68] Numerosos estudios han informado de que no hay evidencias de transmisión asintomática de los portadores del SRAS-CoV-2, incluido un amplio estudio en casi 10 millones de residentes en Wuhan.[69][70][71][72] Sólo el 1% de las personas expuestas a un caso índice asintomático se infectaron en una revisión sistemática, lo que sugiere una infectividad limitada.[61]
Las evidencias sobre la dinámica de transmisión asociada a la variante Omicron son dispares: algunos estudios sugieren que los casos sintomáticos presentaban más probabilidades de transmitir la infección en comparación con los casos asintomáticos, y otros estudios no muestran diferencias.[73]
Es difícil estimar la prevalencia de los casos asintomáticos en la población. Una revisión sistemática y un metanálisis en vivo encontraron que el rango intercuartil para la proporción de casos persistentemente asintomáticos era del 14% al 50% en todos los estudios; sin embargo, la heterogeneidad era alta, por lo que el estudio no estimó una proporción media de infecciones asintomáticas globales.[74] Un metanálisis de más de 130,000 personas encontró que el 21.7% permaneció asintomático a lo largo de la infección (tras excluir los casos presintomáticos). El análisis de subgrupos mostró que la tasa global de infecciones asintomáticas fue mayor en las mujeres embarazadas (48.8%) y en los niños (32.1%). Los estudios africanos informaron la tasa de infección asintomática más elevada, mientras que los estudios asiáticos informaron la más baja.[75] Se ha estimado que el porcentaje conjunto de infecciones asintomáticas es del 25.5% al 32.4% entre los pacientes infectados con la variante ómicron.[76]
Los profesionales de salud pueden desempeñar un papel en la transmisión asintomática. Alrededor del 7.6% de los profesionales de salud que trabajaron en unidades hospitalarias con pacientes infectados dieron positivo en las pruebas de anticuerpos contra el SARS-CoV-2; sin embargo, sólo el 58% de estos trabajadores informaron síntomas previos.[77]
Aunque hay algunas evidencias de que los niños de más edad presentan tasas más altas de enfermedad asintomática que los bebés <1 año de edad, la mayoría de los niños presentan enfermedad sintomática y no parecen ser propagadores silenciosos de la infección.[20]
Eventos superpropagadores
Los eventos de supercontagio se asocian a un crecimiento explosivo al principio de un brote y a una transmisión sostenida en etapas posteriores. Algunos ejemplos son las reuniones religiosas o de la iglesia, las reuniones familiares o sociales, los ensayos del coro, las actividades deportivas recreativas en interiores, los clubes nocturnos, los restaurantes, las conferencias de negocios y el trabajo en centros de llamadas. También se ha informado una transmisión generalizada en instalaciones de cuidados a largo plazo, refugios para personas sin hogar, prisiones e instalaciones de procesamiento de carne y aves de corral, así como a bordo de cruceros.[78]
Se ha informado una transmisión limitada en guarderías, escuelas y universidades.[79][80] Hay escasas evidencias de alta calidad para cuantificar el alcance de la transmisión en las escuelas, o para compararla con la transmisión en la comunidad. Sin embargo, los datos indican que la tasa global de ataques de infección en el personal escolar (1.18%) es inferior a la de los estudiantes (1.66%). La evidencia sugiere que la tasa global de ataques de infección y la tasa de positividad del SARS-CoV-2 en los entornos escolares son bajas.[81][82] Durante los periodos de baja incidencia de la infección en la población local en las escuelas con intervenciones no farmacéuticas en marcha, el riesgo para el personal escolar no suele ser mayor que el de la población general y no es comparable al de otras profesiones de alto riesgo (p. ej., el personal sanitario). Los estudios que informan sobre períodos de alta incidencia de la infección son limitados, pero muestran un mayor riesgo para el personal escolar en estas circunstancias.[83] En un estudio, la infección en los contactos cercanos en las escuelas secundarias y colegios de Inglaterra era poco frecuente (aproximadamente el 2%).[84]
Algunas personas son supereliminadores del virus, pero las razones que subyacen a los eventos de supercontagio son a menudo más complejas que el simple exceso de eliminación de virus y pueden incluir una variedad de factores de comportamiento, de huésped y ambientales.[85]
Factores de transmisión viral
Periodo de incubación
Se ha estimado que el periodo de incubación es de entre 1 y 14 días, con una mediana de 5 a 7 días.[86][87][88] El periodo de incubación ha disminuido gradualmente del virus de tipo salvaje (5.2 días) a la variante Omicron (3.42 días). El periodo de incubación agrupado global fue de 6.57 días (rango de 1.8 a 18.87 días), y fue mayor en los adultos de edad avanzada (7.43 días) y en los niños (8.82 días).[89]
Número de reproducción (R₀)
Una revisión y un análisis sistemáticos estimaron que el número de reproducciones era de 2.69 (basado en la bibliografía publicada de enero a agosto de 2020). Sin embargo, el R₀ difiere en función de varios factores.[90]
Tasa de ataque secundario
La tasa conjunta de ataques secundarios entre todos los contactos cercanos de un caso índice se ha estimado en un 7%, basándose en datos de los primeros momentos de la pandemia.[91] Sin embargo, la tasa varió entre los entornos de contacto con una tasa estimada del 18.9% al 37.3% en entornos domésticos, el 42% entre los residentes en centros de atención a la tercera edad, el 3.6% en los centros de atención médica, del 1.2% al 5.9% en entornos sociales y el 1.9% en los lugares de trabajo. La tasa es mayor para los casos índice sintomáticos en comparación con los asintomáticos y para los adultos en comparación con los niños.[74][92][93][94][95][96] La tasa en niños y jóvenes fue mayor en los entornos domésticos en comparación con los entornos escolares.[97] La tasa de ataques secundarios en entornos domésticos debidos a la transmisión de un caso pediátrico índice osciló entre el 0% y el 75% en todos los estudios.[98] Las tasas de ataque secundario para la variante ómicron es mayor en comparación con otras variantes del SARS-CoV-2.[95][99]
Carga viral
La carga viral parece ser uno de los principales impulsores de la transmisión del virus; las cargas virales más elevadas se asocian a un aumento de las tasas de ataques secundarios y a un mayor riesgo de desarrollar una enfermedad sintomática.[100] La carga viral es mayor en las vías respiratorias altas (nasofaringe y orofaringe) al principio del curso de la infección (por lo general, alcanza su máximo en la primera semana de la enfermedad), y posteriormente aumenta en las vías respiratorias bajas (esputo). La carga viral disminuye después del inicio de los síntomas. Los pacientes con enfermedades graves presentan cargas virales más elevadas comparadas con los que tienen enfermedades leves. La carga viral en las vías respiratorias altas es comparable en los pacientes asintomáticos y sintomáticos; sin embargo, la mayoría de los estudios demuestran una eliminación más rápida del virus entre las personas asintomáticas en comparación con las sintomáticas.[101]
Eliminación viral
La duración media de la excreción viral depende de la muestra: 17 días en las vías respiratorias altas (máximo 83 días); 14.6 días en las vías respiratorias bajas (máximo 59 días); y 17.2 días en las heces (máximo 126 días). La duración de la excreción fue mayor en los pacientes sintomáticos en comparación con los asintomáticos, en los niños en comparación con los adultos, y en los pacientes con enfermedad grave en comparación con los que no tenían enfermedad grave.[101][102] Los pacientes inmunocomprometidos pueden eliminar durante al menos 2 meses.[103] Hay informes de casos de supereliminación viral que eliminan la carga viral durante periodos de tiempo prolongados (el más largo fue un caso que dio positivo durante 505 días).[104] No hay evidencias convincentes de que la duración de la excreción del virus se correlacione con la duración de la infecciosidad.[105] No se ha aislado ningún virus viable en pacientes con enfermedad leve o moderada después de 10 días de síntomas, o después de 20 días en aquellos con enfermedad grave o crítica, a pesar de la continua eliminación del virus.[36] Las personas totalmente vacunadas pueden presentar una menor duración de la excreción viable en comparación con las personas parcialmente vacunadas o no vacunadas.[106]
La duración conjunta de la excreción del virus viable fue de 5.2 días para la variante Ómicron, siendo la duración ligeramente superior en los pacientes sintomáticos en comparación con los asintomáticos (aunque la diferencia no fue significativa).[107]
病理生理学
La fisiopatología exacta es desconocida, en parte debido a la escasez de estudios postmortem.[108] La fisiopatología se asemeja a la de otras infecciones por coronavirus. Sin embargo, algunas evidencias indican que el COVID-19 presenta características fisiopatológicas distintivas que la diferencian de la insuficiencia respiratoria de otros orígenes.[109]
El SARS-CoV-2 se adhiere al receptor de la enzima convertidora de angiotensina-2 (ACE2) en las células huésped objetivo, seguido de la internalización y replicación del virus. Los receptores de la ECA2 se expresan en gran medida en las células del tracto respiratorio superior e inferior, pero también se expresan en las células del miocardio, las células epiteliales renales, los enterocitos y las células endoteliales de múltiples órganos, lo que puede explicar las manifestaciones extrapulmonares asociadas a la enfermedad.[110] Se ha identificado ARN viral en muchos órganos en estudios postmortem.[108]
[Figure caption and citation for the preceding image starts]: Complicaciones multiorgánicas de COVID-19 y COVID largo. El virus SARS-CoV-2 consigue entrar en las células de múltiples órganos a través del receptor ACE2BMJ. 2021;374:n1648 [Citation ends].
El virus utiliza la proteasa transmembrana serina 2 del huésped (TMPRSS2) para el cebado de la proteína viral y la fusión de las membranas de las células virales y del huésped.[111] La proteína de pico del SARS-CoV-2 desempeña un papel fundamental en el reconocimiento del receptor ACE2 y en el proceso de fusión de la membrana celular. Una característica estructural única del dominio de unión al receptor de la glicoproteína de pico confiere una afinidad de unión potencialmente mayor para la ACE2 en las células huésped en comparación con el SARS-CoV-1.[112] Este sitio de clivaje tipo furina no parece existir en otros coronavirus.[113] La energía de unión entre la proteína de pico y la ACE2 fue la más alta para los seres humanos de todas las especies probadas en un estudio, lo que sugiere que la proteína de pico ha evolucionado de forma única para unirse a las células humanas que expresan ACE2 e infectarlas.[114] Las evidencias sugieren que la proteína de pico, por sí sola, puede dañar las células endoteliales al regular a la baja la ECA2 y, en consecuencia, inhibir la función mitocondrial. Hay que seguir investigando si la proteína de pico puede desencadenar por sí misma una señalización celular que podría dar lugar a diversos procesos biológicos.[115][116] Las variantes del SARS-CoV-2 pueden ser más transmisibles, al menos en parte, debido a una mayor afinidad de unión de la proteína de pico al receptor ACE2.[117]
[Figure caption and citation for the preceding image starts]: Ciclo de replicación del virusBMJ. 2020;371:m3862 [Citation ends].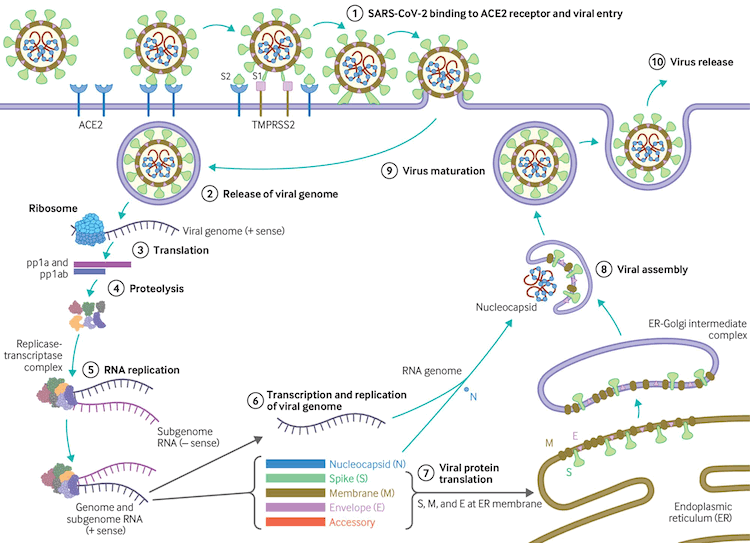
Además de la lesión vírica citopática directa, la enfermedad grave suele complicarse con una microangiopatía inducida por la infección o un estado de hipercoagulabilidad que provoca trombosis capilar, venosa y/o arterial, lo que puede provocar daños en los órganos finales debido a una enfermedad trombótica o embólica a distancia. Se han identificado microtrombos generalizados en casi todos los órganos en estudios postmortem. Los hallazgos patológicos predominantes en los casos mortales fueron el daño alveolar difuso, la coagulopatía y el compromiso hemodinámico. La afectación de órganos no pulmonares se limitó a una inflamación parenquimatosa leve (p. ej., miocarditis, hepatitis, encefalitis). La lesión citopática viral directa de los órganos extrapulmonares en general no se consideraba la causa del fallo orgánico.[108][110][118] La mayoría de los hallazgos en órganos no pulmonares estaban relacionados con enfermedades crónicas.[119] La endotelitis inducida por el SARS-CoV-2 puede desempeñar un papel, tanto en las manifestaciones respiratorias, como en las no respiratorias.[120]
En el tejido pulmonar postmortem han surgido tres fenotipos tisulares principales: un fenotipo clásico caracterizado por un daño alveolar difuso progresivo, una bronconeumonía por infección secundaria y una trombosis tisular. Estos fenotipos no son mutuamente excluyentes y pueden superponerse.[121] La enfermedad pulmonar grave es consecuencia de la remodelación fibrótica y la microisquemia lobular secundaria, lo que da lugar a una forma distintiva de enfermedad pulmonar intersticial fibrótica.[122]
La placentitis por SARS-CoV-2 es una entidad patológica distinta que se ha informado en mujeres embarazadas, y se caracteriza por la deposición masiva de fibrina perivillosa y la intervillositis histiocítica crónica. Se asocia a un mayor riesgo de pérdida del embarazo.[123]
Los factores genéticos pueden desempeñar un papel en la susceptibilidad a la infección y la gravedad de la enfermedad; sin embargo, es necesario seguir investigando.[124][125]
Classification
Clasificación de la variante del coronavirus del síndrome respiratorio agudo grave 2 (SARS-CoV-2)
Todos los virus, incluyendo el SARS-CoV-2, evolucionan con el tiempo. La mayoría de los cambios tienen poco o ningún impacto en las propiedades del virus; sin embargo, algunos cambios pueden afectar a la transmisión del virus, la gravedad de la enfermedad y el rendimiento de las pruebas diagnóstica, la terapéutica o las vacunas.
Las variantes SARS-CoV-2 han ido surgiendo y circulando por todo el mundo desde el comienzo de la pandemia, son objeto de una monitorización rutinaria y se clasifican como variantes bajo monitorización, variantes de interés o variantes preocupantes por parte de la Organización Mundial de la Salud (OMS).[2] Estos sistemas de clasificación pueden variar según el país.
La OMS asigna etiquetas sencillas a las variantes preocupantes utilizando letras del alfabeto griego. Anteriormente, las etiquetas griegas también se utilizaban para denominar variantes de interés, pero esto ya no será así. Este etiquetado no sustituye a los nombres científicos existentes (p. ej., Pango, Nextstrain, GISAID), que siguen utilizándose en la investigación.[2]
Variante bajo vigilancia
La OMS define una variante bajo vigilancia como una variante con cambios genéticos que se sospecha que afectan a las características del virus y las primeras señales de ventaja de crecimiento en relación con otras variantes circulantes (p. ej., ventaja de crecimiento que puede aparecer a nivel mundial o en una sola región de la OMS), pero para la que las evidencias de impacto fenotípico o epidemiológico siguen sin estar claras, lo que requiere una monitorización reforzada y una reevaluación, en espera de nuevas evidencias. Si una variante tiene un número inusualmente grande de mutaciones en sitios antigénicos conocidos, pero con muy pocas secuencias y no es posible estimar su ventaja relativa de crecimiento, dicha variante también puede ser designada como variante bajo vigilancia si también hay evidencia de transmisión comunitaria en dos o más países dentro de un período de 2 a 4 semanas.[3]
Variante de interés
La OMS define una variante de interés como una variante con cambios genéticos que se pronostica o se sabe que afectan a las características del virus, como la transmisibilidad, la virulencia, la evasión de anticuerpos, la susceptibilidad a la terapéutica y la detectabilidad; e identificada por tener una ventaja de crecimiento sobre otras variantes circulantes en más de una región de la OMS con una prevalencia relativa creciente junto con un número creciente de casos a lo largo del tiempo, u otros impactos epidemiológicos aparentes que sugieren un riesgo emergente para la salud pública mundial.[3]
Variante preocupante
La OMS define una variante preocupante como una variante que cumple la definición de variante de interés (véase más arriba) y que, según se ha determinado con un nivel de confianza moderado o alto (mediante una evaluación del riesgo realizada por la OMS), cumple al menos uno de los siguientes criterios cuando se compara con otras variantes:[3]
Cambio perjudicial en la gravedad clínica de la enfermedad, o
Cambio en la epidemiología que causa un impacto sustancial en la capacidad de los sistemas de salud para proporcionar atención a los pacientes con COVID-19 u otras enfermedades y, por lo tanto, requiere intervenciones importantes de salud pública, o
Disminución significativa de la eficacia de las vacunas disponibles en la protección contra enfermedades graves.
Antiguas variantes que suscitaban preocupación
Las variantes preocupantes del SARS-CoV-2 ya se han extinguido, y las variantes de interés que circulan actualmente y las variantes que se están vigilando son las diversas subvariantes de ómicron (véase más abajo). Las variantes se han ido sustituyendo secuencialmente desde el inicio de la pandemia, siendo las variantes más exitosas las variantes alfa (B.1.1.7), Delta (B.1.617.2) y ómicron (B.1.1.529). Alfa y delta surgieron a finales de 2020 y ómicron surgió a finales de 2021. Beta (B.1.351) y Gamma (P.1) también fueron variantes preocupantes.[4]
La variante alfa era más transmisible que el virus de tipo natural, y se asociaba a un mayor riesgo de ingreso hospitalario e ingreso en la unidad de cuidados intensivos (lo que sugiere una enfermedad más grave), pero no de mortalidad, en comparación con el virus de tipo natural, aunque los datos son contradictorios. No se ha asociado a cambios en los síntomas declarados ni en su duración.[5][6][7][8]
La variante delta fue más transmisible que el virus natural y la variante alfa, y se asoció con un mayor riesgo de ingreso hospitalario (lo que sugiere una enfermedad más grave) en comparación con los casos del mismo período de alfa y beta. Sin embargo, había un alto nivel de incertidumbre en los resultados. La tasa de letalidad bruta fue menor que la de la variante alfa.[9]
Variante ómicron
La variante ómicron comprende el linaje parental B.1.1.529 y sus linajes descendientes (o subvariantes) BA.1, BA.2, BA.3, BA.4 y BA.5, así como sus diversos sublinajes. Las subvariantes de ómicron están actualmente en circulación.
La OMS considera la clasificación de los sublinajes de ómicron independientemente como variantes bajo vigilancia, variantes de interés o variantes preocupantes. Anteriormente, todos los sublinajes de ómicron se clasificaban como parte de la variante preocupante de ómicron. Esta clasificación no tenía la granularidad necesaria para comparar nuevos linajes descendientes con fenotipos alterados con los linajes parentales de ómicron BA.1, BA.2, BA.3, BA4 y BA.5.[10]
Ómicron es una variante muy divergente con un elevado número de mutaciones. No existe ninguna vía de transmisión que vincule a ómicron con sus predecesores (alta, delta), y se ha estimado que su ancestro genético más cercano conocido se remonta probablemente a algún momento posterior a mediados de 2020.[11] Los casos se informaron por primera vez en Sudáfrica en noviembre de 2021. La variante Ómicron mostró una ventaja de crecimiento sustancial sobre Delta, y sustituyó rápidamente a Delta en todo el mundo. La variante ómicron se ha convertido en la variante dominante en muchos países, y representa más del 98% de las secuencias disponibles públicamente desde febrero de 2022.[10]
Las evidencias sugieren una menor gravedad de la enfermedad y una menor mortalidad para la variante Ómicron en comparación con la variante delta, tras ajustar los efectos de confusión de la edad, el sexo, el origen étnico, la infección previa, el estado de vacunación, las comorbilidades y el efecto de la provincia y el efecto del sector público/privado.[12][13] La mayoría de las muertes se produjeron en adultos de edad ≥65 años y en pacientes con ≥3 afecciones clínicas subyacentes.[14] Las evidencias de los estudios en animales y los cultivos ex vivo de las vías respiratorias altas y bajas del ser humano sugieren que ómicron no infecta las células de la profundidad del pulmón tan fácilmente como lo hace con las células de las vías respiratorias altas.[15][16] La transmisión, la gravedad de la enfermedad/tasa de ingreso hospitalario y la eficacia de la vacuna pueden variar en función del sublinaje ómicron específico. Las variantes recientes no parecen causar una enfermedad más grave en comparación con las variantes anteriores.[2]
A lo largo de la pandemia se han identificado varias variantes recombinantes del SARS-CoV-2, y la gran mayoría no parecen conferir ninguna ventaja al virus.
Variantes que circulan actualmente
Actualmente no hay variantes de preocupación circulantes, pero hay variantes de interés y variantes bajo monitoreo. Consulte a su autoridad local de salud pública para obtener la información más actualizada sobre las variantes que circulan en su zona. Están disponibles los siguientes recursos:
Use of this content is subject to our disclaimer
