Recommendations
Key Recommendations
El manejo depende predominantemente de la gravedad de la enfermedad y se centra en los siguientes principios: medidas de prevención y control de infecciones; manejo de los síntomas; prevención de la progresión de la enfermedad; cuidados de soporte optimizados; y soporte de órganos en enfermedades graves o críticas.
Se debe considerar si el paciente puede ser manejado en casa. En general, se puede tratar a los pacientes con enfermedad asintomática o de leve a moderada en casa.[86] Proporcionar alivio de los síntomas según sea necesario, incluyendo tratamientos para la fiebre o la tos.[86][406] Considerar el tratamiento antiviral para pacientes con enfermedad no grave que tienen un riesgo moderado a alto de hospitalización.[406][407]
Ingrese a los pacientes con enfermedad grave a un centro sanitario adecuado. Se debe evaluar a los adultos por su fragilidad en el momento del ingreso. Los pacientes con enfermedades críticas requieren cuidados intensivos; se debe implicar al equipo de cuidados intensivos en la toma de decisiones sobre el ingreso en la unidad de cuidados críticos cuando sea necesario. Se debe monitorizar a los pacientes estrechamente para detectar signos de avance de la enfermedad.[86][406]
Se deben iniciar los cuidados de soporte, de acuerdo con la presentación clínica. Esto podría incluir el alivio de los síntomas, la oxigenoterapia, los fluidoterapia intravenosa, la profilaxis del tromboembolismo venoso, el oxígeno nasal de alto flujo (HFNO), la ventilación mecánica no invasiva o invasiva, o la oxigenación por membrana extracorpórea. La sepsis y el shock séptico deben manejarse, de acuerdo a los protocolos locales.[86]
Se deben considerar los antibióticos empíricos si existe sospecha clínica de infección bacteriana secundaria. Es posible que sea necesario el uso de antibióticos en pacientes con enfermedad moderada, grave o crítica. Se debe administrar en el plazo de 1 hora a partir de la evaluación inicial a los pacientes para los que haya sospecha de sepsis, o si el paciente cumple con los criterios de alto riesgo. El régimen debe estar basado en el diagnóstico clínico, los datos locales de epidemiología y susceptibilidad y las guías de práctica clínica locales de tratamiento.[86][406]
Considere la posibilidad de un tratamiento con corticosteroides sistémicos en pacientes con enfermedad grave o crítica. Las evidencias de calidad moderada sugieren que los corticoesteroides sistémicos probablemente reducen la mortalidad a los 28 días en pacientes con enfermedad grave y crítica.[402][406][407]
Considere la posibilidad de uso del antiviral remdesivir en pacientes con enfermedad grave. Las evidencias de baja certeza sugieren que el remdesivir posiblemente reduce la mortalidad, y las evidencias de certeza moderada sugieren que el remdesivir probablemente reduce la necesidad de ventilación mecánica.[402][406][407]
Considere la opción de uso de un inhibidor de la interleucina (IL)-6 (tocilizumab o sarilumab) y/o un inhibidor de la cinasa Janus (JAK)(baricitinib) en pacientes con enfermedad grave o crítica. Las evidencias de alta certeza indican que los inhibidores de la IL-6 reducen la mortalidad y la necesidad de ventilación mecánica. Las evidencias de alta certeza sugieren que el baricitinib reduce la mortalidad, y las evidencias de certeza moderada sugieren que probablemente reduce la duración de la ventilación mecánica.[402][406][407]
Se debe evaluar si el paciente requiere alguna rehabilitación o seguimiento después del alta hospitalaria. Suspenda las precauciones basadas en la transmisión (incluido el aislamiento) y dé de alta a los pacientes de la vía de atención de acuerdo con sus guías de orientación locales.[86]
Aplique los procedimientos locales de prevención y control de infecciones en el manejo de los pacientes. En el caso de los pacientes que se encuentran confinados en sus casas, se debe recomendar a los pacientes, y a las personas que forman parte de la misma familia, que sigan las medidas adecuadas de prevención y control de infecciones:
Las orientaciones sobre el momento de interrumpir el confinamiento varían mucho de un lugar a otro.
Los periodos de confinamiento, si procede, pueden depender de varios factores, incluidas las variantes circulantes del SRAS-CoV-2 y los factores del paciente (p. ej., inmunocompetente/inmunocomprometido, asintomático/sintomático, gravedad de la enfermedad).
La Organización Mundial de la Salud (OMS) recomienda 10 días de confinamiento para pacientes sintomáticos y 5 días de confinamiento para pacientes asintomáticos (basándose en evidencias de muy baja certeza). Las pruebas rápidas de detección de antígenos pueden utilizarse para reducir el periodo de aislamiento.[86]
Algunos países recomiendan ahora periodos de confinamiento tan cortos como de 5 a 7 días, y algunos ya no recomiendan un periodo de confinamiento en absoluto.
Consulte la guía de salud pública local para obtener más información.
Las opciones de tratamiento dependen de factores como la gravedad de la enfermedad, la disponibilidad y las directrices locales.
La Organización Mundial de la Salud (OMS) recomienda firmemente los corticosteroides, los inhibidores de IL-6 o los inhibidores de JAK (baricitinib) para los pacientes con enfermedad grave o crítica, y el nirmatrelvir/ritonavir para los pacientes con enfermedad no grave que tienen un alto riesgo de hospitalización. Hace recomendaciones débiles o condicionales a favor del molnupiravir o el remdesivir para los pacientes con enfermedad no grave que tienen un alto riesgo de hospitalización, el nirmatrelvir/ritonavir para los pacientes con enfermedad no grave que tienen un riesgo moderado de hospitalización y el remdesivir para los pacientes con enfermedad grave.[407][663][664]
[Figure caption and citation for the preceding image starts]: Resumen de las opciones terapéuticas de la OMSBMJ. 2023 Nov 9:383:2622 [Citation ends].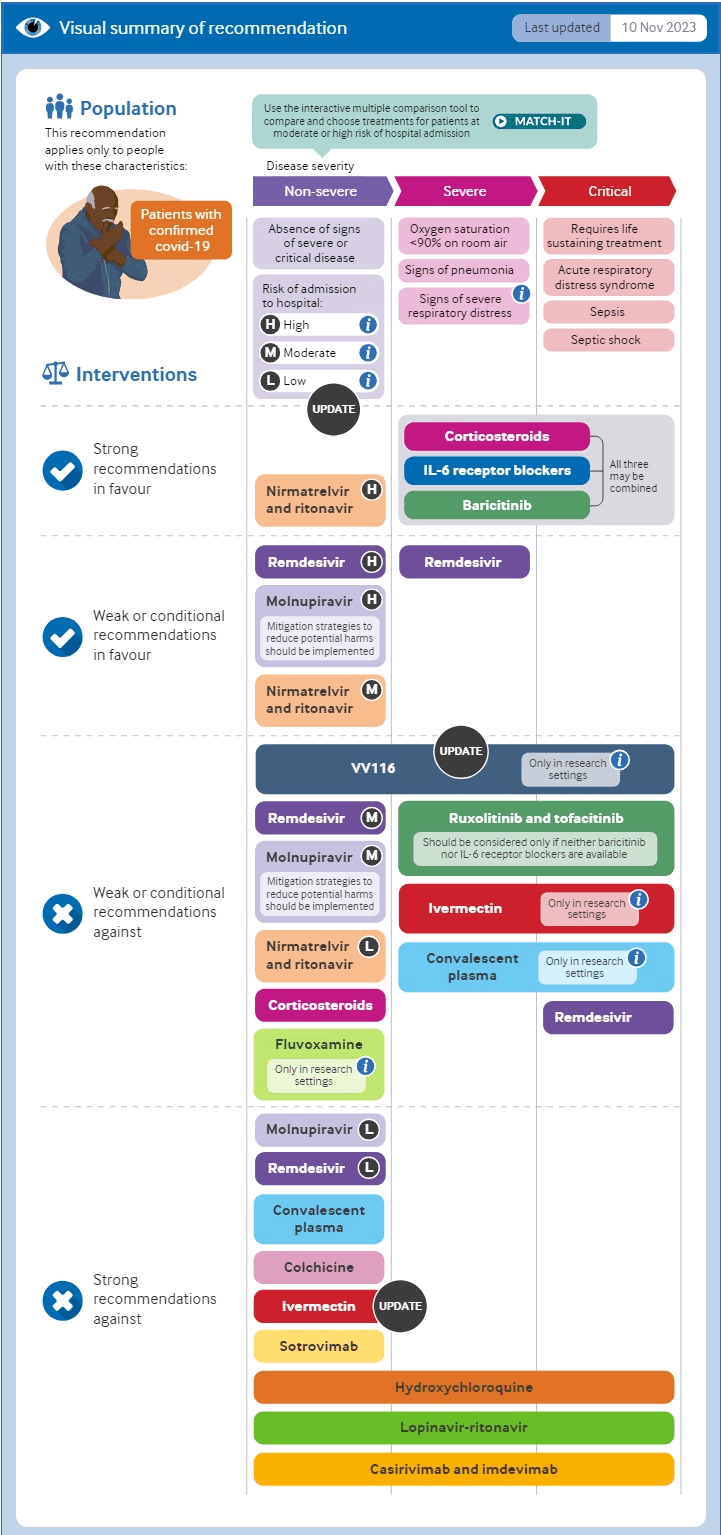
Las recomendaciones de manejo de este tema se basan en las guías de práctica clínica de la OMS, así como en las orientaciones clave del National Institute for Health and Care Excellence (NICE) del Reino Unido y la Sociedad Estadounidense de Enfermedades Infecciosas (IDSA). Consulte las guías de práctica clínica locales para obtener información más detallada o específica.
La mayoría de los pacientes presentan una enfermedad leve a moderada que no justifica la intervención médica ni el ingreso hospitalario, dependiendo de la variante de SARS-CoV-2 circulante. La proporción conjunta de enfermedad no grave en personas infectadas con la variante ómicron fue del 98%, y la proporción conjunta de infección asintomática fue del 25% (las proporciones variaron según el estado de vacunación).[445] Para conocer las definiciones de gravedad, consulte Criterios.
Lugar de la atención
Atienda a los pacientes en un centro sanitario, en un centro comunitario o en su domicilio según las orientaciones de su autoridad local de salud pública. En la mayoría de los pacientes puede considerarse el tratamiento a domicilio, con telemedicina o visitas a distancia según convenga. Se debe manejar a los pacientes con alto riesgo de deterioro en un centro de atención médico.[86][665]
La decisión de tratar a los pacientes en su domicilio requiere un juicio clínico cuidadoso y debe basarse en una evaluación del entorno doméstico del paciente para garantizar que:[665]
Se pueden cumplir las medidas de prevención y control de infecciones y otros requisitos (p. ej., higiene básica, ventilación adecuada)
El cuidador es capaz de proporcionar cuidados y reconocer cuándo el paciente puede estar deteriorándose
El cuidador cuenta con el soporte adecuado (p. ej., alimentos, suministros, apoyo psicológico)
Se dispone del soporte de un profesional de salud formado en el entorno comunitario.
Manejo de síntomas
Fiebre y dolor: se recomienda paracetamol o ibuprofeno.[86][406] El ibuprofeno solo debe tomarse en la dosis eficaz más baja durante el período más breve necesario para controlar los síntomas.
Tos: aconseje a los pacientes que eviten acostarse boca arriba, ya que esto hace que la tos sea ineficaz, y que sigan las guías de práctica clínica locales para tratar la tos aguda.[406]
Disfunción olfativa: considere el tratamiento (p. ej., entrenamiento olfativo, corticosteroides intranasales) si la disfunción olfativa persiste más allá de 2 semanas. A menudo mejora espontáneamente y no requiere un tratamiento específico.[668][669]
Una revisión de la Cochrane encontró que existen evidencias muy limitadas con respecto a la eficacia y los daños de diferentes intervenciones para prevenir o tratar la disfunción olfatoria persistente después de una infección. La única evidencia disponible es para los corticosteroides intranasales (para la prevención), y esta es de muy baja certeza, por lo que no se pudieron extraer conclusiones.[670][671]
Una revisión sistemática y un metanálisis encontraron que no había diferencias significativas en la mejoría de las puntuaciones olfativas con corticoides intranasales u orales más entrenamiento olfativo en comparación con el entrenamiento olfativo en solitario. La función olfativa mejoró significativamente tras el entrenamiento olfativo.[672] Se ha descubierto que el entrenamiento olfativo por sí solo produce mejoras significativas en la disfunción olfativa crónica después de COVID-19; el cumplimiento del protocolo y la mayor duración del tratamiento (generalmente ≥3 meses) mejoran los resultados del tratamiento.[673]
Cuidados de soporte
Se debe aconsejar a los pacientes sobre una nutrición y rehidratación adecuada. Aconseje a los pacientes que beban líquidos regularmente para evitar la deshidratación. Las necesidades de ingesta de líquidos pueden ser mayores de lo habitual debido a la fiebre. Sin embargo, un exceso de líquido puede empeorar la oxigenación.[86][406]
Recomiende a los pacientes que mejoren la circulación del aire abriendo una ventana o una puerta.[406]
Se debe proporcionar salud mental básica y apoyo psicosocial a todos los pacientes, y manejar cualquier síntoma de insomnio, depresión o ansiedad según sea indicado.[86]
Antivirales
Se han aprobado fármacos antivirales, o bien tienen una autorización de uso de emergencia en la mayoría de los países. Las opciones incluyen lo siguiente:
Nirmatrelvir/ritonavir: el nirmatrelvir es un inhibidor oral de la proteasa del SARS-CoV-2. Se administra con una dosis baja de ritonavir para ralentizar el metabolismo hepático del nirmatrelvir y aumentar la concentración plasmática del nirmatrelvir hasta un nivel terapéutico
Molnupiravir: un análogo nucleósido oral del SARS-CoV-2
Remdesivir: un inhibidor de la ARN polimerasa por vía intravenosa.
La Organización Mundial de la Salud (OMS) recomienda encarecidamente el nirmatrelvir/ritonavir en pacientes con enfermedad no grave que tienen un alto riesgo de hospitalización, y recomienda condicionalmente el nirmatrelvir/ritonavir en pacientes con enfermedad no grave que tienen un riesgo moderado de hospitalización. Sugiere el uso de molnupiravir o remdesivir en pacientes con enfermedad no grave que presentan un alto riesgo de hospitalización si no se dispone de nirmatrelvir/ritonavir, pero sugiere no utilizar estos fármacos en pacientes que presentan un riesgo moderado de hospitalización. El tratamiento antiviral no se recomienda en pacientes con bajo riesgo de hospitalización (la mayoría de los pacientes). Para las definiciones de riesgo, véase «Organización Mundial de la Salud (OMS): riesgo de hospitalización para pacientes con enfermedad no grave» en Criterios.[407][663][664]
El nirmatrelvir/ritonavir es una opción con resultado superior a otros tratamientos para la enfermedad no grave porque puede tener una mayor eficacia en la prevención del ingreso hospitalario en comparación con las alternativas, tiene menos preocupaciones con respecto a los daños que el molnupiravir y es más fácil de administrar que el remdesivir intravenoso. Sin embargo, presenta interacciones farmacológicas importantes y complejas.
La recomendación de usar nirmatrelvir/ritonavir se basa en evidencia de certeza alta que sugiere que nirmatrelvir/ritonavir probablemente reduce el ingreso hospitalario, y evidencia de certeza moderada a alta que sugiere que puede reducir la mortalidad dependiendo del riesgo de hospitalización del paciente.
La recomendación de usar remdesivir se basa en evidencia de certeza moderada que sugiere que el remdesivir probablemente reduce el ingreso hospitalario y reduce la mortalidad y la ventilación mecánica.
La recomendación de usar molnupiravir se basa en evidencia de certeza moderada que sugiere que el molnupiravir probablemente reduce el ingreso hospitalario, el tiempo hasta la resolución de los síntomas y la mortalidad.
En el Reino Unido, el National Institute for Health and Care Excellence (NICE) recomienda nirmatrelvir / ritonavir o molnupiravir para adultos que no necesitan oxigenoterapia y tienen un mayor riesgo de avance a enfermedad grave.[406][674]
El molnupiravir solo se recomienda si el paciente tiene 1 o más factores de riesgo de avance a enfermedad grave, y tanto el nirmatrelvir/ritonavir como el sotrovimab están contraindicados o no son adecuados.[675]
En los Estados Unidos, la Sociedad Estadounidense de Enfermedades Infecciosas (IDSA) recomienda nirmatrelvir/ritonavir o remdesivir como las opciones de tratamiento de elección en pacientes con enfermedad leve a moderada que tienen un alto riesgo de avance hacia una enfermedad grave.[402]
El molnupiravir se recomienda solo en pacientes que no tienen otras opciones de tratamiento (es decir, nirmatrelvir/ritonavir o remdesivir).
El tratamiento debe iniciarse lo antes posible tras el diagnóstico, idealmente en un plazo de 5 días desde el inicio de los síntomas para el nirmatrelvir/ritonavir o el molnupiravir, o en un plazo de 7 días desde el inicio de los síntomas para el remdesivir.[402][406][407]
Las limitaciones logísticas pueden dificultar la administración de remdesivir en algunos entornos ambulatorios, ya que requiere la administración mediante infusión intravenosa.
Es posible que no se recomienden antivirales en niños, mujeres embarazadas o mujeres en período de lactancia.[402][406][407] Sin embargo, las recomendaciones de las guías de práctica clínica varían y debe consultar las guías de práctica clínica locales y la fuente de información sobre fármacos.
Se han informado casos de rebote virológico (es decir, resultado positivo recurrente de la reacción en cadena de la polimerasa) y de recurrencia de los síntomas tras el tratamiento antivírico. Sin embargo, parece ser leve y autolimitado. El rebote virológico fue más frecuente en los pacientes tratados con nirmtarelvir/ritonavir en comparación con los pacientes sin tratar, pero también se notificó en los pacientes tratados con molnupiravir.[676]
Existen datos que indican que se han identificado mutaciones asociadas con la resistencia al nirmatrelvir, especialmente en pacientes inmunocomprometidos. Sin embargo, los datos sugieren un riesgo bajo de resistencia significativa a los medicamentos con las variantes actuales del SARS-CoV-2 y los patrones de uso de antivirales.[677]
Las evidencias para el uso de antivirales en pacientes con enfermedad no grave son limitadas.
El nirmatrelvir/ritonavir redujo el riesgo de ingreso hospitalario o muerte en un 89% (en los 3 días siguientes al inicio de los síntomas) y un 88% (en los 5 días siguientes al inicio de los síntomas) en comparación con placebo en adultos no hospitalizados, no vacunados y de alto riesgo en el ensayo de fase 2/3 EPIC-HR.[678] Sin embargo, el ensayo de fase 2/3 EPIC-SR encontró que el tiempo hasta el alivio sostenido de todos los signos y síntomas no difirió significativamente entre nirmatrelvir/ritonavir y placebo, independientemente del estado de vacunación, en pacientes sintomáticos (no hospitalizados) y con riesgo estándar o alto de enfermedad grave.[679] Los metanálisis han revelado que nirmatrelvir/ritonavir reduce el riesgo de visitas a urgencias, ingreso hospitalario, ingreso en la unidad de cuidados intensivos, necesidad de oxígeno y mortalidad. Sin embargo, se necesitan ensayos controlados aleatorizados a gran escala para confirmar estos hallazgos.[680][681] Una revisión sistemática encontró que nirmatrelvir/ritonavir reducía el riesgo de mortalidad e ingreso hospitalario en pacientes de edad avanzada (evidencia de certeza moderada), pero no mejoraba los resultados de mortalidad e ingreso hospitalario en pacientes <65 años (evidencia de certeza baja).[682] Una revisión sistemática viva y un metanálisis en red encontraron que el nirmatrelvir/ritonavir es probablemente el mejor tratamiento para reducir el ingreso hospitalario en comparación con la atención estándar (evidencia de certeza moderada), pero puede no reducir la duración de los síntomas.[683] Una revisión de la Cochrane encontró que el nirmatrelvir/ritonavir puede reducir el riesgo de mortalidad por todas las causas y el ingreso hospitalario o la muerte en 28 días en pacientes ambulatorios no vacunados con infección previa que tenían un riesgo alto con inicio de síntomas en los 5 días e infectados con la variante Delta (evidencia de certeza baja de un ensayo). Existe evidencia de certeza muy baja con respecto a los efectos sobre la mortalidad por cualquier causa y la eliminación viral en pacientes hospitalizados no vacunados con infección leve a moderada causada por la variante ómicron.[684]
En el ensayo de fase 3 MOVe-OUT, se observó que molnupiravir reducía el riesgo de ingreso hospitalario o muerte en un 31% (reducción del riesgo absoluto del 9.7% al 6.8%) en los 29 días posteriores a su uso, en comparación con placebo, en adultos no hospitalizados, no vacunados y en situación de riesgo.[685] Sin embargo, el ensayo PANORAMIC encontró que el molnupiravir no redujo el riesgo de ingreso hospitalario o de muerte entre los adultos vacunados de alto riesgo en la comunidad en comparación con el placebo, aunque sí redujo el tiempo hasta la recuperación.[686] Los metanálisis presentan resultados contradictorios entre sí. Algunos metanálisis no muestran efectos significativos en la reducción de la mortalidad o el ingreso hospitalario con molnupiravir.[687][688] Sin embargo, otros muestran que el molnupiravir presenta un impacto significativo en la reducción de la mortalidad y el ingreso hospitalario.[689][690] Una revisión sistemática viva y un metanálisis en red encontraron que el molnupiravir puede reducir el ingreso hospitalario en comparación con la atención estándar (evidencia de certeza baja) y probablemente reduce la duración de los síntomas (evidencia de certeza alta).[683] La evidencia limitada sugiere que el uso de molnupiravir puede estar contribuyendo a la evolución del virus SARS-CoV-2, pero es necesario seguir investigando.[691]
En un ensayo aleatorizado, doble ciego y controlado con placebo, se comprobó que el remdesivir reduce el riesgo de ingreso hospitalario o muerte en un 87%, en comparación con el placebo en adultos de alto riesgo no hospitalizados.[692] Una revisión sistemática viva y un metanálisis en red encontraron que el remdesivir probablemente reduce el ingreso hospitalario en comparación con la atención estándar (evidencia de certeza moderada), pero puede no reducir la duración de los síntomas.[683]
Al comparar nirmatrelvir/ritonavir y molnupiravir, nirmatrelvir/ritonavir demostró resultados superiores a los de molnupiravir en términos de mortalidad por todas las causas y tasa de ingreso hospitalario en una revisión sistemática y un metanálisis. La incidencia de eventos adversos fue mayor con nirmatrelvir/ritonavir, pero no se observaron diferencias significativas entre ambos fármacos en cuanto a eventos adversos que condujeran a la interrupción del tratamiento.[693]
Anticuerpos monoclonales
Los anticuerpos monoclonales pueden estar aprobados o tener una autorización de uso de emergencia en algunos de los países.
Los anticuerpos monoclonales se unen a epítopos no solapados del dominio de unión al receptor de la proteína de pico para bloquear la entrada del virus en las células huésped.
Las opciones pueden incluir bebtelovimab, tixagevimab/cilgavimab, casirivimab/imdevimab, sotrovimab, bamlanivimab/etesevimab y regdanvimab, dependiendo de su ubicación.
Se requiere la administración ambulatoria en clínicas especializadas, ya que estos fármacos se administran por vía parenteral, lo que puede limitar su viabilidad.[407]
Las limitaciones logísticas o de suministro pueden hacer necesaria la selección de pacientes para el tratamiento con anticuerpos monoclonales. La terapia debe ser prioritaria para los pacientes con mayor riesgo de avance a la enfermedad grave.
La elección del anticuerpo monoclonal depende de la disponibilidad, así como de factores clínicos y contextuales, incluida la información sobre la eficacia con diferentes variantes y subvariantes del SARS-CoV-2.[406][407]
Consulte su guía local para obtener información sobre si un anticuerpo monoclonal concreto es eficaz frente a las variantes y subvariantes circulantes actuales del SRAS-CoV-2.
El tratamiento debe iniciarse lo antes posible y dentro de los 7 días siguientes a la aparición de los síntomas.
Las recomendaciones de la guía de práctica clínica varían.
La OMS desaconseja encarecidamente el uso de sotrovimab y casirivimab/imdevimab en pacientes con enfermedad no grave, ya que existen evidencias de una reducción de la eficacia contra las variantes actualmente circulantes de SARS-CoV-2 y sus subvariantes. La agencia no emite recomendaciones para otros anticuerpos monoclonales, y recomienda el uso de antivirales en su lugar (ver anterior).[407][663][664]
En el Reino Unido, el NICE recomienda sotrovimab como opción para el tratamiento de pacientes ≥12 años de edad y ≥40 kg de peso corporal que no necesitan oxigenoterapia, que presentan un mayor riesgo de avance a enfermedad grave y para los que nirmatrelvir/ritonavir está contraindicado o no es adecuado.[406][674] No se recomienda tixagevimab/cilgavimab.[694]
En los EE. UU., la IDSA actualmente no recomienda el uso de anticuerpos monoclonales para el tratamiento de COVID-19.[402]
La evidencia para el uso de anticuerpos monoclonales en pacientes no hospitalizados es incierta.
Una revisión de la Cochrane encontró que no hay evidencias suficientes para poder extraer conclusiones significativas sobre cualquier anticuerpo monoclonal específico y la etapa de la enfermedad en el que debe utilizarse. Casirivimab/imdevimab disminuye el riesgo de infección y el desarrollo de síntomas clínicos (evidencia de alta certeza). El bamlanivimab disminuye el riesgo de infección (evidencia de certeza moderada). Estos resultados solo se aplican a las personas no vacunadas, y solo son aplicables a las variantes existentes durante el estudio.[695]
Una revisión sistemática y un metanálisis de 27 ensayos controlados aleatorizados encontraron que los anticuerpos monoclonales presentaban efectos limitados en la mayoría de los resultados en pacientes no hospitalizados, con una certeza de las evidencias que iba de muy baja a moderada para la mayoría de los resultados. Los anticuerpos monoclonales redujeron el ingreso hospitalario, pero no se observaron efectos sobre la mortalidad.[696]
Antimicrobianos
Considere la opción de uso de los antibióticos empíricos en pacientes con enfermedad moderada solo si hay sospecha clínica de infección bacteriana secundaria.[86][406]
Inicie el tratamiento lo antes posible y consulte las guías de práctica clínica locales para la elección del régimen.
No ofrezca un antibiótico para prevenir la neumonía bacteriana secundaria.
Aconseje a los pacientes que busquen ayuda médica sin demora si sus síntomas no mejoran o empeoran rápida o significativamente.[406]
Reconsidere si la persona presenta signos y síntomas de una enfermedad más grave en la reevaluación, y si hay que remitirla al hospital, a otros servicios de soporte de la comunidad para casos agudos, o bien a los servicios de cuidados paliativos.
Monitorización
Monitorice estrechamente a los pacientes (en particular a aquellos con factores de riesgo de enfermedad grave) para detectar signos y síntomas de avance de la enfermedad. Aconseje a los pacientes sobre los signos y síntomas de deterioro o complicaciones que requieran una atención urgente inmediata (p. ej., dificultad para respirar, dolor torácico).[86]
Se recomienda la monitorización de la oximetría de pulso en el domicilio en pacientes sintomáticos con factores de riesgo de avance a una enfermedad grave que no estén hospitalizados. Es necesario ofrecer información al paciente y realizar un seguimiento adecuado.[86]
Si se atiende al paciente en el hospital, se debe monitorizar estrechamente a los pacientes para detectar signos de deterioro clínico utilizando las puntuaciones médicas de alerta temprana (p. ej., la National Early Warning Score 2 [NEWS2]), y responda inmediatamente con intervenciones adecuadas de cuidados de soporte.[86]
Una revisión sistemática y un metanálisis encontraron que la puntuación NEWS2 tenía una sensibilidad y especificidad moderadas para predecir el deterioro de los pacientes con COVID-19. La puntuación mostró una buena discriminación en la predicción del resultado combinado de la necesidad de asistencia respiratoria intensiva, el ingreso en la unidad de cuidados intensivos o la mortalidad intrahospitalaria.[480]
Corticosteroides
Una revisión sistemática viva y un metanálisis en red encontraron que los corticosteroides sistémicos pueden reducir el ingreso hospitalario en comparación con la atención estándar (evidencia de certeza baja) y probablemente reducir la duración de los síntomas (evidencia de certeza moderada).[683]
Sin embargo, las guías de práctica clínica no recomiendan los corticosteroides sistémicos en pacientes con enfermedad no grave, a menos que exista otra indicación médica para hacerlo, ya que pueden aumentar el riesgo de mortalidad en estos pacientes.[402][406][407]
Antitrombótico
Las guías de práctica clínica publicadas por el Foro de Anticoagulación de EE.UU. desaconsejan el uso de anticoagulantes y terapia antiplaquetaria para la prevención de la tromboembolia venosa o la trombosis arterial en pacientes no hospitalizados sin evidencia de tromboembolia venosa, a menos que el paciente presente otras indicaciones de tratamiento o esté participando en un ensayo clínico.[697]
Una revisión de la Cochrane encontró que la anticoagulación profiláctica produce poca o ninguna diferencia en la necesidad de ingreso hospitalario, sangrado grave, trombosis venosa profunda, mortalidad por todas las causas o acontecimientos adversos en comparación con placebo o ningún tratamiento en pacientes no hospitalizados (evidencia de baja a moderada certeza), pero puede reducir la incidencia de embolia pulmonar y tromboembolia venosa.[698] En personas con enfermedad leve, los antiagregantes plaquetarios pueden suponer una diferencia escasa o nula en la mortalidad a los 45 días y en los eventos adversos graves, pero pueden reducir ligeramente los eventos trombóticos (evidencia de baja certeza).[699]
Grupos clínicos de mayor riesgo
Un grupo consultivo del Reino Unido ha generado una lista de afecciones o cohortes que corren el mayor riesgo de sufrir una enfermedad grave a causa del COVID-19 en la comunidad y que, por tanto, se beneficiarían de los tratamientos (p. ej., antivirales, anticuerpos monoclonales). Esta lista puede utilizarse al considerar el uso de estos tratamientos en adultos, e incluye lo siguiente: Síndrome de Down y otros trastornos genéticos; cánceres sólidos; enfermedades hematológicas y receptores de trasplantes de células madre hematológicas; enfermedades renales y hepáticas; receptores de trasplantes de órganos sólidos; trastornos inflamatorios inmunomediados; enfermedades respiratorias; inmunodeficiencias; VIH/SIDA; y afecciones neurológicas raras y neurodiscapacidades complejas graves que limitan la vida.[700] Las definiciones pueden variar según otras guías de práctica clínica.
Se dispone de un metanálisis en red viva que resume la evidencia disponible para los tratamientos de COVID-19:
Los pacientes con sospecha o confirmación de enfermedad grave corren el riesgo de un rápido deterioro clínico.[86] Para conocer las definiciones de gravedad, consulte Criterios.
Lugar de la atención
Se debe manejar a los pacientes en un centro de atención médico adecuado bajo la orientación de un equipo de especialistas.[86]
La duración estimada de la estancia hospitalaria es de más de 10 días (media de 15 días). Sin embargo, la duración depende de varios factores como la edad, el país/región y los recursos disponibles.[701]
Evaluación de la fragilidad
Utilice la Clinical Frailty Scale (CFS) para evaluar la salud de base e informar de las discusiones sobre las expectativas de tratamiento cuando sea adecuado y dentro de una evaluación individualizada de la fragilidad. Clinical Frailty Scale Opens in new window No utilice el CFS para personas más jóvenes o para personas con discapacidades estables de larga duración (p. ej., parálisis cerebral), discapacidades de aprendizaje o autismo. Realice una evaluación individualizada de la fragilidad en estas personas, utilizando la evaluación clínica y métodos de puntuación alternativos.[406]
La evidencia para el uso del CFS en COVID-19 está evolucionando a pesar de las limitaciones en los informes sobre su aplicación en la práctica.[702]
Los pacientes con una puntuación entre 4-9 presentaron una mortalidad significativamente mayor en comparación con los que presentaban una puntuación de 1-3 en una revisión sistemática y un metanálisis.[703] Cada aumento de 1 punto en la puntuación se asoció con un aumento del 12% en la mortalidad.[704] Sin embargo, una revisión sistemática y un metanálisis encontraron que no se observaban diferencias en la mortalidad a corto plazo entre los pacientes frágiles y los no frágiles.[705]
Se necesita una comprensión más matizada de la fragilidad y los resultados, y hay que ser cautos a la hora de poner demasiado énfasis en la influencia de la fragilidad sobre el pronóstico de las personas de edad avanzada.[706]
Oxígeno
Se debe iniciar inmediatamente la oxigenoterapia en cualquier paciente con signos de emergencia (es decir, obstrucción o ausencia de respiración, dificultad respiratoria grave, cianosis central, shock, coma y/o convulsiones), o cualquier paciente sin signos de emergencia e hipoxemia.[86]
No hay evidencia de beneficio de la terapia de oxígeno en pacientes con COVID-19 en ausencia de hipoxemia.[707]
Se establece un objetivo de SpO₂ a ≥94% durante la reanimación en adultos y niños con signos de emergencia que requieren un manejo de emergencia de las vías respiratorias y oxigenoterapia. Una vez que el paciente esté estable, se recomienda un objetivo SpO₂ >90% en niños y adultos no embarazadas, y ≥92% a 95% en mujeres embarazadas. En los niños pequeños es preferible usar cánulas nasales.[86]
Algunas guías de práctica clínica recomiendan que SpO₂ se mantenga a un nivel no superior al 96%.[708]
Algunos centros médicos pueden recomendar diferentes objetivos de SpO₂ para apoyar la priorización del flujo de oxígeno para los pacientes más gravemente enfermos en el hospital.
Se deben considerar las técnicas de posicionamiento (p. ej., sentarse con apoyo), y el manejo de la limpieza de las vías respiratorias para optimizar la oxigenación y ayudar a la eliminación de las secreciones en los adultos. Considere la posición en decúbito prono despierta en pacientes gravemente enfermos que requieren oxigenoterapia.[86]
La posición en decúbito prono despierto redujo el riesgo de intubación endotraqueal en comparación con la atención habitual. Sin embargo, no redujo significativamente la mortalidad, los días sin respirador, la duración de la estancia en la unidad de cuidados intensivos o en el hospital, ni el aumento de la modalidad de oxígeno. Los eventos adversos eran infrecuentes.[709]
Se debe monitorizar a los pacientes estrechamente para detectar signos de insuficiencia respiratoria hipoxémica aguda y progresiva. Los pacientes que continúan sufriendo un deterioro, a pesar de la oxigenoterapia estándar requieren un soporte avanzado de oxígeno/ventilación.[86]
La Organización Mundial de la Salud (OMS) recomienda la HFNO, la presión positiva continua en las vías respiratorias [CPAP] o la ventilación no invasiva (interfaz de casco o máscara facial) en pacientes hospitalizados con enfermedad grave e insuficiencia respiratoria hipoxémica aguda que no necesiten intubación urgente, en lugar de la oxigenoterapia estándar. La elección depende de factores como la disponibilidad de dispositivos y el suministro de oxígeno, la comodidad y la experiencia personal, y las consideraciones específicas del paciente (p. ej., la claustrofobia con la CPAP o las mascarillas de ventilación no invasiva, las molestias nasales con la HFNO).[86]
El uso de presión positiva binivel en las vías respiratorias con casco (BiPAP) se asoció con un riesgo significativamente menor de intubación en comparación con la oxigenoterapia de alto flujo (HFNO) y la oxigenoterapia estándar en pacientes con enfermedad moderada a grave, según un metanálisis de ensayos aleatorizados controlados. La BiPAP con casco también se asoció con una estancia más corta en la unidad de cuidados intensivos en comparación con la oxigenoterapia estándar. No se identificaron diferencias significativas en la mortalidad entre BiPAP con casco, HFNO, oxigenoterapia estándar y CPAP.[710]
Manejo de síntomas y cuidados de soporte
Líquidos y electrolitos: se debe usar una fluidoterapia cautelosa en adultos y niños sin hipoperfusión tisular y sin respuesta a los líquidos, ya que la rehidratación agresiva puede empeorar la oxigenación.[86] Se debe corregir cualquier alteración electrolítica o metabólica, como la hiperglucemia o la acidosis metabólica, según los protocolos locales.[711]
Fiebre y dolor: se recomienda paracetamol o ibuprofeno.[86][406] El ibuprofeno solo debe tomarse en la dosis eficaz más baja durante el período más breve necesario para controlar los síntomas.
Tos: aconseje a los pacientes que eviten acostarse boca arriba, ya que esto hace que la tos sea ineficaz, y que sigan las guías de práctica clínica locales para tratar la tos aguda.[406]
Disnea: mantenga la habitación fresca y fomente la relajación, las técnicas de respiración y el cambio de posiciones del cuerpo. Identifique y trate cualquier causa reversible de disnea (p. ej., edema pulmonar, embolia pulmonar, EPOC, asma).[406]
Ansiedad, delirio y agitación: se debe identificar y tratar cualquier causa subyacente o reversible (p. ej., ofrecer consuelo, tratar la hipoxia, corregir las anormalidades metabólicas o endocrinas, abordar las coinfecciones, minimizar el uso de fármacos que puedan causar o empeorar el delirio, tratar la abstinencia de sustancias, mantener ciclos de sueño normales, tratar el dolor o disnea).[86][406]
Cuidado bucal: una parte importante de la atención general a los pacientes hospitalizados, ventilados o no, y a los que se someten a cuidados en reducción o de final de la vida.[713]
Se debe proporcionar soporte básico psicosocial y a la salud mental a todos los pacientes, y manejar cualquier síntoma de insomnio o depresión según sea indicado.[86]
profilaxis de tromboembolia venosa (TEV)
Evaluar el riesgo de sangrado: evalúe el riesgo de sangrado del paciente lo antes posible tras el ingreso, o en el momento de la primera revisión por el especialista, utilizando una herramienta adecuada de evaluación del riesgo.[406]
Si el paciente ya está recibiendo tratamiento de anticoagulación por otra enfermedad subyacente, continúe con la dosis de tratamiento actual del anticoagulante, a menos que esté contraindicado o haya un cambio en las circunstancias clínicas (p. ej., se produce un sangrado o aumenta el riesgo de sangrado).[406][697] Se debe considerar la posibilidad de cambiar a heparina de bajo peso molecular si el estado clínico del paciente se está deteriorando y el paciente no está actualmente con heparina de bajo peso molecular.[406]
Una revisión sistemática y un metanálisis encontraron que el uso de anticoagulación oral antes del ingreso hospitalario no estaba asociada a un menor riesgo de ingreso en la unidad de cuidados intensivos ni de mortalidad. Sin embargo, la revisión reconoció que se necesitan más ensayos.[714]
Iniciar la profilaxis del TEV: inicie la profilaxis en todos los pacientes hospitalizados, siempre que no existan contraindicaciones.[86][406][697] Empiece lo antes posible (en las 14 horas siguientes al ingreso).[406]
Una revisión de la Cochrane descubrió que los anticoagulantes pueden reducir la mortalidad por todas las causas en comparación con la ausencia de anticoagulantes, pero las evidencias son muy inciertas.[715]
Una revisión sistemática y un metanálisis encontraron que las probabilidades agrupadas de mortalidad entre pacientes hospitalizados anticoagulados y no anticoagulados eran similares, pero menores en el grupo de dosis profiláctica estándar. La anticoagulación con dosis profilácticas redujo significativamente las probabilidades de muerte intrahospitalaria en un 17% en comparación con la no anticoagulación.[716]
Elección del anticoagulante: la heparina de bajo peso molecular, la heparina no fraccionada o el fondaparinux son las opciones recomendadas. Se prefiere la heparina de bajo peso molecular a la heparina no fraccionada y al fondaparinux, a menos que su uso esté contraindicado.[86][406] Fondaparinux es la opción recomendada en pacientes con antecedentes de trombocitopenia inducida por heparina.[717]
Un metanálisis encontró que la heparina de bajo peso molecular se asociaba a un menor ingreso en la unidad de cuidados intensivos, ventilación mecánica, estancia hospitalaria y mortalidad, en comparación con la heparina no fraccionada en pacientes hospitalizados, y no se encontraron diferencias en la incidencia de sangrados.[718]
Se recomienda la tromboprofilaxis mecánica (p. ej., dispositivo de compresión neumática intermitente) si el uso de anticoagulantes está contraindicado o estos no están disponibles.[717]
Hay evidencia limitada de que los anticoagulantes orales directos (inhibidores del factor Xa) son más eficaces que la heparina de bajo peso molecular para prevenir la TEV en pacientes hospitalizados que no están gravemente enfermos. Sin embargo, las guías de práctica clínica no recomiendan estos fármacos, y se necesitan ensayos aleatorizados controlados adicionales.[719]
Consulte a un especialista para que le oriente sobre la elección y la dosis del anticoagulante en poblaciones especiales de pacientes (p. ej., niños, mujeres embarazadas y lactantes, insuficiencia hepática o renal, cáncer activo).
Dosis de anticoagulante: generalmente se recomiendan dosis estándar de profilaxis frente a las dosis intermedias o terapéuticas en pacientes sin una indicación establecida para una anticoagulación a dosis más altas.[86][697] No obstante, las recomendaciones varían y debe consultar las orientaciones locales.
En el Reino Unido, el National Institute for Health and Care Excellence (NICE) recomienda dosis profilácticas de heparina de bajo peso molecular. Sin embargo, también ha emitido una recomendación condicional para considerar dosis de tratamiento de heparina de bajo peso molecular en pacientes que puedan beneficiarse de este tratamiento. La decisión debe considerarse cuidadosamente, y la elección del régimen de dosis más adecuado debe estar guiada por el riesgo de sangrado, el juicio clínico y los protocolos locales. Para las personas que no requieran oxigenoterapia, siga las pautas estándar de profilaxis para la TEV.[406]
Una revisión de la Cochrane encontró que los regímenes de dosis más altas dieron lugar a poca o ninguna diferencia en la mortalidad por todas las causas en comparación con los regímenes de dosis más bajas en pacientes hospitalizados; sin embargo, los regímenes de dosis más altas se asociaron con un mayor riesgo de sangrados menores hasta 30 días (evidencia de alta certeza). Los anticoagulantes de dosis más altas probablemente reducen la embolia pulmonar y aumentan ligeramente las sangrados graves en comparación con los regímenes de dosis más bajas hasta los 30 días (evidencia de certeza moderada). Los anticoagulantes de dosis más altas pueden producir poca o ninguna diferencia en la trombosis venosa profunda, el accidente cerebrovascular, los eventos adversos importantes en las extremidades, el infarto de miocardio, la fibrilación auricular o la trombocitopenia en comparación con los regímenes de dosis más bajas hasta los 30 días (evidencia de baja certeza).[715]
Duración del tratamiento: por lo general, el tratamiento de anticoagulación se mantiene hasta el alta hospitalaria. En general, no se recomienda la profilaxis rutinaria de la TEV tras el alta, excepto en determinados pacientes de alto riesgo o si existe otra indicación para la profilaxis para la TEV.[86][697] Sin embargo, en el Reino Unido, el NICE recomienda el tratamiento durante un mínimo de 7 días, incluso después del alta, si se utilizan dosis de profilaxis estándar de heparina.[406] Si se utilizan dosis terapéuticas de heparina, la duración recomendada del tratamiento es de 14 días o hasta el alta hospitalaria, lo que ocurra primero.[406] Algunas guías de práctica clínica recomiendan que se puede considerar el rivaroxabán oral (un anticoagulante oral directo) para la profilaxis para la TEV posterior al alta.[697]
Una revisión sistemática y un metanálisis encontraron que la tromboprofilaxis prolongada (con un anticoagulante oral directo o heparina de bajo peso molecular a dosis de profilaxis) administrada durante <35 días se asoció significativamente con un menor riesgo de trombosis y mortalidad por todas las causas en pacientes tras el alta que presentaban un alto riesgo de tromboembolia, sin aumentar el riesgo de sangrado grave.[720]
Monitorización: monitorice a los pacientes en busca de signos y síntomas sugestivos de tromboembolismo y proceder con las vías de diagnóstico y tratamiento adecuadas en caso de sospecha clínica.[86] Consulte Complicaciones.
Si el estado clínico del paciente cambia, se debe evaluar el riesgo de TEV, se debe reevaluar el riesgo de sangrado y revisar la profilaxis para la TEV.[406]
La monitorización de los parámetros clínicos durante la tromboprofilaxis depende del anticoagulante y de la dosis utilizada. Consulte sus protocolos locales para más información.
Antimicrobianos
Considere la posibilidad de administrar antibióticos empíricos si existe alguna sospecha clínica de infección bacteriana secundaria. Administre en el plazo de 1 hora desde la evaluación inicial de los pacientes con sospecha de sepsis o si el paciente cumple los criterios de alto riesgo (o en el plazo de 4 horas desde que se establece el diagnóstico de neumonía bacteriana secundaria); no espere a los resultados de microbiología. Se debe basar el régimen en el diagnóstico clínico (p. ej., neumonía adquirida en la comunidad, neumonía adquirida en el hospital, sepsis), en los datos de epidemiología y susceptibilidad locales y en las guías locales de tratamiento.[86][406]
No ofrezca antibióticos para prevenir o tratar la neumonía si es probable que la causa sea el SARS-CoV-2, otro virus o una infección fúngica.[406]
Considere la posibilidad de buscar el consejo de un especialista para las personas que: están inmunocomprometidas; presentan una anamnesis de infección con organismos resistentes; presentan antecedentes de exacerbaciones infecciosas repetidas de la enfermedad pulmonar; están embarazadas; o están recibiendo soporte respiratorio u orgánico avanzado.[406]
Busque el consejo de un especialista si se sospecha que la persona presenta una infección con bacterias multirresistentes y puede necesitar un antibiótico diferente, o si hay evidencias clínicas o microbiológicas de infección y el estado de la persona no mejora como se esperaba después de 48 a 72 horas de tratamiento antibiótico.
Se debe reevaluar a diario el uso de antibióticos. Se debe disminuir la terapia empírica basándose en los resultados de la microbiología y el juicio clínico. Se debe revisar regularmente la posibilidad de cambiar de tratamiento intravenoso a tratamiento oral. La duración del tratamiento debe ser lo más breve posible (p. ej., de 5-7 días). Deberían establecerse programas de administración de antibióticos.[86]
Un metanálisis encontró que la prevalencia de la prescripción de antibióticos en pacientes con COVID-19 era del 75%, lo cual es un valor significativamente mayor que la prevalencia estimada de la coinfección bacteriana. Por lo tanto, es probable que el uso innecesario de antibióticos sea elevado en estos pacientes.[721]
Se deben tratar las coinfecciones confirmadas por laboratorio (p. ej., el paludismo, la tuberculosis, la gripe) según sea indicado, de acuerdo con los protocolos locales.[86]
Corticosteroides
La OMS recomienda encarecidamente el tratamiento con corticosteroides sistémicos (dosis bajas de dexametasona o hidrocortisona intravenosa u oral) durante 7 a 10 días en adultos con enfermedad grave.[407][663][664]
Esta recomendación se basa en evidencias de calidad moderada que sugieren que los corticosteroides sistémicos probablemente reducen la mortalidad a los 28 días en pacientes con enfermedad grave. No hay evidencias que comparen directamente la dexametasona y la hidrocortisona. Los daños del tratamiento en este contexto se consideran menores. No está claro si estas recomendaciones pueden aplicarse a los niños o a los que están inmunocomprometidos.
En el Reino Unido, el NICE recomienda ofrecer dexametasona (o una alternativa como la hidrocortisona o la prednisolona cuando la dexametasona no pueda utilizarse o no esté disponible) durante un máximo de 10 días (a menos que exista una indicación clara de suspenderlo antes) a las personas que necesiten oxigenoterapia para alcanzar los niveles de saturación de oxígeno prescritos, o que presenten un nivel de hipoxia que requiera oxigenoterapia, pero que no puedan recibirla o tolerarla.[406]
En Estados Unidos, la Sociedad Estadounidense de Enfermedades Infecciosas (IDSA) recomienda la dexametasona (o un corticosteroide alternativo si no se dispone de dexametasona) durante 10 días o hasta el alta hospitalaria en pacientes hospitalizados con enfermedad grave.[402]
Las evidencias respaldan el uso de corticosteroides en pacientes hospitalizados.
Una revisión de la Cochrane encontró que los corticosteroides sistémicos probablemente reducen ligeramente la mortalidad por todas las causas hasta los 30 días en pacientes hospitalizados con enfermedad sintomática (evidencia de certeza moderada), aunque la evidencia es muy incierta acerca del efecto sobre la mortalidad por todas las causas hasta los 120 días. La evidencia relacionada con el tipo, la dosis o el momento más eficaz de corticosteroide es incierta.[722]
Una revisión sistemática y un metanálisis en red en vivo encontraron que los corticosteroides probablemente reducen la mortalidad en comparación con la atención estándar.[723][724]
La evidencia sugiere que las dosis más altas pueden ser superiores a las dosis más bajas en la reducción de la mortalidad en pacientes con enfermedad grave o crítica.[725] Sin embargo, el ensayo RECOVERY descubrió que las dosis más altas de corticosteroides aumentaban significativamente el riesgo de muerte en comparación con la atención habitual (que incluía dosis bajas de corticosteroides) en pacientes hospitalizados que no necesitaban oxígeno, o que solo necesitaban oxígeno en monoterapia. El estudio sigue evaluando dosis más altas en pacientes hospitalizados que requieren ventilación no invasiva, ventilación mecánica u oxigenación por membrana extracorpórea (OMEC).[726]
Las evidencias también sugieren que los tratamientos más breves pueden optimizar el beneficio sobre la mortalidad en pacientes hospitalizados. La duración óptima del tratamiento fue <7 días en un metanálisis, y no se informó ningún beneficio adicional para la supervivencia con ≥7 días de tratamiento.[727]
Se debe monitorizar a los pacientes para detectar efectos adversos (p. ej., hiperglucemia, infecciones secundarias, efectos psiquiátricos, reactivación de infecciones latentes) y evaluar las interacciones farmacológicas.
Antivirales
La OMS recomienda de forma condicional el antiviral intravenoso remdesivir durante 5 a 10 días en adultos con enfermedad grave. Debe iniciarse lo antes posible tras el inicio de los síntomas.[407][663][664]
Esta recomendación se basa en evidencias de baja certeza que sugiere que el remdesivir posiblemente reduce la mortalidad, y en la evidencia de certeza moderada que sugiere que probablemente reduce la necesidad de ventilación mecánica. Las evidencias de certeza moderada sugieren que el remdesivir probablemente tiene poco o ningún impacto en el tiempo de mejoría de los síntomas. No hay evidencias suficientes para emitir una recomendación sobre su uso en niños.
En el Reino Unido, el NICE recomienda el remdesivir como una opción en los hospitales en adultos con alto riesgo de enfermedad grave y niños (de 4 semanas a 17 años y peso ≥3 kg) que tienen neumonía y necesitan oxigenoterapia o que pesan ≥40 kg y tienen un alto riesgo de enfermedad grave.[406][694]
En los EE. UU., la IDSA recomienda remdesivir durante 5 días en pacientes que requieren oxigenoterapia.[402]
El curso de tratamiento recomendado es de 5 a 10 días o hasta el alta hospitalaria, lo que ocurra primero.[402][406][407]
La evidencia no sugiere un mayor beneficio con un curso de 10 días de remdesivir, en comparación con un curso de 5 días, pero sugiere un mayor riesgo de daño. Es posible que no haya ningún beneficio en completar el curso completo de remdesivir si el paciente progresa.[406]
A pesar de que las guías de práctica clínica recomiendan el uso de remdesivir en pacientes con enfermedad grave, las evidencias de su uso son contradictorias.
Una revisión de la Cochrane encontró que remdesivir probablemente presenta poco o ningún efecto sobre la mortalidad por todas las causas (hasta 150 días) en pacientes hospitalizados con enfermedad moderada a grave en comparación con placebo o la atención habitual (evidencia de certeza moderada). Remdesivir probablemente aumenta ligeramente la probabilidad de mejoría clínica hasta el día 28, y disminuye el riesgo de empeoramiento clínico en 28 días (evidencia de certeza moderada).[728]
Una revisión sistemática de ensayos aleatorizados controlados y estudios del mundo real (que incluyeron más de 1.2 millones de participantes) encontró que el remdesivir disminuyó significativamente la mortalidad por cualquier causa a los 28-30 días en pacientes hospitalizados, independientemente de la gravedad de la enfermedad, la variante del SARS-CoV-2 o la era de la vacunación.[729]
Un seguimiento de 1 año de los pacientes hospitalizados en un ensayo controlado aleatorizado no encontró beneficios a largo plazo (calidad de vida o resultados de los síntomas) para el remdesivir, en comparación con el tratamiento estándar.[730]
Los antivirales orales (nirmatrelvir/ritonavir, molnupiravir) no se recomiendan actualmente en pacientes con enfermedad grave. La evidencia actual no apoya el agregado de estos fármacos a la atención estándar para los pacientes hospitalizados, ya que no se han asociado con mejores resultados clínicos.[731]
Inhibidores de la interleucina 6 (IL-6)
La OMS recomienda encarecidamente una dosis única de un inhibidor de la IL-6 (tocilizumab o sarilumab) en adultos con enfermedad grave. Los inhibidores de la IL-6 pueden administrarse en combinación con corticosteroides e inhibidores de JAK, y deben iniciarse al mismo tiempo que los corticosteroides.[407][663][664]
Esta recomendación se basa en evidencias de alta certeza que muestran que los inhibidores de la IL-6 reducen la mortalidad y la necesidad de ventilación mecánica, y en evidencias de baja certeza que sugieren que los inhibidores de la IL-6 también pueden reducir la duración de la ventilación mecánica y el ingreso hospitalario. La evidencia sobre el riesgo de eventos adversos graves es incierta. La aplicabilidad de esta recomendación a los niños es actualmente incierta.
En el Reino Unido, el NICE recomienda una dosis única de tocilizumab en adultos hospitalizados que reciban corticosteroides sistémicos y necesiten oxigenoterapia o ventilación mecánica.[406][674]
En los Estados Unidos, la IDSA recomienda una dosis única de tocilizumab (o sarilumab si no se dispone de tocilizumab) en pacientes hospitalizados con enfermedad grave progresiva que tienen marcadores elevados de inflamación sistémica además de la atención estándar (es decir, corticosteroides).[402]
Las evidencias respaldan el uso de inhibidores de la IL-6.
Una revisión de la Cochrane encontró que el tocilizumab redujo la mortalidad por todas las causas en el día 28 (evidencia de alta certeza) en comparación con la atención estándar en monoterapia o el placebo. La evidencia sugiere incertidumbre en torno al efecto de tocilizumab sobre la mortalidad después del día 60.La evidencia de un efecto sobre estos resultados para sarilumab es muy incierta. Tocilizumab y sarilumab probablemente producen poco o ningún aumento de la mejoría clínica en el día 28 (es decir, alta hospitalaria o mejoría medida por escalas definidas por el triallist) (evidencia de certeza moderada). La evidencia de mejoría clínica después del día 60 es muy incierta para ambos fármacos.[732] [
 ]
]
Una revisión sistemática y un metanálisis en red en vivo encontraron que los inhibidores de la IL-6 (con corticosteroides) probablemente reducen la mortalidad (evidencia de certeza moderada), es probable que reduzcan la necesidad de ventilación mecánica (evidencia de certeza moderada) y pueden reducir la duración del ingreso hospitalario (evidencia de certeza moderada) en comparación con la atención estándar.[723][724]
Los inhibidores de la IL-6 pueden no ser beneficiosos cuando se utilizan en monoterapia (sin corticosteroides).[733]
Inhibidores de la cinasa Janus (JAK)
La OMS recomienda encarecidamente un inhibidor oral de JAK (baricitinib) durante 14 días o hasta el alta hospitalaria (lo que suceda antes) en adultos con enfermedad grave. El baricitinib puede administrarse en combinación con corticosteroides e inhibidores de la IL-6 y debe iniciarse al mismo tiempo que los corticosteroides sistémicos.[407][663][664]
Esta recomendación se basa en las evidencias de alta certeza de que el baricitinib reduce la mortalidad, y en las evidencias de certeza moderada de que el baricitinib probablemente reduce la duración de la ventilación mecánica y la duración de la estancia hospitalaria. La aplicabilidad de esta recomendación a los niños es actualmente incierta.
La OMS recomienda no utilizar otros fármacos de esta clase (tofacitinib y ruxolitinib), a menos que no se disponga de baricitinib o inhibidores de la IL-6, ya que los efectos del tofacitinib o el ruxolitinib sobre la mortalidad, la necesidad de ventilación mecánica y la duración de la estancia hospitalaria siguen siendo inciertos y se necesitan más evidencias de ensayos.
En el Reino Unido, el NICE recomienda baricitinib en adultos hospitalizados que: necesiten oxigenoterapia y estén recibiendo o hayan completado un curso de corticosteroides (a menos que esté contraindicado), y no presentan evidencia de infección (además del SARS-CoV-2) que pueda empeorar con baricitinib. También puede considerarse en niños ≥2 años de edad siempre que cumplan los mismos criterios.[406]
En los EE. UU., la IDSA recomienda baricitinib en pacientes hospitalizados con enfermedad grave, además del tratamiento con corticosteroides. También se puede utilizar en pacientes que no pueden recibir un corticosteroide debido a una contraindicación (en combinación con remdesivir).[402]
La evidencia respalda el uso de los inhibidores de la cinasa Janus (JAK).
Una revisión de la Cochrane encontró que los inhibidores de la cinasa Janus (JAK) probablemente redujeron la mortalidad por todas las causas hasta el día 28 (evidencia de certeza moderada) y hasta el día 60 (evidencia de certeza alta). Probablemente, la diferencia en la mejoría del estado clínico o en la tasa de eventos adversos sea escasa o nula (evidencia de certeza moderada). El baricitinib fue el inhibidor de la cinasa janus más evaluado.[734]
Una revisión sistemática y un metanálisis en red en vivo encontraron que los inhibidores de JAK probablemente reducen la mortalidad (evidencia de alta certeza), reducen la duración de la ventilación mecánica (evidencia de alta certeza) y reducen la duración de la estancia hospitalaria (evidencia de alta certeza), en comparación con la atención estándar.[723][724]
Otros fármacos inmunomoduladores
En los EE.UU., la IDSA recomienda el abatacept o el infliximab intravenosos en adultos hospitalizados con enfermedad de avance rápido que reciben corticosteroides sistémicos, como alternativas al baricitinib y al tocilizumab (cuando estos fármacos no están disponibles), sobre la base de pruebas de certeza baja.[402]
Sin embargo, otras guías de práctica clínica aún no recomiendan estos fármacos.
Anticuerpos monoclonales
Las recomendaciones para los anticuerpos monoclonales en pacientes con enfermedad grave difieren de las recomendaciones en pacientes con enfermedad leve o moderada. Las principales guías de práctica clínica internacionales no recomiendan actualmente los anticuerpos monoclonales para los pacientes con enfermedad grave.
La Organización Mundial de la Salud desaconseja encarecidamente el uso de casirivimab/imdevimab en pacientes con cualquier gravedad de la enfermedad. La agencia no ha emitido ninguna otra recomendación a favor o en contra del uso de otros anticuerpos monoclonales en pacientes con enfermedad grave.[407][663][664]
En el Reino Unido,el NICE recomienda no ofrecer casirivimab/imdevimab a pacientes que se sabe o se sospecha que tienen una infección causada por una variante de ómicron.[406]
En los EE. UU., la IDSA actualmente no recomienda el uso de anticuerpos monoclonales para el tratamiento de COVID-19.[402]
La evidencia para el uso de anticuerpos monoclonales en pacientes hospitalizados es incierta.
Una revisión sistemática y un metanálisis de 27 ensayos controlados aleatorizados encontraron que los anticuerpos monoclonales presentaban efectos limitados en la mayoría de los resultados en pacientes hospitalizados, con una certeza de las pruebas que iba de muy baja a moderada para la mayoría de los resultados. Los anticuerpos monoclonales redujeron ligeramente la ventilación mecánica y la bacteriemia, pero no se observaron efectos sobre la mortalidad.[696]
Monitorización
Se debe monitorizar estrechamente a los pacientes para detectar signos de deterioro clínico y responder de inmediato con las intervenciones de cuidados de soporte más indicadas.[86]
Alta y rehabilitación
Se debe evaluar rutinariamente a los pacientes de edad avanzada en cuanto a la movilidad, la deglución funcional, el trastorno cognitivo y los problemas de salud mental, y sobre la base de esa evaluación determinar si el paciente está listo para recibir el alta, y si presenta algún requisito de rehabilitación y seguimiento.[86]
Cuidados paliativos
Las intervenciones de cuidados paliativos deben ser accesibles en cada institución que atienda a pacientes con COVID-19. Se debe identificar si el paciente tiene un plan de atención anticipada y respetar las prioridades y preferencias del paciente al formular el plan de atención del mismo.[86] Se deben seguir las guías de práctica clínica sobre cuidados paliativos.
Faltan datos sobre los cuidados paliativos en pacientes con COVID-19.
Sin embargo, una rápida revisión sistemática de las estrategias farmacológicas utilizadas para los cuidados paliativos en estos pacientes, la primera revisión internacional de este tipo, encontró que una mayor proporción de pacientes requería infusiones subcutáneas continuas para la administración de la medicación de lo que se suele ver en la población de cuidados paliativos. Para el control de los síntomas se requirieron dosis limitadas de medicamentos para cuidados paliativos de uso frecuente. Sin embargo, estos resultados deben interpretarse con precaución debido a la falta de datos disponibles.[735]
Se dispone de un metanálisis en red viva que resume la evidencia disponible para los tratamientos de COVID-19:
Se debe ingresar o trasladar a los pacientes con enfermedades críticas (es decir, presencia de síndrome de dificultad respiratoria aguda, sepsis o shock séptico) a una unidad de cuidados intensivos/críticos. Para conocer las definiciones de gravedad, consulte Criterios. La tasa de mortalidad general agrupada en pacientes con enfermedad crítica fue del 34%, y el 62% de los pacientes requirieron ventilación mecánica. Aproximadamente el 69% de estos pacientes tenían comorbilidades.[736]
Se deben utilizar los paquetes de medidas existentes (es decir, tres o más prácticas basadas en la evidencia que se aplican al mismo tiempo y de forma sistemática para mejorar la calidad de la atención), seleccionados de forma local por parte del hospital o la unidad de cuidados intensivos y que se hayan adaptado según sea necesario a las circunstancias locales.[86]
Lugar de la atención
Se debe manejar a los pacientes en una unidad de cuidados intensivos/críticos bajo la orientación de un equipo de especialistas.[86]
Comente los riesgos, beneficios y posibles resultados de las opciones de tratamiento con los pacientes y sus familias, y permítales expresar sus preferencias sobre su manejo. Se deben tener en cuenta los deseos y expectativas del paciente al considerar el límite máximo de intervención. Utilice las herramientas de apoyo a las decisiones si están disponibles. Ponga en marcha planes de escalada de tratamiento y comente cualquier plan de cuidados anticipados existente o voluntades anticipadas de rechazar el tratamiento con pacientes que presentan comorbilidades avanzadas preexistentes.[406]
HFNO o ventilación no invasiva
La Organización Mundial de la Salud (OMS) recomienda la HFNO, la presión positiva continua en las vías respiratorias (CPAP) o la ventilación no invasiva (interfaz de casco o máscara facial) en pacientes hospitalizados con enfermedad crítica e insuficiencia respiratoria hipoxémica aguda que no necesiten intubación urgente, en lugar de la oxigenoterapia estándar.[86]
La elección depende de factores como la disponibilidad de dispositivos y el suministro de oxígeno, la comodidad y la experiencia personal, y las consideraciones específicas del paciente (por ejemplo, la claustrofobia con la CPAP o las máscaras de ventilación no invasiva, las molestias nasales con la HFNO).
Se debe considerar la colocación en decúbito prono con el paciente despierto (durante 8-12 horas/día, repartidas en periodos más cortos a lo largo del día) en pacientes graves que requieran oxígeno nasal de alto flujo (HFNO) o ventilación no invasiva.
En el Reino Unido, el National Institute for Health and Care Excellence (NICE) recomienda la CPAP en pacientes con hipoxemia que no responde a la oxigenoterapia con una fracción de oxígeno inspirado de ≥0.4 (40%), y el escalado a la ventilación mecánica invasiva sería una opción pero no se necesita inmediatamente o se acuerda que el soporte respiratorio no debe escalarse más allá de la CPAP.[406]
Garantizar el acceso a los proveedores de cuidados críticos para el asesoramiento, la revisión periódica y la rápida intensificación del tratamiento si es necesario, así como la evaluación periódica y la gestión de los síntomas junto con la asistencia respiratoria no invasiva.
Considerar el uso de HFNO para las personas cuando: no toleran la CPAP pero necesitan oxígeno humidificado a flujos altos; el oxígeno convencional máximo no mantiene sus saturaciones de oxígeno objetivo y no necesitan ventilación mecánica invasiva inmediata o la escalada a la ventilación mecánica invasiva no es adecuada, y la CPAP no es adecuada; o necesitan un descanso de la CPAP (p. ej., durante las comidas, el alivio de la presión de la piel, el cuidado de la boca), necesitan oxígeno humidificado o nebulizadores (o ambos), o necesitan el destete de la CPAP.
No ofrecer de forma rutinaria oxígeno nasal de alto flujo (HFNO) como forma principal de asistencia respiratoria a las personas con insuficiencia respiratoria en las que sería adecuado escalar a la ventilación mecánica invasiva.
Optimice las estrategias de manejo farmacológico y no farmacológico en personas que necesitan asistencia respiratoria no invasiva.
Considere la posibilidad de la posición prona despierta para los pacientes hospitalizados que no están intubados y presentan mayores necesidades de oxígeno.
Las evidencias de la ventilación no invasiva son limitadas.
No hay evidencias seguras de que la asistencia respiratoria no invasiva aumente o disminuya la mortalidad en pacientes con COVID-19 insuficiencia respiratoria aguda.[739]
Las evidencias limitadas indican que la ventilación no invasiva reduce la necesidad de intubación, mejora la utilización de recursos, puede estar asociada a mejores resultados y es segura.[740]
Las evidencias indirectas y de baja certeza indican que la ventilación no invasiva probablemente reduce la mortalidad, de forma similar a la ventilación mecánica invasiva, pero puede aumentar el riesgo de transmisión viral. El HFNO puede reducir la mortalidad en comparación con el no HFNO.[741][742]
La HFNO fue superior a la ventilación no invasiva para la insuficiencia respiratoria aguda en términos de disminución de la mortalidad. Sin embargo, no hubo diferencias significativas en las tasas de intubación y la duración de la estancia hospitalaria entre los dos grupos.[743][744]
El HFNO puede reducir la tasa de intubación y la mortalidad en la unidad de cuidados intensivos a los 28 días, y puede mejorar los días sin ventilador a los 28 días, en comparación con la oxigenoterapia convencional en pacientes con insuficiencia respiratoria aguda. Sin embargo, son necesarios ensayos controlados aleatorizados a gran escala.[745]
El ensayo RECOVERY-RS (un ensayo controlado aleatorizado abierto, multicéntrico y adaptativo) encontró que la CPAP reducía la necesidad de ventilación mecánica invasiva en adultos ingresados en el hospital con insuficiencia respiratoria aguda. Ni la CPAP ni el oxígeno nasal de alto flujo (HFNO) redujeron la mortalidad en comparación con la oxigenoterapia convencional.[746]
El ensayo HELMET-COVID (un ensayo clínico aleatorizado multicéntrico) encontró que la ventilación no invasiva con casco helmet no redujo significativamente la mortalidad a los 28 días en comparación con la asistencia respiratoria habitual (uso alternativo de ventilación no invasiva con mascarilla, oxígeno nasal de alto flujo (HFNO) u oxígeno estándar según la respuesta clínica) entre los pacientes con insuficiencia respiratoria aguda hipoxémica. Sin embargo, el estudio presentaba varias limitaciones importantes, y la interpretación de los resultados está limitada por la imprecisión en la estimación del tamaño del efecto.[747]
El ensayo SOHO-COVID (un ensayo clínico aleatorizado) encontró que el HFNO no redujo significativamente la mortalidad a los 28 días en comparación con la oxigenoterapia estándar entre los pacientes con insuficiencia respiratoria.[748] Otro ensayo controlado aleatorizado encontró que el tratamiento con HFNO reducía la probabilidad de ventilación mecánica invasiva y disminuía el tiempo de recuperación clínica, en comparación con la oxigenoterapia convencional de bajo flujo en pacientes con enfermedad grave.[749]
Se recomiendan precauciones para evitar la transmisión por el aire para estas intervenciones (incluida la CPAP de burbujas) debido a la incertidumbre sobre el potencial de aerosolización.[86]
Sin embargo, la ventilación por presión positiva continua en las vías respiratorias (PPCVR) y oxígeno nasal de alto flujo (HFNO) no parecen estar asociadas a una contaminación vírica adicional significativa del aire o de la superficie en comparación con la oxigenoterapia.[750] A pesar de la tendencia a evitar el HFNO, se ha demostrado que tiene un riesgo de generación de aerosoles similar al de las mascarillas de oxígeno estándar.[751] Una revisión sistemática y un metanálisis no encontraron asociación entre la HFNO y la ventilación no invasiva y la detección de patógenos en el aire con aumento de la generación de aerosoles.[752]
Los pacientes con hipercapnia, inestabilidad hemodinámica, disfunción multiorgánica o estado mental anormal no deberían recibir, por lo general, oxígeno nasal de alto flujo (HFNO), aunque los datos sugieren que puede ser seguro en pacientes con hipercapnia leve a moderada y que no sufre empeoramiento. Los pacientes con insuficiencia respiratoria hipoxémica e inestabilidad hemodinámica, insuficiencia multiorgánica o estado mental anormal no deben recibir estos tratamientos en lugar de otras opciones como la ventilación invasiva.[86]
Se debe monitorizar estrechamente a los pacientes para detectar si existe deterioro agudo. Si los pacientes no mejoran después de una breve prueba de estas intervenciones, entonces requieren una intubación endotraqueal urgente.[86][708]
Una guía más detallada sobre el manejo del síndrome de dificultad respiratoria aguda (SDRA) en COVID-19 está fuera del alcance de este tema; consulte a un especialista para obtener más orientación.
Ventilación mecánica
Se debe considerar la intubación endotraqueal y la ventilación mecánica invasiva en pacientes con SDRA que sufren un grave deterioro a pesar de las medidas avanzadas de soporte ventilatorio no invasivo/de oxígeno.[86]
El uso de la ventilación mecánica en pacientes con COVID-19 implica un alto riesgo de mortalidad. La mortalidad es muy variable entre los estudios, oscilando entre el 21% y el 100%. Se ha informado una razón de riesgo de mortalidad intrahospitalaria global de 0.70 basada en estimaciones agrupadas de efectos aleatorios. Los resultados parecen haber mejorado a medida que ha ido avanzando la pandemia.[753] Sin embargo, los resultados no han sido congruentes.[754]
La intubación temprana puede estar asociada a una menor mortalidad por todas las causas en comparación con los pacientes que reciben una intubación tardía. Sin embargo, una vez más, los resultados no han sido congruentes.[755][756]
La intubación endotraqueal se debe realizar por parte de un proveedor con experiencia, tomando precauciones para evitar la transmisión por el aire.[86]
Los niños pequeños, los adultos que son obesos o las mujeres embarazadas pueden desaturarse rápidamente durante la intubación y, por lo tanto, requieren una preoxigenación con una fracción del 100% de oxígeno inspirado (FiO₂) durante 5 minutos.[86]
Los pacientes ventilados mecánicamente con SDRA deben recibir una estrategia de ventilación que proteja los pulmones, de bajo volumen corriente/baja presión inspiratoria (se recomiendan objetivos más bajos en los niños). En los casos de SDRA moderados a graves, se sugiere una estrategia de presión positiva al final de la espiración (PEEP) más alta que una estrategia de PEEP más baja. Sin embargo, se recomienda la individualización de la PEEP, en la que se monitoriza al paciente por los efectos beneficiosos o perjudiciales y la presión de conducción durante la titulación, teniendo en cuenta los riesgos y beneficios de la titulación de la PEEP.[86][708]
Aunque algunos pacientes con neumonía COVID-19 cumplen los criterios para el SDRA, se discute si la neumonía COVID-19 es una enfermedad específica con fenotipos atípicos. Las evidencias esporádicas de principios de la pandemia sugerían que la principal característica de la presentación atípica era la disociación entre la mecánica pulmonar bien conservada y la gravedad de la hipoxemia.[757][758][759][760][761][762] Sin embargo, esta hipótesis ha sido objeto de críticas.[763][764] Una revisión sistemática y un metanálisis publicados a finales de 2022 no encontraron evidencias de fenotipos clínicos distintos basados en el cumplimiento estático del sistema respiratorio en pacientes con SDRA relacionado con COVID-19.[765]
Se ha argumentado que un enfoque basado en evidencias que extrapola los datos de los SDRA no relacionados con COVID-19 es el enfoque más razonable para los cuidados intensivos de los pacientes de COVID-19.[766] Sin embargo, algunos médicos han advertido de que el uso del ventilador basado en protocolos puede causar lesiones pulmonares en algunos pacientes, y que los ajustes del ventilador deben basarse en los hallazgos fisiológicos en lugar de utilizar protocolos estándar. Un alto nivel de presión positiva final de espiración más alta (PEEP) puede tener un efecto perjudicial en los pacientes con un cumplimiento normal.[757] Por lo tanto, la PEEP siempre debe ajustarse cuidadosamente.[767]
Se debe considerar la ventilación en posición prona en pacientes con SDRA grave durante 12 a 16 horas por día. Las mujeres embarazadas en el tercer trimestre pueden beneficiarse al ser colocadas en posición de decúbito lateral. Se requiere cuidado en los niños.[86][708] En algunos pacientes pueden ser factibles duraciones más largas.[768]
Una revisión sistemática y un metanálisis encontraron que no se observan diferencias significativas en la mortalidad entre la posición en decúbito prono y supino, y que la estancia hospitalaria era significativamente mayor en el grupo de posición en decúbito prono. No se observaron diferencias entre ambos grupos en cuanto a la duración de la estancia en la unidad de cuidados intensivos y los días de ventilación mecánica.[769]
Se sugieren maniobras de reclutamiento alveolar, pero no se recomiendan las maniobras de reclutamiento en escalera.[708]
Una orientación más detallada sobre el manejo de los síndromes de dificultad respiratoria aguda (SDRA) en COVID-19, incluida la sedación y el uso de bloqueo neuromuscular durante la ventilación, está fuera del alcance de este tema; consulte a un especialista para obtener más orientación.
Vasodilatador pulmonar inhalado
Considere la posibilidad de realizar un ensayo de un vasodilatador pulmonar inhalado en adultos y niños que presenten SDRA grave e hipoxemia refractaria a pesar de optimizar la ventilación. Se debe reducir gradualmente si no hay una rápida mejoría en la oxigenación.[708]
Una revisión sistemática y un metanálisis encontraron que los vasodilatadores pulmonares inhalados pueden mejorar la oxigenación, pero no mostraron ningún beneficio en cuanto a la mortalidad, en comparación con el tratamiento estándar.[770]
Oxigenación por membrana extracorpórea
Se debe considerar la oxigenación por membrana extracorpórea (OMEC) de acuerdo con la disponibilidad y la competencia si los métodos anteriores fallan.[86][708]
La evidencia para respaldar el uso de ECMO es limitada.
Un estudio de cohortes basado en un registro encontró que la OMEC se asociaba a una reducción del 7.1% de la mortalidad en adultos seleccionados (es decir, PaO2/FiO2 <80 mmHg) con insuficiencia respiratoria asociada al COVID-19, en comparación con la ventilación mecánica convencional sin oxigenación por membrana extracorpórea (OMEC). Fue más eficaz en pacientes de edad <65 años y en aquellos con una PaO2/FiO2 <80 mmHg o con presiones de distensión >15 cm H2O durante los primeros 10 días de ventilación mecánica.[771]
Las tasas de mortalidad agrupadas en adultos que recibieron OMEC oscilaron entre el 39% y el 49%.[772][773] La tasa de mortalidad infantil fue del 26.6%.[774] Los factores asociados a un mayor riesgo de mortalidad fueron la edad avanzada, el sexo masculino, la enfermedad pulmonar crónica, la mayor duración de los síntomas, la mayor duración de la ventilación mecánica invasiva, la mayor presión de conducción y la mayor presión parcial de dióxido de carbono arterial.[775]
Existe un alto riesgo de complicaciones trombóticas y neurológicas (p. ej., trombosis del circuito, sangrado grave, sangrado intracraneal, accidente cerebrovascular isquémico y lesión cerebral isquémica hipóxica) en pacientes sometidos a OMEC.[776][777][778]
Manejo de shock séptico/sepsis
El manejo de la sepsis y el shock séptico en pacientes con COVID-19 está fuera del alcance de este tema. Ver Complicaciones.
Manejo de síntomas y cuidados de soporte
Considere el manejo de fluidos y electrolitos, el tratamiento antimicrobiano y el manejo de los síntomas, según corresponda (ver COVID-19 grave arriba).
profilaxis de tromboembolia venosa (TEV)
Las recomendaciones para la profilaxis del TEV en pacientes con enfermedad crítica pueden diferir de las de la enfermedad grave (véase más arriba). Consulte las guías de práctica clínica locales.
En el Reino Unido, el NICE recomienda una dosis profiláctica de una heparina de bajo peso molecular a los jóvenes y adultos que necesitan HFNO, CPAP, ventilación no invasiva o ventilación mecánica invasiva, y que no tienen un mayor riesgo de sangrado. Una dosis intermedia o de tratamiento de una heparina de bajo peso molecular solo se recomienda en estos pacientes como parte de un ensayo clínico.[406]
Las pruebas para la profilaxis de la TEV son limitadas en pacientes con enfermedad crítica.
Una revisión sistemática y un metanálisis de casi 28,000 pacientes hospitalizados descubrieron que tanto la anticoagulación a dosis intermedias como a dosis terapéuticas disminuía el riesgo de eventos trombóticos en pacientes críticos en la unidad de cuidados intensivos en comparación con la anticoagulación a dosis profilácticas, pero estos regímenes se asociaban a un mayor riesgo de sangrado y a una mortalidad intrahospitalaria sin cambios.[779]
Otra revisión sistemática y metanálisis de menor tamaño no encontró diferencias entre las dosis aumentadas y las dosis estándar de profilaxis en cuanto al impacto sobre la mortalidad en pacientes críticos. Sin embargo, se observó un menor riesgo de embolia pulmonar en el grupo de dosis escalada.[780]
Otros metanálisis confirmaron la falta de beneficio en la mortalidad en pacientes con enfermedad crítica.[781]
Corticosteroides
La OMS recomienda encarecidamente el tratamiento con corticosteroides sistémicos (dosis bajas de dexametasona o hidrocortisona intravenosa u oral) durante 7 a 10 días en adultos con enfermedad crítica.
Esta recomendación se basa en evidencias de calidad moderada que sugieren que los corticosteroides sistémicos probablemente reducen la mortalidad a los 28 días en pacientes con enfermedad crítica. También es probable que reduzcan la necesidad de ventilación invasiva.[407]
En Estados Unidos, la Sociedad Estadounidense de Enfermedades Infecciosas (IDSA) recomienda la dexametasona (o un corticosteroide alternativo si no se dispone de dexametasona) durante 10 días o hasta el alta hospitalaria en pacientes en estado crítico.[402]
Consulte la sección de corticoesteroides en la sección COVID-19 grave más arriba para obtener más información.
Antivirales
El remdesivir puede aumentar el riesgo de muerte en pacientes en estado crítico y, por esta razón, la OMS, el NICE y la IDSA recomiendan no usar remdesivir de forma rutinaria en pacientes con enfermedad crítica.[402][406][407]
Inhibidores de la interleucina 6 (IL-6)
La OMS recomienda encarecidamente un inhibidor de la IL-6 (tocilizumab o sarilumab) en adultos con enfermedad crítica.[407][663][664]
En el Reino Unido, el NICE recomienda una dosis única de tocilizumab en adultos hospitalizados que reciban corticosteroides sistémicos y necesiten oxigenoterapia o ventilación mecánica.[406][674]
En los Estados Unidos, la IDSA recomienda una dosis única de tocilizumab (o sarilumab si no se dispone de tocilizumab) en pacientes en estado crítico que tienen marcadores elevados de inflamación sistémica además de la atención estándar (es decir, corticosteroides).[402]
Consulte la sección de inhibidores de la IL-6 en COVID-19 grave más arriba para obtener más información.
Inhibidores de la cinasa Janus (JAK)
La OMS recomienda encarecidamente un inhibidor oral de JAK (baricitinib) en adultos con enfermedad crítica.[407][663][664]
En el Reino Unido, el NICE recomienda baricitinib en adultos hospitalizados que: necesiten oxigenoterapia y estén recibiendo o hayan completado un curso de corticosteroides (a menos que esté contraindicado), y no presentan evidencia de infección (además del SARS-CoV-2) que pueda empeorar con baricitinib. También puede considerarse en niños ≥2 años de edad siempre que cumplan los mismos criterios.[406]
En los Estados Unidos, la IDSA recomienda el baricitinib en pacientes en estado crítico que reciben HFNO o ventilación no invasiva (y pacientes que reciben ventilación invasiva o ECMO cuando los inhibidores de IL-6 no están disponibles), además del tratamiento con corticosteroides.[402]
Consulte la sección de inhibidores de JAK en COVID-19 grave más arriba para obtener más información.
Otros fármacos inmunomoduladores
En los EE.UU., la IDSA recomienda el abatacept o el infliximab intravenosos en adultos hospitalizados con enfermedad crítica que reciben corticosteroides sistémicos, como alternativas al baricitinib y al tocilizumab (cuando estos fármacos no están disponibles), sobre la base de pruebas de certeza baja.[402]
Sin embargo, otras guías de práctica clínica aún no recomiendan estos fármacos.
Alta y rehabilitación
Se debe evaluar rutinariamente a los pacientes de cuidados intensivos en lo que respecta a la movilidad, la deglución funcional, el trastorno cognitivo y las preocupaciones respecto a la salud mental y, basándose en esa evaluación, determinar si el paciente está listo para recibir el alta y si presenta algún requisito de rehabilitación y seguimiento.[86]
Cuidados paliativos
Las intervenciones de cuidados paliativos deben ser accesibles en cada institución que atienda a pacientes con COVID-19. Se debe identificar si el paciente tiene un plan de atención anticipada y respetar las prioridades y preferencias del paciente al formular el plan de atención del mismo.[86] Se deben seguir las guías de práctica clínica sobre cuidados paliativos.
Faltan datos sobre los cuidados paliativos en pacientes con COVID-19.
Una revisión de la Cochrane encontró evidencia de muy baja certeza para la eficacia de las intervenciones farmacológicas para el alivio de los síntomas paliativos, y ninguna evidencia sobre la seguridad de las intervenciones farmacológicas o la seguridad y eficacia de las intervenciones no farmacológicas para el control de los síntomas paliativos. Se necesitan más evidencias para orientar el manejo del final de la vida.[782]
Sin embargo, una rápida revisión sistemática de las estrategias farmacológicas utilizadas para los cuidados paliativos en estos pacientes, la primera revisión internacional de este tipo, encontró que una mayor proporción de pacientes requería infusiones subcutáneas continuas para la administración de la medicación de lo que se suele ver en la población de cuidados paliativos. Para el control de los síntomas se requirieron dosis limitadas de medicamentos para cuidados paliativos de uso frecuente. Sin embargo, estos resultados deben interpretarse con precaución debido a la falta de datos disponibles.[735]
Se dispone de un metanálisis en red viva que resume la evidencia disponible para los tratamientos de COVID-19:
Las mujeres embarazadas deben ser atendidas por un equipo multidisciplinario que incluya especialistas en obstetricia, perinatología, neonatología y cuidados intensivos, así como los servicios de obstetricia y soporte a la salud mental y psicosocial. Se recomienda un enfoque de la atención que esté centrado en la mujer y que sea respetuoso y cualificado.[86]
Por lo general, las mujeres embarazadas pueden recibir tratamiento con las mismas terapias de soporte que las adultas no embarazadas, teniendo en cuenta los cambios fisiológicos que se producen con el embarazo.[86] Sin embargo, las recomendaciones de profilaxis para la tromboembolia venosa (TEV) pueden diferir y no se ha establecido la seguridad de los antivirales en el embarazo. A pesar de ello, es importante que a las mujeres embarazadas no se les niegue el tratamiento de forma inadecuada.[783]
Existe una importante heterogeneidad en varios aspectos del manejo de las mujeres embarazadas entre las guías de práctica clínica, especialmente en lo que respecta al seguimiento tras la infección y al momento del parto. Sin embargo, hay un acuerdo general en los criterios de ingreso hospitalario de la madre y en el modo de parto.[784][785]
Siga los procedimientos locales de prevención y control de infecciones durante el parto y los cuidados del recién nacido. La Organización Mundial de la Salud (OMS) recomienda que las madres y los lactantes permanezcan juntos, a menos que la madre esté demasiado enferma para cuidar de su bebé. Debe fomentarse la lactancia materna aplicando al mismo tiempo medidas adecuadas de prevención y control de infecciones (p. ej., higiene de las manos antes y después del contacto con el bebé, uso de mascarilla durante la lactancia).[86]
Una discusión detallada del manejo de las mujeres embarazadas queda fuera del alcance de este tema. Consulte sus protocolos locales para más información.
ამ მასალის გამოყენება ექვემდებარება ჩვენს განცხადებას
