Los objetivos del tratamiento de la enfermedad pulmonar obstructiva crónica (EPOC) son prevenir y controlar los síntomas para reducir la gravedad y la cantidad de exacerbaciones, mejorar la capacidad respiratoria para una mayor tolerancia al ejercicio y reducir la mortalidad.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Las revisiones sistemáticas reportan una reducción moderada en la tasa de disminución del VEF₁ entre los pacientes que reciben tratamiento farmacológico.[84]Celli BR, Anderson JA, Cowans NJ, et al. Pharmacotherapy and lung function decline in patients with chronic obstructive pulmonary disease. A systematic review. Am J Respir Crit Care Med. 2021 Mar 15;203(6):689-98.
https://www.atsjournals.org/doi/10.1164/rccm.202005-1854OC
http://www.ncbi.nlm.nih.gov/pubmed/32966751?tool=bestpractice.com
[85]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com
Es necesario seguir investigando para saber qué pacientes tienen más probabilidades de beneficiarse.
Hay un enfoque gradual de la terapia y el tratamiento debe ser individualizado para el estado de salud general y las comorbilidades. Si un paciente con EPOC presenta asma concomitante, debe tratarse principalmente de acuerdo mediante la guía de práctica clínica para el asma.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Véase el apartado Asma en adultos. Para más detalles sobre el tratamiento de la deficiencia de alfa-1 antitripsina, véase Deficiencia de alfa-1 antitripsina.
El método terapéutico implica la disminución de la exposición del factor de riesgo, la evaluación adecuada de la enfermedad, la educación del paciente, el manejo farmacológico y no farmacológico de la EPOC estable, y la prevención y el tratamiento de las exacerbaciones de la EPOC agudas.
La Organización Mundial de la Salud (OMS) ha especificado un conjunto mínimo de intervenciones para el tratamiento de la EPOC estable en la atención primaria.
WHO: package of essential noncommunicable (PEN) disease interventions for primary health care
Opens in new window
Evaluación continua y monitorización de la enfermedad
La evaluación y monitorización continua de la enfermedad pulmonar obstructiva crónica (EPOC) garantizan que se cumplan los objetivos del tratamiento. La calidad de vida y sensación de bienestar del paciente mejoran, y los ingresos hospitalarios disminuyen significativamente cuando se utilice la automonitorización o monitorización de la enfermedad por parte de un profesional.[86]Lemmens KM, Nieboer AP, Huijsman R. A systematic review of integrated use of disease-management interventions in asthma and COPD. Respir Med. 2009 May;103(5):670-91.
http://www.ncbi.nlm.nih.gov/pubmed/19155168?tool=bestpractice.com
Este tipo de evaluación de la historia clínica debe incluir lo siguiente:
Exposición a los factores de riesgo y medidas de prevención:
Humo del tabaco
Contaminación del aire interior y exterior
Exposiciones laborales (humo, polvo, etc.)
Vacunación contra la gripe y neumococo
Avance de la enfermedad y desarrollo de complicaciones:
Disminución de la tolerancia al ejercicio
Aumento de los síntomas
Empeoramiento de la calidad del sueño
Faltar al trabajo o a otras actividades
Farmacoterapia y otros tratamientos médicos:
Frecuencia con la que se utiliza el inhalador de rescate
Medicamentos nuevos
Cumplimiento del régimen médico
Capacidad para usar los inhaladores correctamente
Efectos adversos
Antecedentes de exacerbaciones
Atención urgente o visitas al servicio de urgencias
Ciclo corto de corticosteroides orales reciente
Evaluación de la frecuencia, la gravedad y las causas probables de exacerbaciones
Comorbilidades:
Además, la evaluación objetiva de la función pulmonar se debe obtener todos los años o con mayor frecuencia si se produce un aumento importante de los síntomas.
Una revisión de la Cochrane descubrió que el manejo integral de la enfermedad (MIE), en el que varios profesionales de salud (fisioterapeuta, médico respiratorio, enfermera, etc.) trabajan conjuntamente con los pacientes, probablemente produce una mejora en la calidad de vida específica de la enfermedad, la capacidad de ejercicio, los ingresos hospitalarios y los días de hospitalización por persona.[87]Poot CC, Meijer E, Kruis AL, et al. Integrated disease management interventions for patients with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2021 Sep 8;(9):CD009437.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD009437.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/34495549?tool=bestpractice.com
[  ]
What are the effects of integrated disease management (IDM) interventions for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3877/full展示答案[证据 A]76ea49b7-0eff-463d-90da-4755f900cedfccaACuáles son los efectos de las intervenciones integradas de manejo de enfermedades (MIE) para las personas con enfermedad pulmonar obstructiva crónica (EPOC)
]
What are the effects of integrated disease management (IDM) interventions for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3877/full展示答案[证据 A]76ea49b7-0eff-463d-90da-4755f900cedfccaACuáles son los efectos de las intervenciones integradas de manejo de enfermedades (MIE) para las personas con enfermedad pulmonar obstructiva crónica (EPOC)
Exacerbaciones agudas
Una exacerbación de la enfermedad pulmonar obstructiva crónica (EPOC) se define como un evento caracterizado por un cambio en los síntomas iniciales de disnea, tos o esputo, que excede las variaciones diarias normales y es agudo en el inicio. Véase Exacerbación de la enfermedad pulmonar obstructiva crónica.
Manejo crónico: terapia escalonada según el grupo GOLD
Las guías de práctica clínica de la Iniciativa Global para la Enfermedad Pulmonar Obstructiva Crónica (GOLD) recomiendan que el tratamiento inicial sea determinado por el grupo GOLD del paciente en el momento del diagnóstico:[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Los broncodilatadores de corta acción de rescate deben ser prescritos a todos los pacientes para el alivio inmediato de los síntomas. Una respuesta negativa al broncodilatador de acción corta puede implicar una exacerbación aguda.
Para los pacientes del grupo A (algunos síntomas [Modified British Medical Research Council {mMRC} 0-1 o Prueba de Evaluación de la EPOC {CAT} <10] y bajo riesgo de exacerbaciones [0-1 exacerbaciones al año, que no requieren ingreso hospitalario]), se ofrece en primera línea un broncodilatador de acción corta o de acción prolongada. Se prefieren los agonistas beta-2 de acción prolongada (LABA) y los antagonistas muscarínicos de acción prolongada (LAMA) a los broncodilatadores de acción corta, excepto en el caso de pacientes con disnea ocasional.
Para los pacientes del grupo B (más síntomas [mMRC ≥2 o CAT ≥10] y bajo riesgo de exacerbaciones [0-1 exacerbaciones al año, que no requieren ingreso hospitalario]), debe ofrecerse tratamiento combinado LABA/LAMA de primera línea en ausencia de problemas de efectos adversos o disponibilidad. En caso contrario, puede prescribirse una monoterapia con un LAMA o un LABA. No existen evidencias para recomendar una clase de broncodilatador de acción prolongada sobre otra para la monoterapia broncodilatadora. La opción debe depender de la percepción del paciente sobre el alivio de los síntomas. Los pacientes del grupo B pueden presentar comorbilidades que se suman a los síntomas e influyen en el pronóstico, por lo que se deben considerar e investigar las posibles comorbilidades.
Para los pacientes del grupo E (alto riesgo de exacerbaciones [≥2 exacerbaciones al año, o ≥1 que requieren ingreso hospitalario] y cualquier nivel de síntomas), el tratamiento combinado LABA/LAMA es la terapia de primera línea en ausencia de problemas con los efectos adversos o la disponibilidad. Puede considerarse el agregado de un corticosteroide inhalado (CSI) a una combinación LABA/LAMA si el recuento de eosinófilos en sangre del paciente es ≥300 células/microlitro (terapia triple). No se recomienda el uso de CSI con LABA solos.
[Figure caption and citation for the preceding image starts]: Manejo farmacológico inicial de la EPOCGlobal Initiative for Chronic Obstructive Lung Disease (GOLD). Estrategia mundial para el diagnóstico, tratamiento y prevención de la enfermedad pulmonar obstructiva crónica (informe 2025); reproducido con permiso [Citation ends].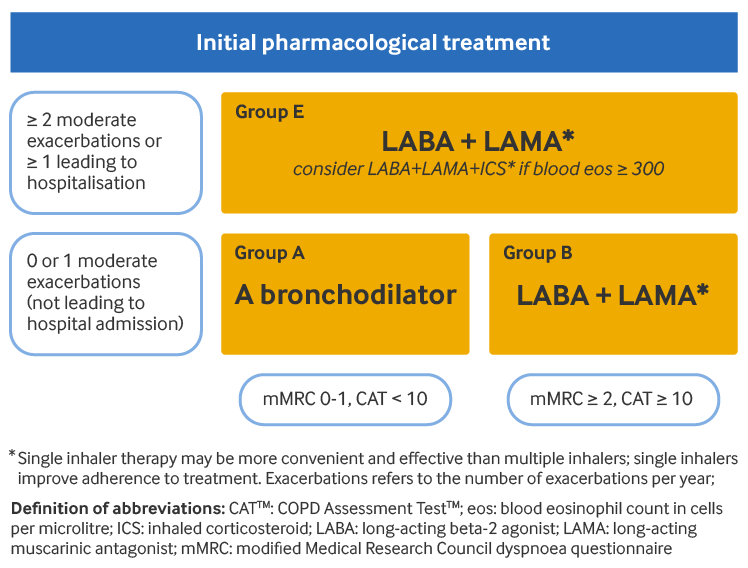
El tratamiento ulterior está determinado por la carga de síntomas de la disnea/limitación de ejercicio del paciente y la frecuencia de las exacerbaciones después de la revisión y es independiente del grupo GOLD del paciente en el momento del diagnóstico. La GOLD (siglas en inglés de Global Initiative for Chronic Obstructive Lung Disease o Iniciativa Global para la Enfermedad Pulmonar Obstructiva Crónica) recomienda diferentes vías de tratamiento dependiendo de si el objetivo principal del tratamiento es aliviar los síntomas de disnea/limitación de ejercicio o reducir las exacerbaciones. Si se requiere un tratamiento para ambos objetivos, los médicos deben seguir la vía de la exacerbación.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Antes de cualquier ajuste en el tratamiento, los pacientes deben ser revisados en cuanto a los síntomas y el riesgo de exacerbación, y se debe evaluar su técnica de inhalación y el cumplimiento del tratamiento. También debe evaluarse el papel del tratamiento no farmacológico. Si la respuesta del paciente al tratamiento inicial es adecuada, se puede mantener el tratamiento inicial. El ajuste del tratamiento farmacológico puede consistir en la escalada o desescalada de la terapia, así como en el cambio de los dispositivos de inhalación o de las moléculas dentro de la misma clase de fármacos. Si se cambia el tratamiento, los médicos deben revisar al paciente para obtener una respuesta clínica y para cualquier efecto adverso potencial.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
La terapia de escalada recomendada para los pacientes con disnea persistente/limitación de ejercicio después de la terapia inicial es la siguiente:[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Los pacientes que reciben broncodilatadores de acción prolongada en monoterapia deben iniciar el tratamiento con un segundo broncodilatador de acción prolongada
Si los síntomas persisten después de la adición de un segundo broncodilatador de acción prolongada
considere cambiar el dispositivo inhalador o las moléculas
implementar o intensificar el tratamiento no farmacológico (p. ej., rehabilitación pulmonar)
considere agregar ensifentrina (un inhibidor de la fosfodiesterasa-3 [PDE-3] y de la PDE-4)
La disnea debida a otras causas debe ser considerada, estudiada y tratada. También deben reevaluarse la técnica de inhalación y el cumplimiento, ya que pueden haber dado lugar a una respuesta inadecuada al tratamiento.
La terapia de escalada recomendada para los pacientes con exacerbaciones persistentes después de la terapia inicial es la siguiente:[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Los pacientes que reciben broncodilatadores de acción prolongada en monoterapia deben aumentar el tratamiento a LABA/LAMA. El recuento de eosinófilos en sangre puede identificar a los pacientes que presentan más probabilidades de responder al CSI.[76]Bafadhel M, Peterson S, De Blas MA, et al. Predictors of exacerbation risk and response to budesonide in patients with chronic obstructive pulmonary disease: a post-hoc analysis of three randomised trials. Lancet Respir Med. 2018 Feb;6(2):117-26.
http://www.ncbi.nlm.nih.gov/pubmed/29331313?tool=bestpractice.com
[77]Harries TH, Rowland V, Corrigan CJ, et al. Blood eosinophil count, a marker of inhaled corticosteroid effectiveness in preventing COPD exacerbations in post-hoc RCT and observational studies: systematic review and meta-analysis. Respir Res. 2020 Jan 3;21(1):3.
https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1268-7
http://www.ncbi.nlm.nih.gov/pubmed/31900184?tool=bestpractice.com
[78]Oshagbemi OA, Odiba JO, Daniel A, et al. Absolute blood eosinophil counts to guide inhaled corticosteroids therapy among patients with COPD: systematic review and meta-analysis. Curr Drug Targets. 2019;20(16):1670-9.
http://www.ncbi.nlm.nih.gov/pubmed/31393244?tool=bestpractice.com
Puede considerarse el escalado a una terapia triple con LABA/LAMA/ICS en pacientes en monoterapia con broncodilatadores de acción prolongada si su recuento de eosinófilos periféricos es ≥300 células/microlitro. Es poco probable que los CSI sean beneficiosos en pacientes cuyo recuento de eosinófilos en sangre sea <100 células/microlitro.
Los pacientes que toman LABA/LAMA y cuyos eosinófilos en la sangre son ≥100 células/microlitro deben pasar a una terapia triple con LABA/LAMA/CSI. Múltiples estudios respaldan la terapia triple con LABA/LAMA/CSI por presentar un resultado superior a la terapia de agente único o doble con LABA/LAMA o LABA/CSI en cuanto a la tasa de exacerbaciones de EPOC moderadas a graves y la tasa de ingreso hospitalario.[80]Cazzola M, Rogliani P, Calzetta L, et al. Triple therapy versus single and dual long-acting bronchodilator therapy in COPD: a systematic review and meta-analysis. Eur Respir J. 2018 Dec 13;52(6):1801586.
https://erj.ersjournals.com/content/52/6/1801586
http://www.ncbi.nlm.nih.gov/pubmed/30309975?tool=bestpractice.com
[88]Singh D, Papi A, Corradi M, et al. Single inhaler triple therapy versus inhaled corticosteroid plus long-acting beta2-agonist therapy for chronic obstructive pulmonary disease (TRILOGY): a double-blind, parallel group, randomised controlled trial. Lancet. 2016 Sep 3;388(10048):963-73.
http://www.ncbi.nlm.nih.gov/pubmed/27598678?tool=bestpractice.com
[89]Vestbo J, Papi A, Corradi M, et al. Single inhaler extrafine triple therapy versus long-acting muscarinic antagonist therapy for chronic obstructive pulmonary disease (TRINITY): a double-blind, parallel group, randomised controlled trial. Lancet. 2017 May 13;389(10082):1919-29.
http://www.ncbi.nlm.nih.gov/pubmed/28385353?tool=bestpractice.com
[90]Papi A, Vestbo J, Fabbri L, et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): a double-blind, parallel group, randomised controlled trial. Lancet. 2018 Mar 17;391(10125):1076-84.
http://www.ncbi.nlm.nih.gov/pubmed/29429593?tool=bestpractice.com
[91]Lipson DA, Barnacle H, Birk R, et al. FULFIL Trial: once-daily triple therapy for patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2017 Aug 15;196(4):438-46.
https://www.atsjournals.org/doi/full/10.1164/rccm.201703-0449OC
http://www.ncbi.nlm.nih.gov/pubmed/28375647?tool=bestpractice.com
[92]Lipson DA, Barnhart F, Brealey N, et al. Once-daily single-inhaler triple versus dual therapy in patients with COPD. N Engl J Med. 2018 May 3;378(18):1671-80.
https://www.nejm.org/doi/10.1056/NEJMoa1713901
http://www.ncbi.nlm.nih.gov/pubmed/29668352?tool=bestpractice.com
[93]Rojas-Reyes MX, García Morales OM, Dennis RJ, et al. Combination inhaled steroid and long-acting beta₂-agonist in addition to tiotropium versus tiotropium or combination alone for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2016 Jun 6;(6):CD008532.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD008532.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27271056?tool=bestpractice.com
[94]Lai CC, Chen CH, Lin CYH, et al. The effects of single inhaler triple therapy vs single inhaler dual therapy or separate triple therapy for the management of chronic obstructive pulmonary disease: a systematic review and meta-analysis of randomized controlled trials. Int J Chron Obstruct Pulmon Dis. 2019 Jul 11;14:1539-48. [Erratum in: Int J Chron Obstruct Pulmon Dis. 2020 Jan 21;15:155-6.]
https://www.dovepress.com/the-effects-of-single-inhaler-triple-therapy-vs-single-inhaler-dual-th-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/31371939?tool=bestpractice.com
[95]Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med. 2020 Jul 2;383(1):35-48.
http://www.ncbi.nlm.nih.gov/pubmed/32579807?tool=bestpractice.com
Las guías de práctica clínica de la American Thoracic Society recomiendan el uso de la terapia triple en pacientes que han presentado una o más exacerbaciones que requieren corticoesteroides orales, antibióticos o ingreso hospitalario en el último año y que presentan síntomas de disnea o reducción de la tolerancia al ejercicio a pesar de la terapia doble de LABA/LAMA.[96]Nici L, Mammen MJ, Charbek E, et al. Pharmacologic management of chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 May 1;201(9):e56-69.
https://www.atsjournals.org/doi/10.1164/rccm.202003-0625ST
http://www.ncbi.nlm.nih.gov/pubmed/32283960?tool=bestpractice.com
Las guías de práctica clínica del Reino Unido recomiendan el uso de terapia triple en pacientes que presentan una exacerbación que requiere ingreso hospitalario, o dos exacerbaciones moderadas en un año, a pesar de la terapia doble con LABA/LAMA.[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].
https://www.nice.org.uk/guidance/ng115
Los pacientes que toman un LABA/LAMA y cuyos eosinófilos en la sangre son <100 células/microlitro deben agregar roflumilast o azitromicina.
La GOLD no recomienda LABA/CSI. Sin embargo, un paciente con EPOC que anteriormente tuvo exacerbaciones que respondieron a LABA/CSI (y no tiene exacerbaciones actuales) puede continuar con LABA/CSI; la alta carga de síntomas puede justificar una escalada a LABA/LAMA/CSI en esta población de pacientes. Si un paciente que actualmente recibe LABA/CSI no tiene antecedentes de exacerbaciones relevantes, considere cambiar a LABA/LAMA. Los pacientes tratados con LABA/CSI con exacerbaciones actuales y recuento de eosinófilos en sangre <100 células/microlitro pueden ser candidatos para cambiar a LABA/LAMA. Aquellos pacientes con exacerbaciones actuales y un recuento de eosinófilos en sangre ≥100 células/microlitro mientras usan LABA/CSI deben ser escalados a una terapia triple mediante la adición de un LAMA.
Los pacientes que toman LABA/LAMA/CSI pueden añadir roflumilast, azitromicina o dupilumab (un anticuerpo monoclonal antagonista del receptor de interleucina [IL]-4). El uso de roflumilast puede considerarse en pacientes con volumen espiratorio forzado en 1 segundo (VEF₁) <50% previsto y bronquitis crónica, particularmente si han tenido al menos un ingreso hospitalario por una exacerbación en el último año. Al recetar azitromicina, debe tenerse en cuenta el riesgo de desarrollar organismos resistentes a los antibióticos. Dupilumab puede considerarse en pacientes con bronquitis crónica cuyo recuento de eosinófilos en sangre es de ≥300 células/microlitro. El CSI puede suspenderse si no es eficaz o causa efectos adversos. Los pacientes con eosinófilos en sangre ≥300 células/microlitro presentan el mayor riesgo de exacerbaciones después de retirar el CSI.[81]Chapman KR, Hurst JR, Frent SM, et al. Long-term triple therapy de-escalation to indacaterol/glycopyrronium in patients with chronic obstructive pulmonary disease (SUNSET): a randomized, double-blind, triple-dummy clinical trial. Am J Respir Crit Care Med. 2018 Aug 1;198(3):329-39.
https://www.atsjournals.org/doi/10.1164/rccm.201803-0405OC
http://www.ncbi.nlm.nih.gov/pubmed/29779416?tool=bestpractice.com
Todos los pacientes son candidatos para intervenciones de educación, vacunación y abandono del hábito de fumar.
[Figure caption and citation for the preceding image starts]: Terapia de intensificación para pacientes con EPOC. Definición de abreviaturas: CSI: corticosteroides inhalados; LABA: agonistas beta-2 de acción prolongada; LAMA: antagonistas muscarínicos de acción prolongadaGlobal Initiative for Chronic Obstructive Lung Disease (GOLD). Estrategia mundial para el diagnóstico, tratamiento y prevención de la enfermedad pulmonar obstructiva crónica (informe 2025); reproducido con permiso [Citation ends].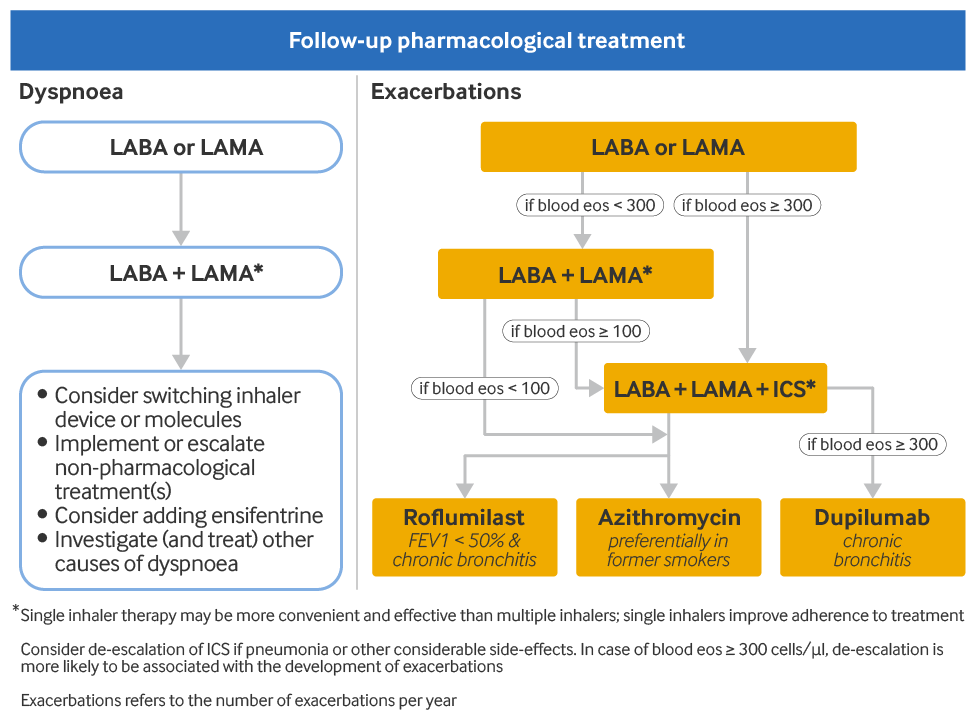
Broncodilatadores
Los agonistas beta-2 son ampliamente utilizados en el tratamiento de la EPOC. Aumentan el monofosfato de adenosina cíclica (MFcA) intracelular, lo que produce la relajación del músculo liso respiratorio y reduce la resistencia de las vías respiratorias. Los antagonistas muscarínicos (anticolinérgicos) actúan como broncodilatadores bloqueando los receptores colinérgicos en el músculo liso respiratorio. Esto produce la relajación del músculo y reduce la limitación del flujo aéreo. Por lo tanto, los agonistas beta y agentes muscarínicos producen efectos broncodilatadores a través de diferentes vías. Ambos están disponibles como preparados de corta y larga duración.
Los agonistas beta-2 de acción corta (p. ej., el salbutamol) y los antagonistas muscarínicos de acción corta (p. ej., el ipratropio) mejoran la función pulmonar y la disnea y la calidad de vida. El ipratropio puede tener un pequeño beneficio sobre los agonistas beta-2 de corta acción para mejorar la calidad de vida asociada a la salud.[97]Appleton S, Jones T, Poole P, et al. Ipratropium bromide versus short acting beta-2 agonists for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2006 Apr 19;(2):CD001387.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001387.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/16625543?tool=bestpractice.com
Estos fármacos pueden utilizarse como terapia de rescate cuando el paciente utiliza un tratamiento broncodilatador de acción prolongada y pueden emplearse como tratamiento inicial para los pacientes del grupo A de GOLD si los pacientes solo tienen disnea ocasional.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[98]Chen AM, Bollmeier SG, Finnegan PM, et al. Long-acting bronchodilator therapy for the treatment of chronic obstructive pulmonary disease. Ann Pharmacother. 2008 Dec;42(12):1832-42.
http://www.ncbi.nlm.nih.gov/pubmed/18957624?tool=bestpractice.com
Sin embargo, en general no se recomienda el uso habitual de broncodilatadores de acción corta.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Se ha demostrado que el tiotropio, un LAMA, reduce el riesgo de exacerbación versus placebo u otros tratamientos de mantenimiento.[99]Halpin DM, Vogelmeier C, Pieper MP, et al. Effect of tiotropium on COPD exacerbations: a systematic review. Respir Med. 2016 May;114:1-8.
https://www.resmedjournal.com/article/S0954-6111(16)30030-0/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/27109805?tool=bestpractice.com
[  ]
How does tiotropium compare with ipratropium bromide for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.2154/fullShow me the answer Los LAMA más recientes, como el aclidinio, el glicopironio y el umeclidinio, presentan al menos una eficacia comparable a la del tiotropio, en lo que se refiere al cambio de la línea de base en el VEF₁, la puntuación focal del índice de disnea transicional, la puntuación del St George's Respiratory Questionnaire y el uso de medicamentos de rescate.[100]Ismaila AS, Huisman EL, Punekar YS, et al. Comparative efficacy of long-acting muscarinic antagonist monotherapies in COPD: a systematic review and network meta-analysis. Int J Chron Obstruct Pulmon Dis. 2015 Nov 16;10(1):2495-517.
https://www.dovepress.com/comparative-efficacy-of-long-acting-muscarinic-antagonist-monotherapie-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/26604738?tool=bestpractice.com
La revefenacina es un LAMA nebulizado aprobado para el tratamiento de mantenimiento de la EPOC de moderada a grave. Se ha sugerido un aumento de la mortalidad cardiovascular en algunos estudios de pacientes que reciben antagonistas muscarínicos de acción corta y en algunos estudios de pacientes que reciben LAMA.[101]Hilleman DE, Malesker MA, Morrow LE, et al. A systematic review of the cardiovascular risk of inhaled anticholinergics in patients with COPD. Int J Chron Obstruct Pulmon Dis. 2009 Jun 29;4:253-63.
https://www.dovepress.com/getfile.php?fileID=5012
http://www.ncbi.nlm.nih.gov/pubmed/19657399?tool=bestpractice.com
[102]Wang MT, Liou JT, Lin CW, et al. Association of cardiovascular risk with inhaled long-acting bronchodilators in patients with chronic obstructive pulmonary disease: a nested case-control study. JAMA Intern Med. 2018 Feb 1;178(2):229-38.
https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2666790
http://www.ncbi.nlm.nih.gov/pubmed/29297057?tool=bestpractice.com
Un estudio llegó a la conclusión de que el aclidinio no estaba asociado con un aumento de los principales eventos cardiovasculares adversos, en comparación con el placebo.[103]Wise RA, Chapman KR, Scirica BM, et al. Effect of aclidinium bromide on major cardiovascular events and exacerbations in high-risk patients with chronic obstructive pulmonary disease: the ASCENT-COPD randomized clinical trial. JAMA. 2019 May 7;321(17):1693-701.
https://jamanetwork.com/journals/jama/fullarticle/2732574
http://www.ncbi.nlm.nih.gov/pubmed/31063575?tool=bestpractice.com
Un estudio de cohorte basado en la población encontró que los hombres de edad más avanzada con EPOC recién iniciados en LAMA presentan un mayor riesgo de infecciones del tracto urinario.[104]Gershon AS, Newman AM, Fischer HD, et al. Inhaled long-acting anticholinergics and urinary tract infection in individuals with COPD. COPD. 2017 Feb;14(1):105-12.
http://www.ncbi.nlm.nih.gov/pubmed/27732117?tool=bestpractice.com
]
How does tiotropium compare with ipratropium bromide for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.2154/fullShow me the answer Los LAMA más recientes, como el aclidinio, el glicopironio y el umeclidinio, presentan al menos una eficacia comparable a la del tiotropio, en lo que se refiere al cambio de la línea de base en el VEF₁, la puntuación focal del índice de disnea transicional, la puntuación del St George's Respiratory Questionnaire y el uso de medicamentos de rescate.[100]Ismaila AS, Huisman EL, Punekar YS, et al. Comparative efficacy of long-acting muscarinic antagonist monotherapies in COPD: a systematic review and network meta-analysis. Int J Chron Obstruct Pulmon Dis. 2015 Nov 16;10(1):2495-517.
https://www.dovepress.com/comparative-efficacy-of-long-acting-muscarinic-antagonist-monotherapie-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/26604738?tool=bestpractice.com
La revefenacina es un LAMA nebulizado aprobado para el tratamiento de mantenimiento de la EPOC de moderada a grave. Se ha sugerido un aumento de la mortalidad cardiovascular en algunos estudios de pacientes que reciben antagonistas muscarínicos de acción corta y en algunos estudios de pacientes que reciben LAMA.[101]Hilleman DE, Malesker MA, Morrow LE, et al. A systematic review of the cardiovascular risk of inhaled anticholinergics in patients with COPD. Int J Chron Obstruct Pulmon Dis. 2009 Jun 29;4:253-63.
https://www.dovepress.com/getfile.php?fileID=5012
http://www.ncbi.nlm.nih.gov/pubmed/19657399?tool=bestpractice.com
[102]Wang MT, Liou JT, Lin CW, et al. Association of cardiovascular risk with inhaled long-acting bronchodilators in patients with chronic obstructive pulmonary disease: a nested case-control study. JAMA Intern Med. 2018 Feb 1;178(2):229-38.
https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2666790
http://www.ncbi.nlm.nih.gov/pubmed/29297057?tool=bestpractice.com
Un estudio llegó a la conclusión de que el aclidinio no estaba asociado con un aumento de los principales eventos cardiovasculares adversos, en comparación con el placebo.[103]Wise RA, Chapman KR, Scirica BM, et al. Effect of aclidinium bromide on major cardiovascular events and exacerbations in high-risk patients with chronic obstructive pulmonary disease: the ASCENT-COPD randomized clinical trial. JAMA. 2019 May 7;321(17):1693-701.
https://jamanetwork.com/journals/jama/fullarticle/2732574
http://www.ncbi.nlm.nih.gov/pubmed/31063575?tool=bestpractice.com
Un estudio de cohorte basado en la población encontró que los hombres de edad más avanzada con EPOC recién iniciados en LAMA presentan un mayor riesgo de infecciones del tracto urinario.[104]Gershon AS, Newman AM, Fischer HD, et al. Inhaled long-acting anticholinergics and urinary tract infection in individuals with COPD. COPD. 2017 Feb;14(1):105-12.
http://www.ncbi.nlm.nih.gov/pubmed/27732117?tool=bestpractice.com
Tanto los LABA como los LAMA mejoran significativamente la función pulmonar, la disnea y el estado de salud y reducen las tasas de exacerbación.
[  ]
How does umeclidinium bromide compare with placebo for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1829/fullShow me the answer[Evidence A]81c5e462-8f36-4687-93b0-cd4b9989ab2accaACómo se compara el umeclidinio con el placebo en personas con enfermedad pulmonar obstructiva crónica (EPOC)? En casos de EPOC estable, si se toma la decisión de utilizar una monoterapia, los LAMA pueden presentar mejores resultados en comparación a los fármacos LABA.[105]Rabe KF, Timmer W, Sagkriotis A, et al. Comparison of a combination of tiotropium plus formoterol to salmeterol plus fluticasone in moderate COPD. Chest. 2008 Aug;134(2):255-62.
http://www.ncbi.nlm.nih.gov/pubmed/18403672?tool=bestpractice.com
Los LAMA presentan un mayor efecto en la reducción de la exacerbación que los LABA en pacientes con EPOC moderada a muy grave.[106]Vogelmeier C, Hederer B, Glaab T, et al; POET-COPD Investigators. Tiotropium versus salmeterol for the prevention of exacerbations of COPD. N Engl J Med. 2011 Mar 24;364(12):1093-103.
https://www.nejm.org/doi/full/10.1056/NEJMoa1008378
http://www.ncbi.nlm.nih.gov/pubmed/21428765?tool=bestpractice.com
[107]Decramer ML, Chapman KR, Dahl R, et al; INVIGORATE investigators. Once-daily indacaterol versus tiotropium for patients with severe chronic obstructive pulmonary disease (INVIGORATE): a randomised, blinded, parallel-group study. Lancet Respir Med. 2013 Sep;1(7):524-33.
http://www.ncbi.nlm.nih.gov/pubmed/24461613?tool=bestpractice.com
En el ensayo UPLIFT, se demostró la seguridad a largo plazo de los LAMA.[108]Celli B, Decramer M, Kesten S, et al. UPLIFT Study Investigators. Mortality in the 4-year trial of tiotropium (UPLIFT) in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2009 Nov 15;180(10):948-55.
https://www.atsjournals.org/doi/full/10.1164/rccm.200906-0876OC
http://www.ncbi.nlm.nih.gov/pubmed/19729663?tool=bestpractice.com
]
How does umeclidinium bromide compare with placebo for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1829/fullShow me the answer[Evidence A]81c5e462-8f36-4687-93b0-cd4b9989ab2accaACómo se compara el umeclidinio con el placebo en personas con enfermedad pulmonar obstructiva crónica (EPOC)? En casos de EPOC estable, si se toma la decisión de utilizar una monoterapia, los LAMA pueden presentar mejores resultados en comparación a los fármacos LABA.[105]Rabe KF, Timmer W, Sagkriotis A, et al. Comparison of a combination of tiotropium plus formoterol to salmeterol plus fluticasone in moderate COPD. Chest. 2008 Aug;134(2):255-62.
http://www.ncbi.nlm.nih.gov/pubmed/18403672?tool=bestpractice.com
Los LAMA presentan un mayor efecto en la reducción de la exacerbación que los LABA en pacientes con EPOC moderada a muy grave.[106]Vogelmeier C, Hederer B, Glaab T, et al; POET-COPD Investigators. Tiotropium versus salmeterol for the prevention of exacerbations of COPD. N Engl J Med. 2011 Mar 24;364(12):1093-103.
https://www.nejm.org/doi/full/10.1056/NEJMoa1008378
http://www.ncbi.nlm.nih.gov/pubmed/21428765?tool=bestpractice.com
[107]Decramer ML, Chapman KR, Dahl R, et al; INVIGORATE investigators. Once-daily indacaterol versus tiotropium for patients with severe chronic obstructive pulmonary disease (INVIGORATE): a randomised, blinded, parallel-group study. Lancet Respir Med. 2013 Sep;1(7):524-33.
http://www.ncbi.nlm.nih.gov/pubmed/24461613?tool=bestpractice.com
En el ensayo UPLIFT, se demostró la seguridad a largo plazo de los LAMA.[108]Celli B, Decramer M, Kesten S, et al. UPLIFT Study Investigators. Mortality in the 4-year trial of tiotropium (UPLIFT) in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2009 Nov 15;180(10):948-55.
https://www.atsjournals.org/doi/full/10.1164/rccm.200906-0876OC
http://www.ncbi.nlm.nih.gov/pubmed/19729663?tool=bestpractice.com
Una combinación de LABA/LAMA puede proporcionar un mejor efecto terapéutico sin aumentar los efectos adversos de cada clase.[105]Rabe KF, Timmer W, Sagkriotis A, et al. Comparison of a combination of tiotropium plus formoterol to salmeterol plus fluticasone in moderate COPD. Chest. 2008 Aug;134(2):255-62.
http://www.ncbi.nlm.nih.gov/pubmed/18403672?tool=bestpractice.com
[109]Tashkin DP, Littner M, Andrews CP, et al. Concomitant treatment with nebulized formoterol and tiotropium in subjects with COPD: a placebo-controlled trial. Respir Med. 2008 Apr;102(4):479-87.
http://www.ncbi.nlm.nih.gov/pubmed/18258423?tool=bestpractice.com
[110]Tashkin DP, Pearle J, Iezzoni D, et al. Formoterol and tiotropium compared with tiotropium alone for treatment of COPD. COPD. 2009 Feb;6(1):17-25.
http://www.ncbi.nlm.nih.gov/pubmed/19229704?tool=bestpractice.com
[111]Vogelmeier C, Kardos P, Harari S, et al. Formoterol mono- and combination therapy with tiotropium in patients with COPD: a 6-month study. Respir Med. 2008 Nov;102(11):1511-20.
http://www.ncbi.nlm.nih.gov/pubmed/18804362?tool=bestpractice.com
[112]Maltais F, Bjermer L, Kerwin EM, et al. Efficacy of umeclidinium/vilanterol versus umeclidinium and salmeterol monotherapies in symptomatic patients with COPD not receiving inhaled corticosteroids: the EMAX randomised trial. Respir Res. 2019 Oct 30;20(1):238.
https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1193-9
http://www.ncbi.nlm.nih.gov/pubmed/31666084?tool=bestpractice.com
Las combinaciones umeclidinio/vilanterol, glicopironio/formoterol, tiotropio/olodaterol y aclidinio/formoterol están aprobadas para el uso en la EPOC. Las revisiones sistemáticas y los metanálisis han encontrado que los tratamientos combinados con un LABA/LAMA:
reducen la tasa de exacerbación en comparación con la monoterapia
se asocian con una mejora clínicamente significativa en la función pulmonar y la calidad de vida relacionada con la salud en pacientes con EPOC leve/moderada, en comparación con placebo[113]Maqsood U, Ho TN, Palmer K, et al. Once daily long-acting beta2-agonists and long-acting muscarinic antagonists in a combined inhaler versus placebo for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 Mar 6;(3):CD012930.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012930.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/30839102?tool=bestpractice.com
[  ]
How does a combined inhaler with once‐daily long‐acting beta2‐agonist (LABA) plus a long‐acting muscarinic antagonist (LAMA) compare with placebo for adults with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2551/fullShow me the answer
]
How does a combined inhaler with once‐daily long‐acting beta2‐agonist (LABA) plus a long‐acting muscarinic antagonist (LAMA) compare with placebo for adults with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2551/fullShow me the answer
mejora el VEF₁ y reduce modestamente el riesgo de neumonía en pacientes con enfermedad pulmonar obstructiva crónica estable, pero aumenta las probabilidades de muerte por cualquier causa del 1% al 1.4%.[114]Fukuda N, Horita N, Kaneko A, et al. Long-acting muscarinic antagonist (LAMA) plus long-acting beta-agonist (LABA) versus LABA plus inhaled corticosteroid (ICS) for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Jun 5;6(6):CD012066.
https://www.doi.org/10.1002/14651858.CD012066.pub3
http://www.ncbi.nlm.nih.gov/pubmed/37276335?tool=bestpractice.com
[  ]
How does long‐acting muscarinic antagonist (LAMA) plus long‐acting beta‐agonist (LABA) compare with LABA plus inhaled corticosteroid (ICS) for people with stable chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4356/fullShow me the answer
]
How does long‐acting muscarinic antagonist (LAMA) plus long‐acting beta‐agonist (LABA) compare with LABA plus inhaled corticosteroid (ICS) for people with stable chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4356/fullShow me the answer
El umeclidinium/vilanterol disminuye el riesgo de exacerbaciones en pacientes con EPOC leve/moderada.[113]Maqsood U, Ho TN, Palmer K, et al. Once daily long-acting beta2-agonists and long-acting muscarinic antagonists in a combined inhaler versus placebo for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 Mar 6;(3):CD012930.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012930.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/30839102?tool=bestpractice.com
[  ]
How does a combined inhaler with once‐daily long‐acting beta2‐agonist (LABA) plus a long‐acting muscarinic antagonist (LAMA) compare with placebo for adults with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2551/fullShow me the answer Una revisión sistemática y un metanálisis de la red encontraron que todas las combinaciones de dosis fija de LABA/LAMA presentaron una eficacia y seguridad similares.[115]Schlueter M, Gonzalez-Rojas N, Baldwin M, et al. Comparative efficacy of fixed-dose combinations of long-acting muscarinic antagonists and long-acting beta2-agonists: a systematic review and network meta-analysis. Ther Adv Respir Dis. 2016 Apr;10(2):89-104.
https://journals.sagepub.com/doi/10.1177/1753465815624612
http://www.ncbi.nlm.nih.gov/pubmed/26746383?tool=bestpractice.com
]
How does a combined inhaler with once‐daily long‐acting beta2‐agonist (LABA) plus a long‐acting muscarinic antagonist (LAMA) compare with placebo for adults with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2551/fullShow me the answer Una revisión sistemática y un metanálisis de la red encontraron que todas las combinaciones de dosis fija de LABA/LAMA presentaron una eficacia y seguridad similares.[115]Schlueter M, Gonzalez-Rojas N, Baldwin M, et al. Comparative efficacy of fixed-dose combinations of long-acting muscarinic antagonists and long-acting beta2-agonists: a systematic review and network meta-analysis. Ther Adv Respir Dis. 2016 Apr;10(2):89-104.
https://journals.sagepub.com/doi/10.1177/1753465815624612
http://www.ncbi.nlm.nih.gov/pubmed/26746383?tool=bestpractice.com
Como se ha descrito anteriormente, la GOLD realiza recomendaciones sobre el fármaco inicial con base en el grupo de riesgo del paciente (A, B, o E).[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Las guías de práctica clínica de la American Thoracic Society recomiendan iniciar la terapia dual LABA/LAMA en lugar de la monoterapia en pacientes con EPOC que presentan disnea o intolerancia al ejercicio.[96]Nici L, Mammen MJ, Charbek E, et al. Pharmacologic management of chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 May 1;201(9):e56-69.
https://www.atsjournals.org/doi/10.1164/rccm.202003-0625ST
http://www.ncbi.nlm.nih.gov/pubmed/32283960?tool=bestpractice.com
Las guías de práctica clínica del Reino Unido recomiendan iniciar una terapia dual con un LABA/LAMA o un LABA/CI si un paciente tiene síntomas o exacerbaciones a pesar del tratamiento no farmacológico y utilizar un broncodilatador de corta acción según sea necesario. La elección del régimen farmacológico inicial en la guía del orientación del Reino Unido se basa en si el paciente presenta o no características de asma o características que sugieren una respuesta a los corticosteroides.[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].
https://www.nice.org.uk/guidance/ng115
Corticosteroides inhalados (CSI)
Cuando estén indicados en pacientes con EPOC, los CSI deben prescribirse siempre en combinación con broncodilatadores de acción prolongada. Se cree que los CSI son eficaces debido a sus efectos antiinflamatorios. El uso de CSI a largo plazo reduce la necesidad de utilizar una terapia de rescate y reduce las exacerbaciones. Además, puede disminuir la mortalidad.[116]Spencer S, Calverley PM, Burge PS, et al. Impact of preventing exacerbations on deterioration of health status in COPD. Eur Respir J. 2004 May;23(5):698-702.
https://erj.ersjournals.com/content/23/5/698
http://www.ncbi.nlm.nih.gov/pubmed/15176682?tool=bestpractice.com
[117]Sin DD, Wu L, Anderson JA, et al. Inhaled corticosteroids and mortality in chronic obstructive pulmonary disease. Thorax. 2005 Dec;60(12):992-7.
http://www.ncbi.nlm.nih.gov/pubmed/16227327?tool=bestpractice.com
[118]Lee HW, Park J, Jo J, et al. Comparisons of exacerbations and mortality among regular inhaled therapies for patients with stable chronic obstructive pulmonary disease: systematic review and Bayesian network meta-analysis. PLoS Med. 2019 Nov;16(11):e1002958.
https://journals.plos.org/plosmedicine/article?id=10.1371/journal.pmed.1002958
http://www.ncbi.nlm.nih.gov/pubmed/31730642?tool=bestpractice.com
El efecto de los regímenes de tratamiento que contienen CI es mayor en los pacientes con mayor riesgo de exacerbaciones (dos o más exacerbaciones y/o un ingreso hospitalario por una exacerbación en el año anterior).[90]Papi A, Vestbo J, Fabbri L, et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): a double-blind, parallel group, randomised controlled trial. Lancet. 2018 Mar 17;391(10125):1076-84.
http://www.ncbi.nlm.nih.gov/pubmed/29429593?tool=bestpractice.com
[92]Lipson DA, Barnhart F, Brealey N, et al. Once-daily single-inhaler triple versus dual therapy in patients with COPD. N Engl J Med. 2018 May 3;378(18):1671-80.
https://www.nejm.org/doi/10.1056/NEJMoa1713901
http://www.ncbi.nlm.nih.gov/pubmed/29668352?tool=bestpractice.com
[119]Wedzicha JA, Banerji D, Chapman KR, et al; FLAME Investigators. Indacaterol-glycopyrronium versus salmeterol-fluticasone for COPD. N Engl J Med. 2016 Jun 9;374(23):2222-34.
https://www.nejm.org/doi/10.1056/NEJMoa1516385
http://www.ncbi.nlm.nih.gov/pubmed/27181606?tool=bestpractice.com
El recuento de eosinófilos en la sangre puede pronosticar la eficacia del agregado de CSI al tratamiento habitual con broncodilatadores de acción prolongada para prevenir las exacerbaciones.[77]Harries TH, Rowland V, Corrigan CJ, et al. Blood eosinophil count, a marker of inhaled corticosteroid effectiveness in preventing COPD exacerbations in post-hoc RCT and observational studies: systematic review and meta-analysis. Respir Res. 2020 Jan 3;21(1):3.
https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1268-7
http://www.ncbi.nlm.nih.gov/pubmed/31900184?tool=bestpractice.com
[78]Oshagbemi OA, Odiba JO, Daniel A, et al. Absolute blood eosinophil counts to guide inhaled corticosteroids therapy among patients with COPD: systematic review and meta-analysis. Curr Drug Targets. 2019;20(16):1670-9.
http://www.ncbi.nlm.nih.gov/pubmed/31393244?tool=bestpractice.com
[79]Pascoe S, Barnes N, Brusselle G, et al. Blood eosinophils and treatment response with triple and dual combination therapy in chronic obstructive pulmonary disease: analysis of the IMPACT trial. Lancet Respir Med. 2019 Sep;7(9):745-56.
http://www.ncbi.nlm.nih.gov/pubmed/31281061?tool=bestpractice.com
Se observa poco o ningún efecto en el recuento de eosinófilos en sangre de <100 células/microlitro, mientras que el efecto máximo se observa en el recuento de eosinófilos en sangre de >300 células/microlitro.[76]Bafadhel M, Peterson S, De Blas MA, et al. Predictors of exacerbation risk and response to budesonide in patients with chronic obstructive pulmonary disease: a post-hoc analysis of three randomised trials. Lancet Respir Med. 2018 Feb;6(2):117-26.
http://www.ncbi.nlm.nih.gov/pubmed/29331313?tool=bestpractice.com
[80]Cazzola M, Rogliani P, Calzetta L, et al. Triple therapy versus single and dual long-acting bronchodilator therapy in COPD: a systematic review and meta-analysis. Eur Respir J. 2018 Dec 13;52(6):1801586.
https://erj.ersjournals.com/content/52/6/1801586
http://www.ncbi.nlm.nih.gov/pubmed/30309975?tool=bestpractice.com
Estos umbrales indican valores límite aproximados que pueden ayudar a los médicos a pronosticar la probabilidad de beneficio del tratamiento.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Los ex fumadores son más sensibles a los corticoides que los fumadores actuales en cualquier recuento de eosinófilos.[79]Pascoe S, Barnes N, Brusselle G, et al. Blood eosinophils and treatment response with triple and dual combination therapy in chronic obstructive pulmonary disease: analysis of the IMPACT trial. Lancet Respir Med. 2019 Sep;7(9):745-56.
http://www.ncbi.nlm.nih.gov/pubmed/31281061?tool=bestpractice.com
Tanto los fumadores actuales, como los ex fumadores con EPOC pueden beneficiarse de los CI en términos de función pulmonar y tasas de exacerbación, aunque el efecto es menor para los fumadores empedernidos o actuales en comparación con los fumadores ligeros o ex fumadores.[92]Lipson DA, Barnhart F, Brealey N, et al. Once-daily single-inhaler triple versus dual therapy in patients with COPD. N Engl J Med. 2018 May 3;378(18):1671-80.
https://www.nejm.org/doi/10.1056/NEJMoa1713901
http://www.ncbi.nlm.nih.gov/pubmed/29668352?tool=bestpractice.com
[120]Sonnex K, Alleemudder H, Knaggs R. Impact of smoking status on the efficacy of inhaled corticosteroids in chronic obstructive pulmonary disease: a systematic review. BMJ Open. 2020 Apr 15;10(4):e037509.
https://bmjopen.bmj.com/content/10/4/e037509
http://www.ncbi.nlm.nih.gov/pubmed/32300001?tool=bestpractice.com
El uso de CSI a corto plazo (≤1 año) puede estar asociado con mayores mejorías en el VEF₁ que el uso a largo plazo, aunque se necesitan más estudios para comprender mejor el efecto del tratamiento en la función pulmonar.[121]Whittaker HR, Jarvis D, Sheikh MR, et al. Inhaled corticosteroids and FEV1 decline in chronic obstructive pulmonary disease: a systematic review. Respir Res. 2019 Dec 4;20(1):277.
https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1249-x
http://www.ncbi.nlm.nih.gov/pubmed/31801539?tool=bestpractice.com
Varios estudios han señalado un mayor riesgo de neumonía en pacientes con EPOC que toman CSI.[85]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com
[  ]
What are the benefits and harms of inhaled corticosteroids (ICS) in people with stable chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4293/fullShow me the answer El riesgo es mayor con fluticasona en comparación con budesonida.[122]Suissa S, Patenaude V, Lapi F, et al. Inhaled corticosteroids in COPD and the risk of serious pneumonia. Thorax. 2013 Nov;68(11):1029-36.
https://thorax.bmj.com/content/68/11/1029.long
http://www.ncbi.nlm.nih.gov/pubmed/24130228?tool=bestpractice.com
[123]Lodise TP, Li J, Gandhi HN, et al. Intraclass difference in pneumonia risk with fluticasone and budesonide in COPD: a systematic review of evidence from direct-comparison studies. Int J Chron Obstruct Pulmon Dis. 2020 Nov 11;15:2889-900.
https://www.dovepress.com/intraclass-difference-in-pneumonia-risk-with-fluticasone-and-budesonid-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/33204085?tool=bestpractice.com
[124]Yang M, Du Y, Chen H, et al. Inhaled corticosteroids and risk of pneumonia in patients with chronic obstructive pulmonary disease: a meta-analysis of randomized controlled trials. Int Immunopharmacol. 2019 Dec;77:105950.
http://www.ncbi.nlm.nih.gov/pubmed/31629940?tool=bestpractice.com
Un estudio realizado en una cohorte de gran tamaño de pacientes daneses descubrió que el riesgo de contraer Pseudomonas aeruginosa, una causa común de neumonía hospitalaria, dependía de la dosis, y que los CSI de dosis altas eran los que presentaban mayor riesgo. El estudio también descubrió que los pacientes con P aeruginosa eran más propensos a tener un IMC y un VEF₁ más bajos que los pacientes sin P aeruginosa.[125]Eklöf J, Ingebrigtsen TS, Sørensen R, et al. Use of inhaled corticosteroids and risk of acquiring Pseudomonas aeruginosa in patients with chronic obstructive pulmonary disease. Thorax. 2022 Jun;77(6):573-80.
https://thorax.bmj.com/content/77/6/573
http://www.ncbi.nlm.nih.gov/pubmed/34446524?tool=bestpractice.com
Una revisión sistemática y un metanálisis encontraron que, a pesar de un aumento significativo del riesgo no ajustado de neumonía asociado al uso de CSI, la mortalidad por neumonía y la mortalidad global no aumentaron en los ensayos aleatorizados controlados y disminuyeron en los estudios observacionales.[126]Festic E, Bansal V, Gupta E, et al. Association of inhaled corticosteroids with incident pneumonia and mortality in COPD patients; systematic review and meta-analysis. COPD. 2016 Jun;13(3):312-26.
https://www.tandfonline.com/doi/full/10.3109/15412555.2015.1081162
http://www.ncbi.nlm.nih.gov/pubmed/26645797?tool=bestpractice.com
Por lo tanto, se debe implementar un método de tratamiento individualizado que evalúe el riesgo del paciente de tener neumonía frente al beneficio de disminución de las exacerbaciones.[85]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com
[127]Welte T. Inhaled corticosteroids in COPD and the risk of pneumonia. Lancet. 2009 Aug 29;374(9691):668-70.
http://www.ncbi.nlm.nih.gov/pubmed/19716946?tool=bestpractice.com
[128]Kew KM, Seniukovich A. Inhaled steroids and risk of pneumonia for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2014 Mar 10;(3):CD010115.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010115.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/24615270?tool=bestpractice.com
También es preocupante el aumento del riesgo de tuberculosis y gripe en pacientes adultos con EPOC que reciben tratamiento con CSI, aunque un metanálisis halló que menos del 1% de todos los casos de tuberculosis evaluados eran atribuibles a la exposición a los CSI.[129]Dong YH, Chang CH, Lin Wu FL, et al. Use of inhaled corticosteroids in patients with COPD and the risk of TB and influenza: a systematic review and meta-analysis of randomized controlled trials. Chest. 2014 Jun;145(6):1286-97.
http://www.ncbi.nlm.nih.gov/pubmed/24504044?tool=bestpractice.com
[130]Castellana G, Castellana M, Castellana C, et al. Inhaled corticosteroids and risk of tuberculosis in patients with obstructive lung diseases: a systematic review and meta-analysis of non-randomized studies. Int J Chron Obstruct Pulmon Dis. 2019 Sep 26;14:2219-27.
https://www.dovepress.com/inhaled-corticosteroids-and-risk-of-tuberculosis-in-patients-with-obst-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/31576118?tool=bestpractice.com
Los CSI también pueden causar candidiasis orofaríngea y ronquera.[85]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com
[
]
What are the benefits and harms of inhaled corticosteroids (ICS) in people with stable chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4293/fullShow me the answer El riesgo es mayor con fluticasona en comparación con budesonida.[122]Suissa S, Patenaude V, Lapi F, et al. Inhaled corticosteroids in COPD and the risk of serious pneumonia. Thorax. 2013 Nov;68(11):1029-36.
https://thorax.bmj.com/content/68/11/1029.long
http://www.ncbi.nlm.nih.gov/pubmed/24130228?tool=bestpractice.com
[123]Lodise TP, Li J, Gandhi HN, et al. Intraclass difference in pneumonia risk with fluticasone and budesonide in COPD: a systematic review of evidence from direct-comparison studies. Int J Chron Obstruct Pulmon Dis. 2020 Nov 11;15:2889-900.
https://www.dovepress.com/intraclass-difference-in-pneumonia-risk-with-fluticasone-and-budesonid-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/33204085?tool=bestpractice.com
[124]Yang M, Du Y, Chen H, et al. Inhaled corticosteroids and risk of pneumonia in patients with chronic obstructive pulmonary disease: a meta-analysis of randomized controlled trials. Int Immunopharmacol. 2019 Dec;77:105950.
http://www.ncbi.nlm.nih.gov/pubmed/31629940?tool=bestpractice.com
Un estudio realizado en una cohorte de gran tamaño de pacientes daneses descubrió que el riesgo de contraer Pseudomonas aeruginosa, una causa común de neumonía hospitalaria, dependía de la dosis, y que los CSI de dosis altas eran los que presentaban mayor riesgo. El estudio también descubrió que los pacientes con P aeruginosa eran más propensos a tener un IMC y un VEF₁ más bajos que los pacientes sin P aeruginosa.[125]Eklöf J, Ingebrigtsen TS, Sørensen R, et al. Use of inhaled corticosteroids and risk of acquiring Pseudomonas aeruginosa in patients with chronic obstructive pulmonary disease. Thorax. 2022 Jun;77(6):573-80.
https://thorax.bmj.com/content/77/6/573
http://www.ncbi.nlm.nih.gov/pubmed/34446524?tool=bestpractice.com
Una revisión sistemática y un metanálisis encontraron que, a pesar de un aumento significativo del riesgo no ajustado de neumonía asociado al uso de CSI, la mortalidad por neumonía y la mortalidad global no aumentaron en los ensayos aleatorizados controlados y disminuyeron en los estudios observacionales.[126]Festic E, Bansal V, Gupta E, et al. Association of inhaled corticosteroids with incident pneumonia and mortality in COPD patients; systematic review and meta-analysis. COPD. 2016 Jun;13(3):312-26.
https://www.tandfonline.com/doi/full/10.3109/15412555.2015.1081162
http://www.ncbi.nlm.nih.gov/pubmed/26645797?tool=bestpractice.com
Por lo tanto, se debe implementar un método de tratamiento individualizado que evalúe el riesgo del paciente de tener neumonía frente al beneficio de disminución de las exacerbaciones.[85]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com
[127]Welte T. Inhaled corticosteroids in COPD and the risk of pneumonia. Lancet. 2009 Aug 29;374(9691):668-70.
http://www.ncbi.nlm.nih.gov/pubmed/19716946?tool=bestpractice.com
[128]Kew KM, Seniukovich A. Inhaled steroids and risk of pneumonia for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2014 Mar 10;(3):CD010115.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010115.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/24615270?tool=bestpractice.com
También es preocupante el aumento del riesgo de tuberculosis y gripe en pacientes adultos con EPOC que reciben tratamiento con CSI, aunque un metanálisis halló que menos del 1% de todos los casos de tuberculosis evaluados eran atribuibles a la exposición a los CSI.[129]Dong YH, Chang CH, Lin Wu FL, et al. Use of inhaled corticosteroids in patients with COPD and the risk of TB and influenza: a systematic review and meta-analysis of randomized controlled trials. Chest. 2014 Jun;145(6):1286-97.
http://www.ncbi.nlm.nih.gov/pubmed/24504044?tool=bestpractice.com
[130]Castellana G, Castellana M, Castellana C, et al. Inhaled corticosteroids and risk of tuberculosis in patients with obstructive lung diseases: a systematic review and meta-analysis of non-randomized studies. Int J Chron Obstruct Pulmon Dis. 2019 Sep 26;14:2219-27.
https://www.dovepress.com/inhaled-corticosteroids-and-risk-of-tuberculosis-in-patients-with-obst-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/31576118?tool=bestpractice.com
Los CSI también pueden causar candidiasis orofaríngea y ronquera.[85]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com
[  ]
What are the benefits and harms of inhaled corticosteroids (ICS) in people with stable chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4293/fullShow me the answer
]
What are the benefits and harms of inhaled corticosteroids (ICS) in people with stable chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4293/fullShow me the answer
Aunque se ha reportado que el uso de CSI aumenta o disminuye el riesgo de cáncer de pulmón, los datos disponibles no parecen apoyar ninguna de las dos conclusiones; se necesitan más estudios.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Los médicos deben sopesar los posibles beneficios y riesgos de la prescripción de CSI y analizarlos con el paciente.[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].
https://www.nice.org.uk/guidance/ng115
Antecedentes de ingresos hospitalarios por exacerbaciones de la EPOC, dos o más exacerbaciones moderadas por año a pesar de los broncodilatadores regulares de larga duración, eosinófilos en sangre de ≥300 células/microlitro, y/o asma previa o concomitante, todos favorecen fuertemente el inicio de CI.[131]Agusti A, Fabbri LM, Singh D, et al. Inhaled corticosteroids in COPD: friend or foe? Eur Respir J. 2018 Dec 13;52(6):1801219.
https://erj.ersjournals.com/content/52/6/1801219
http://www.ncbi.nlm.nih.gov/pubmed/30190269?tool=bestpractice.com
Episodios repetidos de neumonía, eosinófilos sanguíneos <100 células/microlitro y/o antecedentes de infección micobacteriana son factores en contra del uso de CSI.[131]Agusti A, Fabbri LM, Singh D, et al. Inhaled corticosteroids in COPD: friend or foe? Eur Respir J. 2018 Dec 13;52(6):1801219.
https://erj.ersjournals.com/content/52/6/1801219
http://www.ncbi.nlm.nih.gov/pubmed/30190269?tool=bestpractice.com
Se puede considerar el uso de CSI en pacientes con una exacerbación moderada de la EPOC al año a pesar de una tratamiento regular con broncodilatadores de acción prolongada y/o eosinófilos periféricos de 100-300 células/microlitro.[131]Agusti A, Fabbri LM, Singh D, et al. Inhaled corticosteroids in COPD: friend or foe? Eur Respir J. 2018 Dec 13;52(6):1801219.
https://erj.ersjournals.com/content/52/6/1801219
http://www.ncbi.nlm.nih.gov/pubmed/30190269?tool=bestpractice.com
La European Respiratory Society ha producido una guía de práctica clínica sobre la retirada de corticosteroides inhalados en la EPOC.[132]Chalmers JD, Laska IF, Franssen FME, et al. Withdrawal of inhaled corticosteroids in COPD: a European Respiratory Society guideline. Eur Respir J. 2020 Jun 4;55(6):2000351.
https://erj.ersjournals.com/content/55/6/2000351
http://www.ncbi.nlm.nih.gov/pubmed/32366483?tool=bestpractice.com
No se recomienda el uso a largo plazo de corticosteroides orales en la EPOC.[96]Nici L, Mammen MJ, Charbek E, et al. Pharmacologic management of chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 May 1;201(9):e56-69.
https://www.atsjournals.org/doi/10.1164/rccm.202003-0625ST
http://www.ncbi.nlm.nih.gov/pubmed/32283960?tool=bestpractice.com
Algunos pacientes con enfermedades graves no pueden detener completamente el tratamiento después de iniciar los corticosteroides orales para una exacerbación aguda. En este caso, debe mantenerse la dosis más baja posible y considerarse la profilaxis de la osteoporosis.[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].
https://www.nice.org.uk/guidance/ng115
Preparaciones combinadas de broncodilatadores y corticosteroides
En el caso de los pacientes que necesiten ambos fármacos, puede utilizarse una combinación de un broncodilatador de acción prolongada y un CSI.
[  ]
What are the effects of long‐acting inhaled therapies for adults with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2364/fullShow me the answer Esta combinación es práctica y puede ayudar con el cumplimiento del tratamiento a algunos pacientes. La elección del tratamiento en esta categoría se basa en la disponibilidad, y la respuesta y preferencia individuales.[133]Tricco AC, Strifler L, Veroniki AA, et al. Comparative safety and effectiveness of long-acting inhaled agents for treating chronic obstructive pulmonary disease: a systematic review and network meta-analysis. BMJ Open. 2015 Oct 26;5(10):e009183. [Erratum in: BMJ Open. 2019 May 1;9(4):e009183corr1.]
https://bmjopen.bmj.com/content/5/10/e009183.long
http://www.ncbi.nlm.nih.gov/pubmed/26503392?tool=bestpractice.com
La combinación puede proporcionarse en inhaladores separados o en un inhalador combinado.
]
What are the effects of long‐acting inhaled therapies for adults with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2364/fullShow me the answer Esta combinación es práctica y puede ayudar con el cumplimiento del tratamiento a algunos pacientes. La elección del tratamiento en esta categoría se basa en la disponibilidad, y la respuesta y preferencia individuales.[133]Tricco AC, Strifler L, Veroniki AA, et al. Comparative safety and effectiveness of long-acting inhaled agents for treating chronic obstructive pulmonary disease: a systematic review and network meta-analysis. BMJ Open. 2015 Oct 26;5(10):e009183. [Erratum in: BMJ Open. 2019 May 1;9(4):e009183corr1.]
https://bmjopen.bmj.com/content/5/10/e009183.long
http://www.ncbi.nlm.nih.gov/pubmed/26503392?tool=bestpractice.com
La combinación puede proporcionarse en inhaladores separados o en un inhalador combinado.
Múltiples estudios respaldan la terapia triple con LABA/LAMA/CSI por presentar un resultado superior a la terapia de agente único o doble con LABA/LAMA o LABA/CSI en cuanto a la tasa de exacerbaciones de EPOC moderadas a graves y la tasa de ingreso hospitalario.[80]Cazzola M, Rogliani P, Calzetta L, et al. Triple therapy versus single and dual long-acting bronchodilator therapy in COPD: a systematic review and meta-analysis. Eur Respir J. 2018 Dec 13;52(6):1801586.
https://erj.ersjournals.com/content/52/6/1801586
http://www.ncbi.nlm.nih.gov/pubmed/30309975?tool=bestpractice.com
[88]Singh D, Papi A, Corradi M, et al. Single inhaler triple therapy versus inhaled corticosteroid plus long-acting beta2-agonist therapy for chronic obstructive pulmonary disease (TRILOGY): a double-blind, parallel group, randomised controlled trial. Lancet. 2016 Sep 3;388(10048):963-73.
http://www.ncbi.nlm.nih.gov/pubmed/27598678?tool=bestpractice.com
[89]Vestbo J, Papi A, Corradi M, et al. Single inhaler extrafine triple therapy versus long-acting muscarinic antagonist therapy for chronic obstructive pulmonary disease (TRINITY): a double-blind, parallel group, randomised controlled trial. Lancet. 2017 May 13;389(10082):1919-29.
http://www.ncbi.nlm.nih.gov/pubmed/28385353?tool=bestpractice.com
[90]Papi A, Vestbo J, Fabbri L, et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): a double-blind, parallel group, randomised controlled trial. Lancet. 2018 Mar 17;391(10125):1076-84.
http://www.ncbi.nlm.nih.gov/pubmed/29429593?tool=bestpractice.com
[91]Lipson DA, Barnacle H, Birk R, et al. FULFIL Trial: once-daily triple therapy for patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2017 Aug 15;196(4):438-46.
https://www.atsjournals.org/doi/full/10.1164/rccm.201703-0449OC
http://www.ncbi.nlm.nih.gov/pubmed/28375647?tool=bestpractice.com
[92]Lipson DA, Barnhart F, Brealey N, et al. Once-daily single-inhaler triple versus dual therapy in patients with COPD. N Engl J Med. 2018 May 3;378(18):1671-80.
https://www.nejm.org/doi/10.1056/NEJMoa1713901
http://www.ncbi.nlm.nih.gov/pubmed/29668352?tool=bestpractice.com
[93]Rojas-Reyes MX, García Morales OM, Dennis RJ, et al. Combination inhaled steroid and long-acting beta₂-agonist in addition to tiotropium versus tiotropium or combination alone for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2016 Jun 6;(6):CD008532.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD008532.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27271056?tool=bestpractice.com
[94]Lai CC, Chen CH, Lin CYH, et al. The effects of single inhaler triple therapy vs single inhaler dual therapy or separate triple therapy for the management of chronic obstructive pulmonary disease: a systematic review and meta-analysis of randomized controlled trials. Int J Chron Obstruct Pulmon Dis. 2019 Jul 11;14:1539-48. [Erratum in: Int J Chron Obstruct Pulmon Dis. 2020 Jan 21;15:155-6.]
https://www.dovepress.com/the-effects-of-single-inhaler-triple-therapy-vs-single-inhaler-dual-th-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/31371939?tool=bestpractice.com
[95]Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med. 2020 Jul 2;383(1):35-48.
http://www.ncbi.nlm.nih.gov/pubmed/32579807?tool=bestpractice.com
El uso de los CSI también reduce la tasa de disminución de la función pulmonar después de una exacerbación en pacientes con EPOC leve a moderada y eosinófilos elevados en la sangre.[134]Kerkhof M, Voorham J, Dorinsky P, et al. Association between COPD exacerbations and lung function decline during maintenance therapy. Thorax. 2020 Sep;75(9):744-53.
https://thorax.bmj.com/content/75/9/744
http://www.ncbi.nlm.nih.gov/pubmed/32532852?tool=bestpractice.com
Un ensayo aleatorizado controlado ha informado de una reducción de la mortalidad por cualquier causa en los pacientes con VEF₁ <50% y, al menos, una exacerbación en el último año en los que toman fluticasona furoato/umeclidinio/vilanterol, en comparación con los pacientes que toman umeclidinio/vilanterol. Los pacientes con EPOC leve y, al menos, dos exacerbaciones moderadas o una grave en el último año también presentaron una reducción de la mortalidad por cualquier causa al tomar fluticasona furoato/umeclidinium/vilanterol, en comparación con umeclidinium/vilanterol.[135]Lipson DA, Crim C, Criner GJ, et al. Reduction in all-cause mortality with fluticasone furoate/umeclidinium/vilanterol in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2020 Jun 15;201(12):1508-16.
https://www.atsjournals.org/doi/10.1164/rccm.201911-2207OC
http://www.ncbi.nlm.nih.gov/pubmed/32162970?tool=bestpractice.com
Otro ensayo controlado aleatorizado presentó resultados similares en cuanto a la mortalidad en el brazo de triple terapia (budesonida/glicopironio/formoterol), pero solo con la dosis más alta de IC.[95]Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med. 2020 Jul 2;383(1):35-48.
http://www.ncbi.nlm.nih.gov/pubmed/32579807?tool=bestpractice.com
[136]Martinez FJ, Rabe KF, Ferguson GT, et al. Reduced all-cause mortality in the ETHOS trial of budesonide/glycopyrrolate/formoterol for chronic obstructive pulmonary disease. A randomized, double-blind, multicenter, parallel-group study. Am J Respir Crit Care Med. 2021 Mar 1;203(5):553-64.
https://www.atsjournals.org/doi/10.1164/rccm.202006-2618OC
http://www.ncbi.nlm.nih.gov/pubmed/33252985?tool=bestpractice.com
El mismo estudio demostró que el aumento de la dosis de budesonida en la terapia triple no disminuye la tasa de exacerbaciones, en comparación con la dosis estándar de la terapia triple.[95]Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med. 2020 Jul 2;383(1):35-48.
http://www.ncbi.nlm.nih.gov/pubmed/32579807?tool=bestpractice.com
En ambos estudios no se observaron diferencias en cuanto a la mortalidad, en comparación con el LABA/CI.[95]Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med. 2020 Jul 2;383(1):35-48.
http://www.ncbi.nlm.nih.gov/pubmed/32579807?tool=bestpractice.com
[135]Lipson DA, Crim C, Criner GJ, et al. Reduction in all-cause mortality with fluticasone furoate/umeclidinium/vilanterol in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2020 Jun 15;201(12):1508-16.
https://www.atsjournals.org/doi/10.1164/rccm.201911-2207OC
http://www.ncbi.nlm.nih.gov/pubmed/32162970?tool=bestpractice.com
[136]Martinez FJ, Rabe KF, Ferguson GT, et al. Reduced all-cause mortality in the ETHOS trial of budesonide/glycopyrrolate/formoterol for chronic obstructive pulmonary disease. A randomized, double-blind, multicenter, parallel-group study. Am J Respir Crit Care Med. 2021 Mar 1;203(5):553-64.
https://www.atsjournals.org/doi/10.1164/rccm.202006-2618OC
http://www.ncbi.nlm.nih.gov/pubmed/33252985?tool=bestpractice.com
Un análisis combinado post hoc de tres ensayos de triple terapia en pacientes con EPOC y limitación grave del flujo aéreo y una anamnesis de exacerbaciones mostró una tendencia no significativa a una menor mortalidad con la triple terapia, en comparación con los tratamientos sin CSI.[137]Vestbo J, Fabbri L, Papi A, et al. Inhaled corticosteroid containing combinations and mortality in COPD. Eur Respir J. 2018 Dec 13;52(6):1801230.
https://erj.ersjournals.com/content/52/6/1801230
http://www.ncbi.nlm.nih.gov/pubmed/30209195?tool=bestpractice.com
Estos resultados se ven reforzados por los hallazgos de un metanálisis de más de 200 estudios: la terapia triple proporcionó una reducción significativa de la mortalidad frente a la terapia dual, aunque se asoció a un mayor riesgo de neumonía. No se observaron diferencias entre los regímenes en cuanto a la función pulmonar o la calidad de vida relacionada con la salud.[138]Axson EL, Lewis A, Potts J, et al. Inhaled therapies for chronic obstructive pulmonary disease: a systematic review and meta-analysis. BMJ Open. 2020 Sep 29;10(9):e036455.
https://bmjopen.bmj.com/content/10/9/e036455
http://www.ncbi.nlm.nih.gov/pubmed/32994234?tool=bestpractice.com
Antes de recetar la terapia triple, los médicos deben evaluar si otra afección física o mental podría estar causando los síntomas del paciente. Las guías de práctica clínica del Reino Unido recomiendan a los clínicos que revisen a los pacientes que toman la terapia triple para el alivio de los síntomas diarios después de 3 meses. El tratamiento debe cambiarse a LABA/LAMA si los síntomas del paciente no han mejorado.[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].
https://www.nice.org.uk/guidance/ng115
Se puede retirar el CSI si el paciente no ha presentado exacerbaciones en el último año.[96]Nici L, Mammen MJ, Charbek E, et al. Pharmacologic management of chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 May 1;201(9):e56-69.
https://www.atsjournals.org/doi/10.1164/rccm.202003-0625ST
http://www.ncbi.nlm.nih.gov/pubmed/32283960?tool=bestpractice.com
Una revisión sistemática de los datos de los estudios del mundo real halló poca o ninguna evidencia de resultados empeorados cuando se retiró el CSI y se continuó con un manejo farmacológico adecuado en pacientes con EPOC moderada a grave.[139]Rogliani P, Ritondo BL, Gabriele M, et al. Optimizing de-escalation of inhaled corticosteroids in COPD: a systematic review of real-world findings. Expert Rev Clin Pharmacol. 2020 Sep;13(9):977-90.
https://www.tandfonline.com/doi/full/10.1080/17512433.2020.1817739
http://www.ncbi.nlm.nih.gov/pubmed/32885691?tool=bestpractice.com
o inhibidores de la fosfodiesterasa
El roflumilast es un inhibidor oral de la fosfodiesterasa (PDE)-4 que inhibe la descomposición de la adenosín monofosfato cíclico (AMPc). Se puede considerar que en pacientes con VEF₁ <50% previsto y bronquitis crónica que están tomando LABA/LAMA/CSI, particularmente si han tenido al menos un ingreso hospitalario por una exacerbación en el último año.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
El roflumilast ofrece beneficios para mejorar la función pulmonar y reducir la probabilidad de exacerbaciones. Sin embargo, tiene poco impacto en la calidad de vida o los síntomas.[140]Janjua S, Fortescue R, Poole P. Phosphodiesterase-4 inhibitors for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2020 May 1;(5):CD002309.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002309.pub6/full
http://www.ncbi.nlm.nih.gov/pubmed/32356609?tool=bestpractice.com
[  ]
How do phosphodiesterase‐4 inhibitors compare with placebo for people with chronic obstructive pulmonary disease?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3151/fullShow me the answer
]
How do phosphodiesterase‐4 inhibitors compare with placebo for people with chronic obstructive pulmonary disease?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3151/fullShow me the answer
La ensifentrina es un inhibidor selectivo de la PDE-3 y la PDE-4 aprobado en los EE.UU. para el tratamiento de mantenimiento de la EPOC en adultos. Combina efectos broncodilatadores y antiinflamatorios no esteroideos en una sola molécula. La ensifentrina puede considerarse como un broncodilatador complementario para los pacientes con EPOC estable que toman LABA/LAMA y que tienen síntomas persistentes de disnea.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Los beneficios clínicos fueron evidentes cuando se utilizó como monoterapia y con otros tratamientos de mantenimiento.[141]Anzueto A, Barjaktarevic IZ, Siler TM, et al. Ensifentrine, a novel phosphodiesterase 3 and 4 inhibitor for the treatment of chronic obstructive pulmonary disease: randomized, double-blind, placebo-controlled, multicenter phase III trials (the ENHANCE trials). Am J Respir Crit Care Med. 2023 Aug 15;208(4):406-16.
https://www.atsjournals.org/doi/10.1164/rccm.202306-0944OC?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/37364283?tool=bestpractice.com
No obstante, el lugar de la enfensitrina en el tratamiento requiere más estudio.
Antibióticos
Se puede considerar la posibilidad de utilizar antibióticos profilácticos, como los macrólidos, para reducir el riesgo de exacerbación aguda, en particular en los pacientes que presentan exacerbaciones frecuentes y son refractarios al tratamiento estándar.[142]Simoens S, Laekeman G, Decramer M. Preventing COPD exacerbations with macrolides: a review and budget impact analysis. Respir Med. 2013 May;107(5):637-48.
http://www.ncbi.nlm.nih.gov/pubmed/23352223?tool=bestpractice.com
[143]Lee JS, Park DA, Hong Y, et al. Systematic review and meta-analysis of prophylactic antibiotics in COPD and/or chronic bronchitis. Int J Tuberc Lung Dis. 2013 Feb;17(2):153-62.
http://www.ncbi.nlm.nih.gov/pubmed/23317949?tool=bestpractice.com
[144]Uzun S, Djamin RS, Kluytmans JA, et al. Azithromycin maintenance treatment in patients with frequent exacerbations of chronic obstructive pulmonary disease (COLUMBUS): a randomised, double-blind, placebo-controlled trial. Lancet Respir Med. 2014 May;2(5):361-8.
http://www.ncbi.nlm.nih.gov/pubmed/24746000?tool=bestpractice.com
[145]Janjua S, Mathioudakis AG, Fortescue R, et al. Prophylactic antibiotics for adults with chronic obstructive pulmonary disease: a network meta-analysis. Cochrane Database Syst Rev. 2021 Jan 15;(1):CD013198.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013198.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/33448349?tool=bestpractice.com
Una revisión de la Cochrane clasificó los macrólidos en primer lugar para reducir las exacerbaciones y los eventos adversos graves, y mejorar la calidad de vida, por encima de las fluoroquinolonas y las tetraciclinas.[145]Janjua S, Mathioudakis AG, Fortescue R, et al. Prophylactic antibiotics for adults with chronic obstructive pulmonary disease: a network meta-analysis. Cochrane Database Syst Rev. 2021 Jan 15;(1):CD013198.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013198.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/33448349?tool=bestpractice.com
El uso de antibióticos macrólidos profilácticos disminuye la frecuencia de las exacerbaciones en los pacientes con EPOC, pero el uso de azitromicina a largo plazo se asocia con una pérdida de audición clínicamente significativa, que en muchos casos era reversible.[146]Herath SC, Normansell R, Maisey S, et al. Prophylactic antibiotic therapy for chronic obstructive pulmonary disease (COPD). Cochrane Database Syst Rev. 2018 Oct 30;(10):CD009764.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD009764.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/30376188?tool=bestpractice.com
[  ]
What are the effects of prophylactic antibiotics for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2431/fullMostrarme la respuesta No hay datos que demuestren la eficacia o la seguridad del tratamiento crónico con azitromicina después de un año de tratamiento.
]
What are the effects of prophylactic antibiotics for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2431/fullMostrarme la respuesta No hay datos que demuestren la eficacia o la seguridad del tratamiento crónico con azitromicina después de un año de tratamiento.
Se cree que el tratamiento con azitromicina es más eficaz para prevenir la exacerbación aguda, y se observa una mayor eficacia en los pacientes de edad avanzada y en las etapas más leves de GOLD. Existe poca evidencia del beneficio del tratamiento en los fumadores activos.[147]Han MK, Tayob N, Murray S, et al. Predictors of chronic obstructive pulmonary disease exacerbation reduction in response to daily azithromycin therapy. Am J Respir Crit Care Med. 2014 Jun 15;189(12):1503-8.
https://www.atsjournals.org/doi/full/10.1164/rccm.201402-0207OC#.V9weczUpW9Y
http://www.ncbi.nlm.nih.gov/pubmed/24779680?tool=bestpractice.com
La azitromicina aumenta el riesgo de colonización con organismos resistentes a los macrólidos y no se debe recetar a pacientes con problemas de audición, taquicardia en reposo o riesgo aparente de prolongación del QTc.+[148]Albert RK, Connett J, Bailey WC, et al; COPD Clinical Research Network. Azithromycin for prevention of exacerbations of COPD. N Engl J Med. 2011 Aug 25;365(8):689-98.
https://www.nejm.org/doi/full/10.1056/NEJMoa1104623
http://www.ncbi.nlm.nih.gov/pubmed/21864166?tool=bestpractice.com
La azitromicina debe considerarse preferentemente, pero no como única opción, en los ex fumadores con exacerbaciones persistentes a pesar del tratamiento adecuado.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Las guías de práctica clínica del Reino Unido aconsejan que se considere la posibilidad de administrar azitromicina profiláctica a aquellos pacientes que presentan más de tres exacerbaciones agudas que requieran tratamiento con corticosteroides y, al menos, una exacerbación que requiera ingreso hospitalario por año.[149]Smith D, Du Rand I, Addy CL, et al. British Thoracic Society guideline for the use of long-term macrolides in adults with respiratory disease. Thorax. 2020 May;75(5):370-404.
https://thorax.bmj.com/content/75/5/370
http://www.ncbi.nlm.nih.gov/pubmed/32303621?tool=bestpractice.com
Antes de iniciar con los antibióticos profilácticos, se debe realizar un ECG inicial y pruebas de función hepática, se debe obtener una muestra de esputo para cultivo y sensibilidad (incluidas pruebas de tuberculosis), se debe optimizar la técnica de eliminación del esputo del paciente y se debe descartar una bronquiectasia con una exploración por TC.[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].
https://www.nice.org.uk/guidance/ng115
[149]Smith D, Du Rand I, Addy CL, et al. British Thoracic Society guideline for the use of long-term macrolides in adults with respiratory disease. Thorax. 2020 May;75(5):370-404.
https://thorax.bmj.com/content/75/5/370
http://www.ncbi.nlm.nih.gov/pubmed/32303621?tool=bestpractice.com
El ECG y las pruebas de hígado deben repetirse después de un mes de tratamiento. Una comparación directa de las fluoroquinolonas, tetraciclinas y macrólidos administrados durante 12-13 semanas a personas con EPOC no identificó ninguna diferencia en la eficacia o la seguridad entre las clases de antibióticos, pero el tamaño de la muestra de los estudios incluidos fue de pequeño tamaño y los estudios fueron de corta duración; es necesario seguir investigando en esta área.[150]Threapleton CJ, Janjua S, Fortescue R, et al. Head-to-head oral prophylactic antibiotic therapy for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 May 24;(5):CD013024.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013024.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/31125127?tool=bestpractice.com
La terapia de antibióticos profilácticos debe revisarse a los 6 y 12 meses para determinar si hay un beneficio en términos de tasas de exacerbación.[149]Smith D, Du Rand I, Addy CL, et al. British Thoracic Society guideline for the use of long-term macrolides in adults with respiratory disease. Thorax. 2020 May;75(5):370-404.
https://thorax.bmj.com/content/75/5/370
http://www.ncbi.nlm.nih.gov/pubmed/32303621?tool=bestpractice.com
Si la antibioticoterapia no es eficaz, debe interrumpirse.
Terapias biológicas
Dupilumab, un antagonista del receptor de IL-4, puede considerarse para pacientes con EPOC moderada a grave que toman LABA/LAMA/CSI con antecedentes de exacerbaciones, bronquitis crónica y eosinófilos en sangre ≥300 células/microlitro.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[151]Bhatt SP, Rabe KF, Hanania NA, et al. Dupilumab for COPD with type 2 inflammation indicated by eosinophil counts. N Engl J Med. 2023 Jul 20;389(3):205-14.
https://www.doi.org/10.1056/NEJMoa2303951
http://www.ncbi.nlm.nih.gov/pubmed/37272521?tool=bestpractice.com
[152]Bhatt SP, Rabe KF, Hanania NA, et al. Dupilumab for COPD with blood eosinophil evidence of type 2 inflammation. N Engl J Med. 2024 Jun 27;390(24):2274-83.
http://www.ncbi.nlm.nih.gov/pubmed/38767614?tool=bestpractice.com
El dupilumab no debe usarse para el alivio del broncoespasmo agudo. Dupilumab está aprobado en los EE. UU. y Europa para el tratamiento de mantenimiento complementario en adultos con EPOC no controlada caracterizada por eosinófilos en sangre elevados.
Metilxantinas
La teofilina (un fármaco de metilxantina) es un broncodilatador que aumenta la AMPc y produce la relajación del músculo liso respiratorio posteriormente. No se utiliza con frecuencia debido a su potencia limitada, intervalo terapéutico estrecho, perfil de alto riesgo y frecuentes interacciones farmacológicas. La teofilina presenta efectos modestos en la función pulmonar en los casos de EPOC de moderada a grave.[153]Ram FSF, Jones P, Jardim J, et al. Oral theophylline for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2002;(4):CD003902.
http://www.ncbi.nlm.nih.gov/pubmed/12519617?tool=bestpractice.com
Un gran ensayo aleatorizado controlado no halló ningún efecto de la teofilina oral sola o con prednisolona en las exacerbaciones de la EPOC grave.[154]Jenkins CR, Wen FQ, Martin A, et al; TASCS study investigators. The effect of low-dose corticosteroids and theophylline on the risk of acute exacerbations of COPD: the TASCS randomised controlled trial. Eur Respir J. 2021 Jun 10;57(6):2003338.
https://erj.ersjournals.com/content/57/6/2003338
http://www.ncbi.nlm.nih.gov/pubmed/33334939?tool=bestpractice.com
Los expertos pueden recetar teofilina después de que el paciente haya agotado todas las opciones de terapias inhaladas. La teofilina no se recomienda, a menos que no se disponga de otros broncodilatadores a largo plazo o no sean asequibles.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Educación y autocontrol del paciente
Todos los pacientes deben estar bien informados sobre la evolución de la enfermedad, y los síntomas de una exacerbación o descompensación. Su expectativa en cuando a la enfermedad, al tratamiento y al pronóstico debe ser realista. Es importante recordar que no se ha demostrado que ningún medicamento modifique la disminución de la función pulmonar a largo plazo, y la meta principal de la farmacoterapia es controlar los síntomas y prevenir complicaciones.
Una revisión de la Cochrane encontró que las intervenciones de autocontrol que incluyen un plan de acción para las exacerbaciones agudas de la EPOC se asocian con mejoría en la calidad de vida asociada a la salud y con menos ingresos hospitalarios como consecuencia de problemas respiratorios. Un análisis exploratorio encontró una pequeña tasa de mortalidad asociada a la respiración, pero significativamente mayor, para el autocontrol en comparación con la atención habitual, aunque no se observó un riesgo excesivo de mortalidad por cualquier causa.[155]Lenferink A, Brusse-Keizer M, van der Valk PD, et al. Self-management interventions including action plans for exacerbations versus usual care in patients with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017 Aug 4;(8):CD011682.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD011682.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/28777450?tool=bestpractice.com
Un ensayo controlado aleatorizado mostró que un programa de 3 meses de automanejo iniciado en pacientes con exacerbaciones de la EPOC con un alta hospitalaria reciente llevó a un aumento de los ingresos hospitalarios relacionados con la EPOC y las visitas al servicio de urgencias durante 6 meses.[156]Aboumatar H, Naqibuddin M, Chung S, et al. Effect of a hospital-initiated program combining transitional care and long-term self-management support on outcomes of patients hospitalized with chronic obstructive pulmonary disease: a randomized clinical trial. JAMA. 2019 Oct 8;322(14):1371-80.
https://jamanetwork.com/journals/jama/fullarticle/2752467
http://www.ncbi.nlm.nih.gov/pubmed/31593271?tool=bestpractice.com
Los planes de automanejo deben incluir asesoramiento personalizado sobre: técnicas de gestión de la disnea y el estrés; conservación de la energía; cómo evitar los factores agravantes; cómo monitorizar los síntomas; cómo controlar el empeoramiento de los síntomas; y la información de contacto que debe utilizarse en caso de una exacerbación.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Ayudar a los pacientes al automanejo debe resolver idealmente las inquietudes psicosociales y las creencias personales de los pacientes sobre la EPOC y su manejo. Muchos pacientes informan deterioro y limitaciones en su estilo de vida e interacción social después de un diagnóstico de EPOC. Se calcula que los pacientes con EPOC presentan 1.9 veces más probabilidades de morir por suicidio que los que no la padecen, y son frecuentes los síntomas de ansiedad, depresión y frustración.[157]Sampaio MS, Vieira WA, Bernardino ÍM, et al. Chronic obstructive pulmonary disease as a risk factor for suicide: a systematic review and meta-analysis. Respir Med. 2019 May;151:11-18.
https://www.resmedjournal.com/article/S0954-6111(19)30093-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/31047105?tool=bestpractice.com
[158]Russell S, Ogunbayo OJ, Newham JJ, et al. Qualitative systematic review of barriers and facilitators to self-management of chronic obstructive pulmonary disease: views of patients and healthcare professionals. NPJ Prim Care Respir Med. 2018 Jan 17;28(1):2.
https://www.nature.com/articles/s41533-017-0069-z
http://www.ncbi.nlm.nih.gov/pubmed/29343739?tool=bestpractice.com
Algunos estudios han encontrado un efecto beneficioso de la terapia cognitiva conductual (TCC) en los resultados, incluidos los síntomas de depresión y ansiedad, la calidad de vida y la frecuencia de las visitas al servicio de urgencias.[159]Pollok J, van Agteren JE, Esterman AJ, et al. Psychological therapies for the treatment of depression in chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 Mar 6;(3):CD012347.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012347.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/30838649?tool=bestpractice.com
[160]Ma RC, Yin YY, Wang YQ, et al. Effectiveness of cognitive behavioural therapy for chronic obstructive pulmonary disease patients: a systematic review and meta-analysis. Complement Ther Clin Pract. 2020 Feb;38:101071.
http://www.ncbi.nlm.nih.gov/pubmed/31743870?tool=bestpractice.com
[161]Williams MT, Johnston KN, Paquet C. Cognitive behavioral therapy for people with chronic obstructive pulmonary disease: rapid review. Int J Chron Obstruct Pulmon Dis. 2020 Apr 23;15:903-19.
https://www.dovepress.com/cognitive-behavioral-therapy-for-people-with-chronic-obstructive-pulmo-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/32425516?tool=bestpractice.com
Se justifica la realización de más investigaciones sobre los efectos de la TCC de alta intensidad de recursos frente a la de baja intensidad de recursos.[161]Williams MT, Johnston KN, Paquet C. Cognitive behavioral therapy for people with chronic obstructive pulmonary disease: rapid review. Int J Chron Obstruct Pulmon Dis. 2020 Apr 23;15:903-19.
https://www.dovepress.com/cognitive-behavioral-therapy-for-people-with-chronic-obstructive-pulmo-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/32425516?tool=bestpractice.com
Un ensayo controlado aleatorizado encontró que una intervención de formación sanitaria telefónica para promover el cambio de conducta en pacientes con EPOC leve en la atención primaria produjo mejorías en las actividades de autocontrol, pero no mejoró la calidad de vida asociada a la salud.[162]Jolly K, Sidhu MS, Hewitt CA, et al. Self management of patients with mild COPD in primary care: randomised controlled trial. BMJ. 2018 Jun 13;361:k2241.
https://www.bmj.com/content/361/bmj.k2241.long
http://www.ncbi.nlm.nih.gov/pubmed/29899047?tool=bestpractice.com
En un metanálisis se observó que la educación en temas de salud que incluía el establecimiento de objetivos, entrevistas motivacionales y educación en temas de salud asociada a EPOC mejoraba significativamente la calidad de vida relacionada con la salud y reducía los ingresos hospitalarios por una exacerbación de la EPOC, pero no disminuía los ingresos hospitalarios por todas las causas.[163]Long H, Howells K, Peters S, et al. Does health coaching improve health-related quality of life and reduce hospital admissions in people with chronic obstructive pulmonary disease? A systematic review and meta-analysis. Br J Health Psychol. 2019 Sep;24(3):515-46.
https://bpspsychub.onlinelibrary.wiley.com/doi/10.1111/bjhp.12366
http://www.ncbi.nlm.nih.gov/pubmed/31033121?tool=bestpractice.com
Los pacientes que utilizan terapias inhaladas deben recibir formación en la técnica de los dispositivos inhaladores. La mayoría de los pacientes cometen al menos un error en el uso de su inhalador y el uso incorrecto del mismo está asociado con un peor control de la enfermedad.[164]Cho-Reyes S, Celli BR, Dembek C, et al. Inhalation technique errors with metered-dose inhalers among patients with obstructive lung diseases: a systematic review and meta-analysis of US Studies. Chronic Obstr Pulm Dis. 2019 Jul 24;6(3):267-80.
https://journal.copdfoundation.org/jcopdf/id/1241/Inhalation-Technique-Errors-with-Metered-Dose-Inhalers-Among-Patients-with-Obstructive-Lung-Diseases-A-Systematic-Review-and-Meta-Analysis-of-US-Studies
http://www.ncbi.nlm.nih.gov/pubmed/31342732?tool=bestpractice.com
[165]Melani AS, Bonavia M, Cilenti V, et al. Inhaler mishandling remains common in real life and is associated with reduced disease control. Respir Med. 2011 Jun;105(6):930-8.
https://www.resmedjournal.com/article/S0954-6111(11)00009-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/21367593?tool=bestpractice.com
Es más probable que la técnica sea deficiente cuando los pacientes utilizan múltiples dispositivos o nunca han recibido formación en la técnica de inhalación.[166]Rootmensen GN, van Keimpema AR, Jansen HM, et al. Predictors of incorrect inhalation technique in patients with asthma or COPD: a study using a validated videotaped scoring method. J Aerosol Med Pulm Drug Deliv. 2010 Oct;23(5):323-8.
http://www.ncbi.nlm.nih.gov/pubmed/20804428?tool=bestpractice.com
La demostración del uso del inhalador por parte de un médico, la selección del dispositivo y la revisión de la técnica en citas posteriores pueden mejorar la técnica del inhalador.[167]Price D, Keininger DL, Viswanad B, et al. Factors associated with appropriate inhaler use in patients with COPD - lessons from the REAL survey. Int J Chron Obstruct Pulmon Dis. 2018 Feb 26;13:695-702. [Erratum in: Int J Chron Obstruct Pulmon Dis. 2018 Jul 25;13:2253-4.]
https://www.dovepress.com/factors-associated-with-appropriate-inhaler-use-in-patients-with-copd--peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/29520137?tool=bestpractice.com
La demostración mediante un dispositivo placebo puede ser muy eficaz para enseñar la técnica del inhalador a adultos de ≥65 años de edad.[168]Maricoto T, Monteiro L, Gama JMR, et al. Inhaler technique education and exacerbation risk in older adults with asthma or chronic obstructive pulmonary disease: a meta-analysis. J Am Geriatr Soc. 2019 Jan;67(1):57-66.
http://www.ncbi.nlm.nih.gov/pubmed/30291745?tool=bestpractice.com
Se debe pedir a los pacientes que lleven sus inhaladores al centro médico para facilitar la revisión del uso de los mismos.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Las intervenciones dirigidas por los farmacéuticos y el coaching sobre salud pueden mejorar la técnica de inhalación y el cumplimiento en los pacientes con EPOC.[169]Jia X, Zhou S, Luo D, et al. Effect of pharmacist-led interventions on medication adherence and inhalation technique in adult patients with asthma or COPD: a systematic review and meta-analysis. J Clin Pharm Ther. 2020 Oct;45(5):904-17.
https://onlinelibrary.wiley.com/doi/10.1111/jcpt.13126
http://www.ncbi.nlm.nih.gov/pubmed/32107837?tool=bestpractice.com
[170]Willard-Grace R, Chirinos C, Wolf J, et al. Lay health coaching to increase appropriate inhaler use in COPD: a randomized controlled trial. Ann Fam Med. 2020 Jan;18(1):5-14.
https://www.annfammed.org/content/18/1/5
http://www.ncbi.nlm.nih.gov/pubmed/31937527?tool=bestpractice.com
Se han registrado atributos del dispositivo inhalador, como el inicio rápido del alivio de los síntomas y el tamaño pequeño, en los estudios de preferencia del paciente.[171]Navaie M, Dembek C, Cho-Reyes S, et al. Inhaler device feature preferences among patients with obstructive lung diseases: a systematic review and meta-analysis. Medicine (Baltimore). 2020 Jun 19;99(25):e20718.
https://journals.lww.com/md-journal/fulltext/2020/06190/inhaler_device_feature_preferences_among_patients.56.aspx
http://www.ncbi.nlm.nih.gov/pubmed/32569208?tool=bestpractice.com
[172]Tervonen T, Hawken N, Hanania NA, et al. Maintenance inhaler therapy preferences of patients with asthma or chronic obstructive pulmonary disease: a discrete choice experiment. Thorax. 2020 Sep;75(9):735-43.
https://thorax.bmj.com/content/75/9/735
http://www.ncbi.nlm.nih.gov/pubmed/32631932?tool=bestpractice.com
Inhalador dosificadorUn farmacéutico principal muestra a un paciente cómo utilizar un inhalador de dosis medida y comenta formas de mejorar la técnica de inhalación.
Inhalador dosificador más espaciadorUn farmacéutico principal muestra a un paciente cómo utilizar un inhalador de dosis medida más un espaciador y discute formas de mejorar la técnica del inhalador.
Inhaladores de polvo secoUn farmacéutico principal muestra a un paciente cómo utilizar los dispositivos de polvo seco y discute formas de mejorar la técnica de los inhaladores.
Inhalador de niebla suaveUn farmacéutico principal muestra a un paciente cómo utilizar un inhalador de niebla suave y discute formas de mejorar la técnica de inhalación.
Se recomienda la realización de actividades físicas en todos los pacientes con enfermedad pulmonar obstructiva crónica (EPOC).[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Una revisión sistemática y un metanálisis de los ensayos controlados aleatorizados encontraron que el entrenamiento mediante ejercicios físicos por sí solo puede mejorar la actividad física en la EPOC y que se pueden lograr mayores mejorías agregando asesoramiento sobre la actividad física.[173]Lahham A, McDonald CF, Holland AE. Exercise training alone or with the addition of activity counseling improves physical activity levels in COPD: a systematic review and meta-analysis of randomized controlled trials. Int J Chron Obstruct Pulmon Dis. 2016 Dec 8;11:3121-36.
https://www.dovepress.com/exercise-training-alone-or-with-the-addition-of-activity-counseling-im-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/27994451?tool=bestpractice.com
Otra revisión sistemática y metanálisis encontró que una combinación de ejercicio aeróbico y entrenamiento de fuerza resultó más eficaz que el entrenamiento de fuerza o el entrenamiento de resistencia en solitario para aumentar la distancia de 6 minutos de recorrido.[174]Vooijs M, Siemonsma PC, Heus I, et al. Therapeutic validity and effectiveness of supervised physical exercise training on exercise capacity in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Clin Rehabil. 2016 Nov;30(11):1037-48.
http://www.ncbi.nlm.nih.gov/pubmed/26451006?tool=bestpractice.com
Otros estudios han demostrado mejoras en el consumo máximo de oxígeno, la fatiga percibida y la calidad de vida relacionada con la salud tras el cumplimiento de programas de ejercicio supervisados y no supervisados.[175]Ward TJC, Plumptre CD, Dolmage TE, et al. Change in VO2peak in response to aerobic exercise training and the relationship with exercise prescription in people with COPD: a systematic review and meta-analysis. Chest. 2020 Jul;158(1):131-44.
http://www.ncbi.nlm.nih.gov/pubmed/32173489?tool=bestpractice.com
[176]Paneroni M, Vitacca M, Venturelli M, et al. The impact of exercise training on fatigue in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Pulmonology. 2020 Sep - Oct;26(5):304-13.
http://www.ncbi.nlm.nih.gov/pubmed/32184070?tool=bestpractice.com
[177]Taylor D, Jenkins AR, Parrott K, et al. Efficacy of unsupervised exercise in adults with obstructive lung disease: a systematic review and meta-analysis. Thorax. 2021 Jun;76(6):591-600.
http://www.ncbi.nlm.nih.gov/pubmed/33685962?tool=bestpractice.com
Una revisión de la Cochrane encontró evidencias limitadas de una mejoría de la actividad física con el asesoramiento de la actividad física, el entrenamiento mediante ejercicio físico y el tratamiento farmacológico de la EPOC. Los autores comentaron que la evaluación de la calidad se había visto limitada por la falta de información sobre metodología y que la diversa gama de intervenciones se había evaluado principalmente en estudios únicos.[178]Burge AT, Cox NS, Abramson MJ, et al. Interventions for promoting physical activity in people with chronic obstructive pulmonary disease (COPD). Cochrane Database Syst Rev. 2020 Apr 16;(4):CD012626.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012626.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/32297320?tool=bestpractice.com
[  ]
Which interventions lead to increased regular physical activity for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3155/fullПоказать ответ El momento óptimo, los componentes, la duración y los modelos para mejorar la actividad física siguen sin estar claros. Los metanálisis sugieren que el yoga, el Qigong y otros ejercicios respiratorios caseros pueden mejorar la capacidad de ejercicio y la función pulmonar en pacientes con EPOC.[179]Cramer H, Haller H, Klose P, et al. The risks and benefits of yoga for patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Clin Rehabil. 2019 Dec;33(12):1847-62.
http://www.ncbi.nlm.nih.gov/pubmed/31353959?tool=bestpractice.com
[180]Tong H, Liu Y, Zhu Y, et al. The therapeutic effects of qigong in patients with chronic obstructive pulmonary disease in the stable stage: a meta-analysis. BMC Complement Altern Med. 2019 Sep 4;19(1):239.
https://bmccomplementmedtherapies.biomedcentral.com/articles/10.1186/s12906-019-2639-9
http://www.ncbi.nlm.nih.gov/pubmed/31484521?tool=bestpractice.com
[181]Lu Y, Li P, Li N, et al. Effects of home-based breathing exercises in subjects with COPD. Respir Care. 2020 Mar;65(3):377-87.
https://rc.rcjournal.com/content/65/3/377
http://www.ncbi.nlm.nih.gov/pubmed/31719191?tool=bestpractice.com
Se ha demostrado que la práctica del Tai Chi mejora la capacidad de ejercicio en comparación con la atención habitual.[182]Liu X, Fu C, Hu W, et al. The effect of Tai Chi on the pulmonary rehabilitation of chronic obstructive pulmonary disease: a systematic review and meta-analysis. Ann Palliat Med. 2021 Apr;10(4):3763-82.
https://apm.amegroups.org/article/view/67333/html
http://www.ncbi.nlm.nih.gov/pubmed/33894710?tool=bestpractice.com
]
Which interventions lead to increased regular physical activity for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3155/fullПоказать ответ El momento óptimo, los componentes, la duración y los modelos para mejorar la actividad física siguen sin estar claros. Los metanálisis sugieren que el yoga, el Qigong y otros ejercicios respiratorios caseros pueden mejorar la capacidad de ejercicio y la función pulmonar en pacientes con EPOC.[179]Cramer H, Haller H, Klose P, et al. The risks and benefits of yoga for patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Clin Rehabil. 2019 Dec;33(12):1847-62.
http://www.ncbi.nlm.nih.gov/pubmed/31353959?tool=bestpractice.com
[180]Tong H, Liu Y, Zhu Y, et al. The therapeutic effects of qigong in patients with chronic obstructive pulmonary disease in the stable stage: a meta-analysis. BMC Complement Altern Med. 2019 Sep 4;19(1):239.
https://bmccomplementmedtherapies.biomedcentral.com/articles/10.1186/s12906-019-2639-9
http://www.ncbi.nlm.nih.gov/pubmed/31484521?tool=bestpractice.com
[181]Lu Y, Li P, Li N, et al. Effects of home-based breathing exercises in subjects with COPD. Respir Care. 2020 Mar;65(3):377-87.
https://rc.rcjournal.com/content/65/3/377
http://www.ncbi.nlm.nih.gov/pubmed/31719191?tool=bestpractice.com
Se ha demostrado que la práctica del Tai Chi mejora la capacidad de ejercicio en comparación con la atención habitual.[182]Liu X, Fu C, Hu W, et al. The effect of Tai Chi on the pulmonary rehabilitation of chronic obstructive pulmonary disease: a systematic review and meta-analysis. Ann Palliat Med. 2021 Apr;10(4):3763-82.
https://apm.amegroups.org/article/view/67333/html
http://www.ncbi.nlm.nih.gov/pubmed/33894710?tool=bestpractice.com
Se ha comprobado que el asesoramiento dietético y los suplementos orales mejoran el peso corporal, la calidad de vida, la fuerza muscular respiratoria y la distancia de 6 minutos de marcha.[183]Collins PF, Elia M, Stratton RJ. Nutritional support and functional capacity in chronic obstructive pulmonary disease: a systematic review and meta-analysis. Respirology. 2013 May;18(4):616-29.
https://onlinelibrary.wiley.com/doi/10.1111/resp.12070
http://www.ncbi.nlm.nih.gov/pubmed/23432923?tool=bestpractice.com
[184]Ferreira IM, Brooks D, White J, et al. Nutritional supplementation for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2012 Dec 12;(12):CD000998.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD000998.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/23235577?tool=bestpractice.com
Sin embargo, no se ha encontrado de forma consistente que el apoyo nutricional mejore la función pulmonar.[184]Ferreira IM, Brooks D, White J, et al. Nutritional supplementation for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2012 Dec 12;(12):CD000998.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD000998.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/23235577?tool=bestpractice.com
Abandono del hábito de fumar
Se debe alentar a todos los pacientes a que abandonen el hábito de fumar, además de ofrecerles orientación sobre cómo evitar la exposición al humo del tabaco en el trabajo o en el medio ambiente y a otros agentes irritantes.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].
https://www.nice.org.uk/guidance/ng115
El abandono del hábito de fumar reduce considerablemente la tasa de avance de la enfermedad pulmonar obstructiva crónica (EPOC) y el riesgo de que aparezcan neoplasias malignas. También reduce el riesgo de enfermedades coronarias y cerebrovasculares. De entre las diferentes modalidades terapéuticas de la EPOC, los únicos dos factores que mejoran la supervivencia son el abandono del hábito de fumar y la oxigenoterapia.
Los programas habituales de abandono del hábito de fumar incluyen asesoramiento, reuniones grupales y tratamiento farmacológico.[185]Gonzales D, Rennard SI, Nides M, et al; Varenicline Phase 3 Study Group. Varenicline, an alpha4beta2 nicotinic acetylcholine receptor partial agonist, vs sustained-release bupropion and placebo for smoking cessation: a randomized controlled trial. JAMA. 2006 Jul 5;296(1):47-55.
https://jamanetwork.com/journals/jama/fullarticle/211000
http://www.ncbi.nlm.nih.gov/pubmed/16820546?tool=bestpractice.com
Algunos pacientes pueden necesitar derivaciones frecuentes para alcanzar el éxito. El abandono del hábito de fumar, que incluye farmacoterapia y asesoramiento intensivo, tiene una mayor tasa de éxito y es coste-eficiente en EPOC, con bajos costes por año de vida ajustada por calidad.[186]Hoogendoorn M, Feenstra TL, Hoogenveen RT, et al. Long-term effectiveness and cost-effectiveness of smoking cessation interventions in patients with COPD. Thorax. 2010 Aug;65(8):711-8.
http://www.ncbi.nlm.nih.gov/pubmed/20685746?tool=bestpractice.com
[187]Warnier MJ, van Riet EE, Rutten FH, et al. Smoking cessation strategies in patients with COPD. Eur Respir J. 2013 Mar;41(3):727-34.
http://www.ncbi.nlm.nih.gov/pubmed/22936706?tool=bestpractice.com
[188]van Eerd EA, van der Meer RM, van Schayck OC, et al. Smoking cessation for people with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2016 Aug 20;(8):CD010744.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010744.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/27545342?tool=bestpractice.com
El uso de sistemas electrónicos de administración de nicotina (SEAN), incluidos los cigarrillos electrónicos y los productos de vapeo, como ayudas para dejar de fumar es controvertido. La evidencia de los estudios observacionales no apoya actualmente el uso de los SEAN como ayuda para al abandono del hábito de fumar en personas con EPOC.[189]Bowler RP, Hansel NN, Jacobson S, et al; for COPDGene and SPIROMICS Investigators. Electronic cigarette use in US adults at risk for or with COPD: analysis from two observational cohorts. J Gen Intern Med. 2017 Dec;32(12):1315-22.
https://link.springer.com/article/10.1007/s11606-017-4150-7
http://www.ncbi.nlm.nih.gov/pubmed/28884423?tool=bestpractice.com
Consulte el apartado Abandono del hábito de fumar (Enfoque de tratamiento).
Mucolíticos
Los pacientes con fenotipo de bronquitis crónica de la enfermedad pulmonar obstructiva crónica (EPOC) a menudo producen esputo espeso. Los fármacos mucolíticos (erdosteína, carbocisteína y acetilcisteína) no se asocian con un aumento de los efectos adversos y pueden ser beneficiosos durante las exacerbaciones de la EPOC.
[  ]
For people with chronic bronchitis or chronic obstructive pulmonary disease, how do mucolytic agents compare with placebo?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2591/fullПоказать ответ Producen una pequeña reducción de la frecuencia de las exacerbaciones agudas y de los días de incapacidad por mes, pero no mejoran la función pulmonar ni la calidad de vida.[190]Poole P, Sathananthan K, Fortescue R. Mucolytic agents versus placebo for chronic bronchitis or chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 May 20;(5):CD001287.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001287.pub6/full
http://www.ncbi.nlm.nih.gov/pubmed/31107966?tool=bestpractice.com
[191]Rogliani P, Matera MG, Page C, et al. Efficacy and safety profile of mucolytic/antioxidant agents in chronic obstructive pulmonary disease: a comparative analysis across erdosteine, carbocysteine, and N-acetylcysteine. Respir Res. 2019 May 27;20(1):104.
https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1078-y
http://www.ncbi.nlm.nih.gov/pubmed/31133026?tool=bestpractice.com
[192]Wei J, Pang CS, Han J, et al. Effect of orally administered N-acetylcysteine on chronic bronchitis: a meta-analysis. Adv Ther. 2019 Dec;36(12):3356-67.
http://www.ncbi.nlm.nih.gov/pubmed/31598901?tool=bestpractice.com
La erdosteina y la carbocisteína no están disponibles en los Estados Unidos. El tratamiento con fármacos mucolíticos como la carbocisteína y la acetilcisteína puede reducir las exacerbaciones y mejorar modestamente el estado de salud de los pacientes que no reciben CSI.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Sin embargo, la erdosteína puede tener un efecto significativo en las exacerbaciones leves, tanto si el paciente está tomando CSI, como si no.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
]
For people with chronic bronchitis or chronic obstructive pulmonary disease, how do mucolytic agents compare with placebo?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2591/fullПоказать ответ Producen una pequeña reducción de la frecuencia de las exacerbaciones agudas y de los días de incapacidad por mes, pero no mejoran la función pulmonar ni la calidad de vida.[190]Poole P, Sathananthan K, Fortescue R. Mucolytic agents versus placebo for chronic bronchitis or chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 May 20;(5):CD001287.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001287.pub6/full
http://www.ncbi.nlm.nih.gov/pubmed/31107966?tool=bestpractice.com
[191]Rogliani P, Matera MG, Page C, et al. Efficacy and safety profile of mucolytic/antioxidant agents in chronic obstructive pulmonary disease: a comparative analysis across erdosteine, carbocysteine, and N-acetylcysteine. Respir Res. 2019 May 27;20(1):104.
https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1078-y
http://www.ncbi.nlm.nih.gov/pubmed/31133026?tool=bestpractice.com
[192]Wei J, Pang CS, Han J, et al. Effect of orally administered N-acetylcysteine on chronic bronchitis: a meta-analysis. Adv Ther. 2019 Dec;36(12):3356-67.
http://www.ncbi.nlm.nih.gov/pubmed/31598901?tool=bestpractice.com
La erdosteina y la carbocisteína no están disponibles en los Estados Unidos. El tratamiento con fármacos mucolíticos como la carbocisteína y la acetilcisteína puede reducir las exacerbaciones y mejorar modestamente el estado de salud de los pacientes que no reciben CSI.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Sin embargo, la erdosteína puede tener un efecto significativo en las exacerbaciones leves, tanto si el paciente está tomando CSI, como si no.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Rehabilitación pulmonar
La rehabilitación pulmonar compromete el ejercicio aeróbico, el entrenamiento de fuerza y la educación. Debe iniciarse para los pacientes que siguen siendo sintomáticos a pesar del tratamiento broncodilatador y se recomienda comenzar temprano en el curso de la enfermedad, cuando empiecen a sufrir disnea con una actividad habitual y caminando sobre una superficie plana.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[193]Rochester CL, Alison JA, Carlin B, et al. Pulmonary rehabilitation for adults with chronic respiratory disease: an official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2023 Aug 15;208(4):e7-26.
https://www.atsjournals.org/doi/10.1164/rccm.202306-1066ST
http://www.ncbi.nlm.nih.gov/pubmed/37581410?tool=bestpractice.com
[194]Man W, Chaplin E, Daynes E, et al. British Thoracic Society Clinical Statement on pulmonary rehabilitation. Thorax. 2023 Oct;78(suppl 5):s2-15.
https://thorax.bmj.com/content/78/Suppl_5/s2
http://www.ncbi.nlm.nih.gov/pubmed/37770084?tool=bestpractice.com
Las guías de práctica clínica de la GOLD recomiendan la rehabilitación pulmonar para los pacientes con alta carga sintomática y riesgo de exacerbación (es decir, los grupos B y E).[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
La rehabilitación pulmonar alivia la disnea y la fatiga, mejora la función emocional y aumenta la sensación de control en un grado moderadamente grande y clínicamente significativo.[195]McCarthy B, Casey D, Devane D, et al. Pulmonary rehabilitation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2015 Feb 23;(2):CD003793.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD003793.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/25705944?tool=bestpractice.com
La rehabilitación pulmonar extensiva después de un ingreso hospitalario con una exacerbación aguda de la EPOC disminuye el riesgo de reingreso, mejora la calidad de vida relacionada con la salud y reduce la mortalidad.
[  ]
What are the effects of pulmonary rehabilitation after exacerbation in people with chronic obstructive pulmonary disease?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1650/fullПоказать ответ Hay evidencia que apoya el inicio de la rehabilitación pulmonar dentro de 1 mes después de la aparición de una exacerbación aguda.[196]Marciniuk DD, Brooks D, Butcher S, et al. Canadian Thoracic Society COPD Committee Expert Working Group. Optimizing pulmonary rehabilitation in chronic obstructive pulmonary disease - practical issues: a Canadian Thoracic Society Clinical Practice Guideline. Can Respir J. 2010 Jul-Aug;17(4):159-68.
http://www.ncbi.nlm.nih.gov/pubmed/20808973?tool=bestpractice.com
[197]Puhan MA, Gimeno-Santos E, Cates CJ, et al. Pulmonary rehabilitation following exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2016 Dec 8;(12):CD005305.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD005305.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/27930803?tool=bestpractice.com
]
What are the effects of pulmonary rehabilitation after exacerbation in people with chronic obstructive pulmonary disease?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1650/fullПоказать ответ Hay evidencia que apoya el inicio de la rehabilitación pulmonar dentro de 1 mes después de la aparición de una exacerbación aguda.[196]Marciniuk DD, Brooks D, Butcher S, et al. Canadian Thoracic Society COPD Committee Expert Working Group. Optimizing pulmonary rehabilitation in chronic obstructive pulmonary disease - practical issues: a Canadian Thoracic Society Clinical Practice Guideline. Can Respir J. 2010 Jul-Aug;17(4):159-68.
http://www.ncbi.nlm.nih.gov/pubmed/20808973?tool=bestpractice.com
[197]Puhan MA, Gimeno-Santos E, Cates CJ, et al. Pulmonary rehabilitation following exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2016 Dec 8;(12):CD005305.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD005305.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/27930803?tool=bestpractice.com
Un gran estudio de cohortes de EE. UU. halló que el inicio de la rehabilitación pulmonar dentro de los 90 días posteriores al alta hospitalaria se asoció significativamente con un menor riesgo de mortalidad a 1 año y menos rehospitalizaciones a 1 año.[198]Lindenauer PK, Stefan MS, Pekow PS, et al. Association between initiation of pulmonary rehabilitation after hospitalization for COPD and 1-year survival among medicare beneficiaries. JAMA. 2020 May 12;323(18):1813-23.
https://jamanetwork.com/journals/jama/fullarticle/2765730
http://www.ncbi.nlm.nih.gov/pubmed/32396181?tool=bestpractice.com
[199]Stefan MS, Pekow PS, Priya A, et al. Association between initiation of pulmonary rehabilitation and rehospitalizations in patients hospitalized with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2021 Nov 1;204(9):1015-23.
https://www.atsjournals.org/doi/10.1164/rccm.202012-4389OC
http://www.ncbi.nlm.nih.gov/pubmed/34283694?tool=bestpractice.com
Menos del 2% de la cohorte de pacientes inició rehabilitación dentro de este periodo de tiempo, lo que evidencia la necesidad de desarrollar estrategias más eficaces para fomentar la participación del paciente.[198]Lindenauer PK, Stefan MS, Pekow PS, et al. Association between initiation of pulmonary rehabilitation after hospitalization for COPD and 1-year survival among medicare beneficiaries. JAMA. 2020 May 12;323(18):1813-23.
https://jamanetwork.com/journals/jama/fullarticle/2765730
http://www.ncbi.nlm.nih.gov/pubmed/32396181?tool=bestpractice.com
Sin embargo, iniciar la rehabilitación pulmonar antes del alta hospitalaria podría asociarse con una mortalidad más alta a los 12 meses, por lo que no se recomienda.[200]Greening NJ, Williams JE, Hussain SF, et al. An early rehabilitation intervention to enhance recovery during hospital admission for an exacerbation of chronic respiratory disease: randomised controlled trial. BMJ. 2014 Jul 8;349:g4315.
https://www.bmj.com/content/349/bmj.g4315
http://www.ncbi.nlm.nih.gov/pubmed/25004917?tool=bestpractice.com
La rehabilitación pulmonar también disminuye la depresión y la ansiedad relacionadas con la EPOC, y reduce la hospitalización.[201]Casaburi R, ZuWallack R. Pulmonary rehabilitation for management of chronic obstructive pulmonary disease. N Engl J Med. 2009 Mar 26;360(13):1329-35.
http://www.ncbi.nlm.nih.gov/pubmed/19321869?tool=bestpractice.com
El beneficio de la rehabilitación pulmonar parece disminuir tras la finalización del curso, a menos que los pacientes sigan un programa de ejercicios en casa.[202]Guell R, Casan P, Belda J, et al. Long-term effects of outpatient rehabilitation of COPD: a randomized trial. Chest. 2000 Apr;117(4):976-83.
http://www.ncbi.nlm.nih.gov/pubmed/10767227?tool=bestpractice.com
La rehabilitación pulmonar de mantenimiento, definida como el ejercicio supervisado continuado con una frecuencia inferior a la del programa de rehabilitación original, puede tener un papel en la conservación de los beneficios de la rehabilitación pulmonar a lo largo del tiempo. Los hallazgos de una revisión de la Cochrane indican que los programas de mantenimiento supervisado pueden mejorar la calidad de vida relacionada con la salud y la capacidad de ejercicio a los 6-12 meses en comparación con la atención habitual.[203]Malaguti C, Dal Corso S, Janjua S, et al. Supervised maintenance programmes following pulmonary rehabilitation compared to usual care for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2021 Aug 17;(8):CD013569.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013569.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/34404111?tool=bestpractice.com
[  ]
For people with chronic obstructive pulmonary disease (COPD), what are the effects of a supervised maintenance program after pulmonary rehabilitation?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4228/fullПоказать ответ
]
For people with chronic obstructive pulmonary disease (COPD), what are the effects of a supervised maintenance program after pulmonary rehabilitation?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4228/fullПоказать ответ
Los beneficios de la rehabilitación pulmonar de los síntomas respiratorios y la calidad de vida en los pacientes con la EPOC en casa, o bien basados en la comunidad, pueden coincidir con los de los programas de rehabilitación hospitalarios.[204]Maltais F, Bourbeau J, Shapiro S, et al. Effects of home-based pulmonary rehabilitation in patients with chronic obstructive pulmonary disease: a randomized trial. Ann Intern Med. 2008 Dec 16;149(12):869-78.
http://www.ncbi.nlm.nih.gov/pubmed/19075206?tool=bestpractice.com
[205]Neves LF, Reis MH, Gonçalves TR. Home or community-based pulmonary rehabilitation for individuals with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Cad Saude Publica. 2016 Jun 20;32(6):S0102-311X2016000602001.
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0102-311X2016000602001&lng=en&nrm=iso&tlng=en
http://www.ncbi.nlm.nih.gov/pubmed/27333130?tool=bestpractice.com
[206]Holland AE, Mahal A, Hill CJ, et al. Home-based rehabilitation for COPD using minimal resources: a randomised, controlled equivalence trial. Thorax. 2017 Jan;72(1):57-65.
https://thorax.bmj.com/content/72/1/57
http://www.ncbi.nlm.nih.gov/pubmed/27672116?tool=bestpractice.com
Una revisión de la Cochrane concluyó que tanto la telerehabilitación primaria como la de mantenimiento lograron resultados similares a los de la rehabilitación presencial, sin problemas de seguridad. Las limitaciones de la revisión incluyen el pequeño número de pacientes y la heterogeneidad de los modelos de telerehabilitación.[207]Cox NS, Dal Corso S, Hansen H, et al. Telerehabilitation for chronic respiratory disease. Cochrane Database Syst Rev. 2021 Jan 29;(1):CD013040.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013040.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/33511633?tool=bestpractice.com
Oxigenoterapia y soporte ventilatorio
Las guías de práctica clínica de la GOLD recomiendan la oxigenoterapia a largo plazo en pacientes estables que tienen:[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
PaO₂ ≤7.3 kPa (55 mmHg) o SaO₂≤88%, con o sin hipercapnia confirmada dos veces en un período de 3 semanas; o bien
PaO₂ entre 7.3 kPa (55 mmHg) y 8.0 kPa (60 mmHg), o SaO₂ del 88%, si hay evidencia de hipertensión pulmonar, edema periférico que sugiera insuficiencia cardíaca congestiva o policitemia (hematocrito > 55%).
Las guías de práctica clínica de la American Thoracic Society (ATS) recomiendan prescribir una oxigenoterapia a largo plazo durante al menos 15 horas al día en adultos con EPOC que presentan en una grave hipoxemia en reposo en el aire ambiente. El ATS define la hipoxemia grave como cualquiera de estas dos:[208]Jacobs SS, Krishnan JA, Lederer DJ, et al. Home oxygen therapy for adults with chronic lung disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 Nov 15;202(10):e121-41. [Erratum in: Am J Respir Crit Care Med. 2021 Apr 15;203(8):1045-6.]
https://www.atsjournals.org/doi/10.1164/rccm.202009-3608ST
http://www.ncbi.nlm.nih.gov/pubmed/33185464?tool=bestpractice.com
PaO₂ ≤7.3 kPa (55 mmHg) o la saturación de oxígeno medida por oximetría de pulso (SpO₂) ≤88%; o
PaO₂ 7.5-7.9 kPa (56-59 mmHg) o SpO₂ del 89% más uno de los siguientes: edema, hematocrito ≥55%, o P pulmonale en un ECG.
En el caso de los pacientes a los que se les prescribe oxigenoterapia en casa, el ATS recomienda que el paciente y sus cuidadores reciban instrucción y formación sobre el uso y mantenimiento de todos los equipos de oxígeno y formación sobre la seguridad del oxígeno, incluyendo el abandono del hábito de fumar, la prevención de incendios y los peligros de tropiezos.[208]Jacobs SS, Krishnan JA, Lederer DJ, et al. Home oxygen therapy for adults with chronic lung disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 Nov 15;202(10):e121-41. [Erratum in: Am J Respir Crit Care Med. 2021 Apr 15;203(8):1045-6.]
https://www.atsjournals.org/doi/10.1164/rccm.202009-3608ST
http://www.ncbi.nlm.nih.gov/pubmed/33185464?tool=bestpractice.com
La oxigenoterapia debe ajustarse para mantener una SaO₂ ≥90%.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
El paciente debe ser reevaluado después de 60-90 días para determinar si el oxígeno sigue estando indicado y es terapéutico.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
De entre las diferentes modalidades terapéuticas de la EPOC, los únicos dos factores que mejoran la supervivencia son el abandono del hábito de fumar y la oxigenoterapia.
La oxigenoterapia permite minimizar la hipertensión pulmonar al disminuir la presión de la arteria pulmonar, y mejora la tolerancia al ejercicio y la calidad de vida. Se ha demostrado que mejora la supervivencia.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[66]Qaseem A, Wilt TJ, Weinberger SE, et al. Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practice guideline update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society. Ann Intern Med. 2011 Aug 2;155(3):179-91.
https://www.acpjournals.org/doi/10.7326/0003-4819-155-3-201108020-00008
http://www.ncbi.nlm.nih.gov/pubmed/21810710?tool=bestpractice.com
Existen algunas pruebas de que el oxígeno puede aliviar la dificultad para respirar cuando se administra durante el ejercicio a las personas con la EPOC con hipoxemia leve y a las personas sin hipoxemia que no reúnen los requisitos para la oxigenoterapia a domicilio.[209]Ekström M, Ahmadi Z, Bornefalk-Hermansson A, et al. Oxygen for breathlessness in patients with chronic obstructive pulmonary disease who do not qualify for home oxygen therapy. Cochrane Database Syst Rev. 2016 Nov 25;(11):CD006429.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD006429.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27886372?tool=bestpractice.com
El ATS sugiere prescribir oxígeno ambulatorio (oxígeno suministrado durante el ejercicio o las actividades de la vida diaria) en adultos con EPOC que presentan una grave hipoxemia con esfuerzos en el aire ambiente.[208]Jacobs SS, Krishnan JA, Lederer DJ, et al. Home oxygen therapy for adults with chronic lung disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 Nov 15;202(10):e121-41. [Erratum in: Am J Respir Crit Care Med. 2021 Apr 15;203(8):1045-6.]
https://www.atsjournals.org/doi/10.1164/rccm.202009-3608ST
http://www.ncbi.nlm.nih.gov/pubmed/33185464?tool=bestpractice.com
Sin embargo, el ATS sugiere no prescribir la oxigenoterapia a largo plazo en adultos con EPOC que presentan hipoxemia crónica en reposo en aire ambiente (SpO₂ de 89%-93%).[208]Jacobs SS, Krishnan JA, Lederer DJ, et al. Home oxygen therapy for adults with chronic lung disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 Nov 15;202(10):e121-41. [Erratum in: Am J Respir Crit Care Med. 2021 Apr 15;203(8):1045-6.]
https://www.atsjournals.org/doi/10.1164/rccm.202009-3608ST
http://www.ncbi.nlm.nih.gov/pubmed/33185464?tool=bestpractice.com
Los viajes en avión son seguros para la mayoría de los pacientes que reciben oxigenoterapia a largo plazo, aunque los pacientes deben ser capaces de tolerar períodos cortos sin oxígeno, ya que es probable que haya momentos en los que no esté disponible.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[210]British Thoracic Society. Air travel. Mar 2022 [internet publication].
https://www.brit-thoracic.org.uk/quality-improvement/clinical-statements/air-travel
Los pacientes con SaO₂ >95% al nivel del mar y SaO₂ ≥84% después de una prueba de caminata de 6 minutos pueden viajar en avión sin necesidad de una evaluación adicional.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[210]British Thoracic Society. Air travel. Mar 2022 [internet publication].
https://www.brit-thoracic.org.uk/quality-improvement/clinical-statements/air-travel
[211]Edvardsen A, Akerø A, Christensen CC, et al. Air travel and chronic obstructive pulmonary disease: a new algorithm for pre-flight evaluation. Thorax. 2012 Nov;67(11):964-9.
https://thorax.bmj.com/content/67/11/964
http://www.ncbi.nlm.nih.gov/pubmed/22767877?tool=bestpractice.com
Se recomienda oxigenoterapia para pacientes con SaO₂ entre el 92% y el 95% a nivel del mar y SaO₂ <84% después de una prueba de caminata de 6 minutos, y para pacientes con SaO₂ <92% a nivel del mar.[211]Edvardsen A, Akerø A, Christensen CC, et al. Air travel and chronic obstructive pulmonary disease: a new algorithm for pre-flight evaluation. Thorax. 2012 Nov;67(11):964-9.
https://thorax.bmj.com/content/67/11/964
http://www.ncbi.nlm.nih.gov/pubmed/22767877?tool=bestpractice.com
La prueba de simulación de hipoxia-altitud (también conocida como prueba de provocación hipóxica) debe realizarse para otros pacientes.[210]British Thoracic Society. Air travel. Mar 2022 [internet publication].
https://www.brit-thoracic.org.uk/quality-improvement/clinical-statements/air-travel
[211]Edvardsen A, Akerø A, Christensen CC, et al. Air travel and chronic obstructive pulmonary disease: a new algorithm for pre-flight evaluation. Thorax. 2012 Nov;67(11):964-9.
https://thorax.bmj.com/content/67/11/964
http://www.ncbi.nlm.nih.gov/pubmed/22767877?tool=bestpractice.com
Para los pacientes que reciben una oxigenoterapia a largo plazo, la British Thoracic Society recomienda que se considere la posibilidad de utilizar oxígeno en vuelo a 2L/minuto más que la prescripción habitual del paciente.[210]British Thoracic Society. Air travel. Mar 2022 [internet publication].
https://www.brit-thoracic.org.uk/quality-improvement/clinical-statements/air-travel
Para los pacientes que presentan EPOC y apnea obstructiva del sueño, la asistencia ventilatoria con presión positiva continua en las vías respiratorias (CPAP) puede mejorar la supervivencia y reducir los ingresos hospitalarios.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[73]Marin JM, Soriano JB, Carrizo SJ, et al. Outcomes in patients with chronic obstructive pulmonary disease and obstructive sleep apnea: the overlap syndrome. Am J Respir Crit Care Med. 2010 Aug 1;182(3):325-31.
https://www.atsjournals.org/doi/10.1164/rccm.200912-1869OC
http://www.ncbi.nlm.nih.gov/pubmed/20378728?tool=bestpractice.com
La ventilación no invasiva (VNI) se utiliza ocasionalmente en pacientes con EPOC muy grave pero estable, aunque no está claro el momento óptimo para iniciarla ni los mejores criterios de selección de los candidatos.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[212]Wilson ME, Dobler CC, Morrow AS, et al. Association of home noninvasive positive pressure ventilation with clinical outcomes in chronic obstructive pulmonary disease: a systematic review and meta-analysis. JAMA. 2020 Feb 4;323(5):455-65.
https://jamanetwork.com/journals/jama/fullarticle/2760390
http://www.ncbi.nlm.nih.gov/pubmed/32016309?tool=bestpractice.com
[213]Raveling T, Vonk J, Struik FM, et al. Chronic non-invasive ventilation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2021 Aug 9;(8):CD002878.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002878.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/34368950?tool=bestpractice.com
Una revisión de la Cochrane halló que la VNI crónica administrada a través de una máscara facial mejoró la supervivencia y confirió un beneficio de calidad de vida relacionada con la salud a corto plazo en la EPOC estable. La VNI crónica también mejoró la duración de la supervivencia sin ingreso hospitalario en pacientes con hipercapnia persistente después de una exacerbación.[213]Raveling T, Vonk J, Struik FM, et al. Chronic non-invasive ventilation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2021 Aug 9;(8):CD002878.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002878.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/34368950?tool=bestpractice.com
Otro estudio reportó una disminución significativa de la frecuencia de las exacerbaciones con la VNI frente al tratamiento de control, aunque no se observaron mejoras en la mortalidad, la PaO₂, la PaCO₂ o el pH.[214]He X, Luo L, Ma Y, et al. Efficacy of domiciliary noninvasive ventilation on clinical outcomes in posthospital chronic obstructive pulmonary disease patients: a meta-analysis of randomized controlled trials. Ann Palliat Med. 2021 May;10(5):5137-45.
http://www.ncbi.nlm.nih.gov/pubmed/33977751?tool=bestpractice.com
Las guías de práctica clínica de la ATS sugieren el uso de la VNI nocturna además de los cuidados habituales para los pacientes con EPOC crónica estable e hipercápnica.[215]Macrea M, Oczkowski S, Rochwerg B, et al. Long-term noninvasive ventilation in chronic stable hypercapnic chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice fuideline. Am J Respir Crit Care Med. 2020 Aug 15;202(4):e74-87.
https://www.atsjournals.org/doi/10.1164/rccm.202006-2382ST
http://www.ncbi.nlm.nih.gov/pubmed/32795139?tool=bestpractice.com
La European Respiratory Society y la Canadian Thoracic Society han emitido orientaciones similares.[216]Ergan B, Oczkowski S, Rochwerg B, et al. European Respiratory Society guidelines on long-term home non-invasive ventilation for management of COPD. Eur Respir J. 2019 Sep 28;54(3):1901003.
https://erj.ersjournals.com/content/54/3/1901003
http://www.ncbi.nlm.nih.gov/pubmed/31467119?tool=bestpractice.com
[217]Kaminska M, Rimmer KP, McKim DA, et al. Long-term non-invasive ventilation in patients with chronic obstructive pulmonary disease (COPD): 2021 Canadian Thoracic Society clinical practice guideline update. Can J Respir Crit Care Sleep Med. 2021 May 7;5(3):160-83.
https://www.tandfonline.com/doi/full/10.1080/24745332.2021.1911218
Cirugía
Las intervenciones quirúrgicas son el último paso en el tratamiento de la EPOC, e incluyen la bullectomía, la cirugía de reducción del volumen pulmonar y el trasplante de pulmón.[218]van Agteren JE, Hnin K, Grosser D, et al. Bronchoscopic lung volume reduction procedures for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017 Feb 23;(2):CD012158.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012158.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/28230230?tool=bestpractice.com
[219]van Agteren JE, Carson KV, Tiong LU, et al. Lung volume reduction surgery for diffuse emphysema. Cochrane Database Syst Rev. 2016 Oct 14;(10):CD001001.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001001.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27739074?tool=bestpractice.com
[  ]
How does bronchoscopic lung volume reduction compare with medical therapy in people with chronic obstructive pulmonary disease?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1680/fullShow me the answer Se utilizan para mejorar la dinámica pulmonar, el cumplimiento del régimen de ejercicio y la calidad de vida.[219]van Agteren JE, Carson KV, Tiong LU, et al. Lung volume reduction surgery for diffuse emphysema. Cochrane Database Syst Rev. 2016 Oct 14;(10):CD001001.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001001.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27739074?tool=bestpractice.com
La cirugía de reducción del volumen pulmonar se indica en pacientes con limitación del flujo aéreo muy grave y especialmente en los pacientes que presentan enfermedad del lóbulo superior localizada y una capacidad para hacer ejercicio menor de lo normal.[218]van Agteren JE, Hnin K, Grosser D, et al. Bronchoscopic lung volume reduction procedures for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017 Feb 23;(2):CD012158.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012158.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/28230230?tool=bestpractice.com
[
]
How does bronchoscopic lung volume reduction compare with medical therapy in people with chronic obstructive pulmonary disease?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1680/fullShow me the answer Se utilizan para mejorar la dinámica pulmonar, el cumplimiento del régimen de ejercicio y la calidad de vida.[219]van Agteren JE, Carson KV, Tiong LU, et al. Lung volume reduction surgery for diffuse emphysema. Cochrane Database Syst Rev. 2016 Oct 14;(10):CD001001.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001001.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27739074?tool=bestpractice.com
La cirugía de reducción del volumen pulmonar se indica en pacientes con limitación del flujo aéreo muy grave y especialmente en los pacientes que presentan enfermedad del lóbulo superior localizada y una capacidad para hacer ejercicio menor de lo normal.[218]van Agteren JE, Hnin K, Grosser D, et al. Bronchoscopic lung volume reduction procedures for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017 Feb 23;(2):CD012158.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012158.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/28230230?tool=bestpractice.com
[  ]
How does bronchoscopic lung volume reduction compare with medical therapy in people with chronic obstructive pulmonary disease?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1680/fullShow me the answer Un metanálisis encontró un mayor riesgo de mortalidad temprana en los pacientes sometidos a cirugía de reducción del volumen pulmonar, en comparación con la atención estándar; sin embargo, no se observaron diferencias significativas en la mortalidad general.[220]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.
http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com
La bullectomía es una opción para los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) que presentan disnea, en quienes la tomografía computarizada (TC) revela una gran cantidad de bullas que ocupan al menos el 30% del hemitórax. Un estado funcional gravemente malo y una disminución grave del VEF₁ (<500 mL) hacen que estas opciones sean menos favorables. La inserción de la válvula endobronquial puede producir mejorías clínicamente significativas en pacientes adecuadamente seleccionados con EPOC.[220]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.
http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com
[221]Klooster K, Slebos DJ, Zoumot Z, et al. Endobronchial valves for emphysema: an individual patient-level reanalysis of randomised controlled trials. BMJ Open Respir Res. 2017 Nov 2;4(1):e000214.
https://bmjopenrespres.bmj.com/content/4/1/e000214
http://www.ncbi.nlm.nih.gov/pubmed/29441206?tool=bestpractice.com
[222]Labarca G, Uribe JP, Pacheco C, et al. Bronchoscopic lung volume reduction with endobronchial zephyr valves for severe emphysema: a systematic review and meta-analysis. Respiration. 2019 May 22;98(3):268-78.
http://www.ncbi.nlm.nih.gov/pubmed/31117102?tool=bestpractice.com
El procedimiento puede ser más beneficioso en los pacientes cuya disnea se debe principalmente al tórax distendido y al atrapamiento de aire en los espacios aéreos distales a los bronquiolos terminales, que se manifiesta como enfisema con un volumen residual notablemente aumentado. Las contraindicaciones son la infección pulmonar activa y las fisuras lobares incompletas (<80%).[223]Abia-Trujillo D, Johnson MM, Patel NM, et al. Bronchoscopic lung volume reduction: a new hope for patients with severe emphysema and air trapping. Mayo Clin Proc. 2021 Feb;96(2):464-72.
http://www.ncbi.nlm.nih.gov/pubmed/32829903?tool=bestpractice.com
Los eventos adversos más frecuentes asociados con la inserción de la válvula endobronquial son neumotórax y exacerbación.[220]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.
http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com
]
How does bronchoscopic lung volume reduction compare with medical therapy in people with chronic obstructive pulmonary disease?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1680/fullShow me the answer Un metanálisis encontró un mayor riesgo de mortalidad temprana en los pacientes sometidos a cirugía de reducción del volumen pulmonar, en comparación con la atención estándar; sin embargo, no se observaron diferencias significativas en la mortalidad general.[220]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.
http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com
La bullectomía es una opción para los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) que presentan disnea, en quienes la tomografía computarizada (TC) revela una gran cantidad de bullas que ocupan al menos el 30% del hemitórax. Un estado funcional gravemente malo y una disminución grave del VEF₁ (<500 mL) hacen que estas opciones sean menos favorables. La inserción de la válvula endobronquial puede producir mejorías clínicamente significativas en pacientes adecuadamente seleccionados con EPOC.[220]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.
http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com
[221]Klooster K, Slebos DJ, Zoumot Z, et al. Endobronchial valves for emphysema: an individual patient-level reanalysis of randomised controlled trials. BMJ Open Respir Res. 2017 Nov 2;4(1):e000214.
https://bmjopenrespres.bmj.com/content/4/1/e000214
http://www.ncbi.nlm.nih.gov/pubmed/29441206?tool=bestpractice.com
[222]Labarca G, Uribe JP, Pacheco C, et al. Bronchoscopic lung volume reduction with endobronchial zephyr valves for severe emphysema: a systematic review and meta-analysis. Respiration. 2019 May 22;98(3):268-78.
http://www.ncbi.nlm.nih.gov/pubmed/31117102?tool=bestpractice.com
El procedimiento puede ser más beneficioso en los pacientes cuya disnea se debe principalmente al tórax distendido y al atrapamiento de aire en los espacios aéreos distales a los bronquiolos terminales, que se manifiesta como enfisema con un volumen residual notablemente aumentado. Las contraindicaciones son la infección pulmonar activa y las fisuras lobares incompletas (<80%).[223]Abia-Trujillo D, Johnson MM, Patel NM, et al. Bronchoscopic lung volume reduction: a new hope for patients with severe emphysema and air trapping. Mayo Clin Proc. 2021 Feb;96(2):464-72.
http://www.ncbi.nlm.nih.gov/pubmed/32829903?tool=bestpractice.com
Los eventos adversos más frecuentes asociados con la inserción de la válvula endobronquial son neumotórax y exacerbación.[220]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.
http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com
Los criterios para la remisión para trasplante de pulmón incluyen:[224]Leard LE, Holm AM, Valapour M, et al. Consensus document for the selection of lung transplant candidates: an update from the International Society for Heart and Lung Transplantation. J Heart Lung Transplant. 2021 Nov;40(11):1349-79.
https://www.jhltonline.org/article/S1053-2498(21)02407-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34419372?tool=bestpractice.com
Puntuación de índice de masa corporal, obstrucción al flujo aéreo, disnea y ejercicio (BODE) 5-6 con factor(es) adicional(es) presente(s) que sugiere(n) un mayor riesgo de mortalidad:
Exacerbaciones agudas frecuentes
Aumento de la puntuación de BODE >1 en los últimos 24 meses
Diámetro de la arteria pulmonar frente a la aorta >1 en la exploración por TC
VEF₁ del 20% al 25% pronosticado
Deterioro clínico a pesar de un tratamiento máximo que incluya medicación, rehabilitación pulmonar, oxigenoterapia y, en su caso, ventilación nocturna con presión positiva no invasiva
Mala calidad de vida inaceptable para el paciente
En el caso de un paciente que sea candidato a una reducción del volumen pulmonar (RVP) broncoscópica o quirúrgica, lo adecuado es remitirlo simultáneamente para la evaluación del trasplante de pulmón y de la RVP
[
Índice BODE para la predicción de la supervivencia a la EPOC
Opens in new window
]
Se ha demostrado que el trasplante de pulmón mejora la calidad de vida y la capacidad funcional.[219]van Agteren JE, Carson KV, Tiong LU, et al. Lung volume reduction surgery for diffuse emphysema. Cochrane Database Syst Rev. 2016 Oct 14;(10):CD001001.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001001.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27739074?tool=bestpractice.com
Sin embargo, el trasplante de pulmón aparentemente no proporciona un beneficio en la supervivencia.[225]Stavem K, Bjørtuft Ø, Borgan Ø, et al. Lung transplantation in patients with chronic obstructive pulmonary disease in a national cohort is without obvious survival benefit. J Heart Lung Transplant. 2006 Jan;25(1):75-84.
http://www.ncbi.nlm.nih.gov/pubmed/16399534?tool=bestpractice.com
Cuidados paliativos
Las terapias paliativas para mejorar los síntomas de la disnea, ofrecer apoyo nutricional, abordar la ansiedad y la depresión y reducir la fatiga pueden beneficiar a los pacientes con EPOC que las sufren a pesar de una terapia médica óptima. Debe considerarse la opción de ofrecer atención al final de la vida y el ingreso en un hospicio para los pacientes con enfermedades muy avanzadas. El paciente y su familia deben estar bien informados acerca del avance y se sugiere que se mantengan reuniones de forma anticipada durante la evolución de la enfermedad antes de que se produzca una insuficiencia respiratoria aguda.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[226]Janssen DJA, Bajwah S, Boon MH, et al. European Respiratory Society clinical practice guideline: palliative care for people with COPD or interstitial lung disease. Eur Respir J. 2023 Aug;62(2):2202014.
https://erj.ersjournals.com/content/62/2/2202014
http://www.ncbi.nlm.nih.gov/pubmed/37290789?tool=bestpractice.com
Analgésicos opioides, ventiladores, estimulación eléctrica neuromuscular y vibración de la pared torácica pueden aliviar la disnea.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
En un estudio se sugirió que las dosis bajas de un analgésico opioide y una benzodiazepina son seguras, y no están asociadas al aumento de los ingresos hospitalarios o la mortalidad.[227]Ekström MP, Bornefalk-Hermansson A, Abernethy AP, et al. Safety of benzodiazepines and opioids in very severe respiratory disease: national prospective study. BMJ. 2014 Jan 30;348:g445.
https://www.bmj.com/content/348/bmj.g445.long
http://www.ncbi.nlm.nih.gov/pubmed/24482539?tool=bestpractice.com
Otro estudio descubrió que la morfina oral de liberación sostenida en dosis bajas durante 4 semanas mejoraba el estado de salud específico de la enfermedad en pacientes con EPOC y disnea refractaria.[228]Verberkt CA, van den Beuken-van Everdingen MHJ, Schols JMGA, et al. Effect of sustained-release morphine for refractory breathlessness in chronic obstructive pulmonary disease on health status: a randomized clinical trial. JAMA Intern Med. 2020 Oct 1;180(10):1306-14.
https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2769373
http://www.ncbi.nlm.nih.gov/pubmed/32804188?tool=bestpractice.com
Una revisión de la Cochrane concluyó que no existen pruebas a favor o en contra de las benzodiazepinas para el alivio de la disnea en personas con cáncer avanzado y EPOC.[229]Simon ST, Higginson IJ, Booth S, et al. Benzodiazepines for the relief of breathlessness in advanced malignant and non-malignant diseases in adults. Cochrane Database Syst Rev. 2016 Oct 20;(10):CD007354.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD007354.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27764523?tool=bestpractice.com
La acupuntura y la acupresión también pueden mejorar la disnea y la calidad de vida de los pacientes con EPOC avanzada.[230]von Trott P, Oei SL, Ramsenthaler C. Acupuncture for breathlessness in advanced diseases: a systematic review and meta-analysis. J Pain Symptom Manage. 2020 Feb;59(2):327-38.e3.
http://www.ncbi.nlm.nih.gov/pubmed/31539602?tool=bestpractice.com
 ]
[证据 A]
]
[证据 A]

 ]
Los LAMA más recientes, como el aclidinio, el glicopironio y el umeclidinio, presentan al menos una eficacia comparable a la del tiotropio, en lo que se refiere al cambio de la línea de base en el VEF₁, la puntuación focal del índice de disnea transicional, la puntuación del St George's Respiratory Questionnaire y el uso de medicamentos de rescate.[100] La revefenacina es un LAMA nebulizado aprobado para el tratamiento de mantenimiento de la EPOC de moderada a grave. Se ha sugerido un aumento de la mortalidad cardiovascular en algunos estudios de pacientes que reciben antagonistas muscarínicos de acción corta y en algunos estudios de pacientes que reciben LAMA.[101][102] Un estudio llegó a la conclusión de que el aclidinio no estaba asociado con un aumento de los principales eventos cardiovasculares adversos, en comparación con el placebo.[103] Un estudio de cohorte basado en la población encontró que los hombres de edad más avanzada con EPOC recién iniciados en LAMA presentan un mayor riesgo de infecciones del tracto urinario.[104]
]
Los LAMA más recientes, como el aclidinio, el glicopironio y el umeclidinio, presentan al menos una eficacia comparable a la del tiotropio, en lo que se refiere al cambio de la línea de base en el VEF₁, la puntuación focal del índice de disnea transicional, la puntuación del St George's Respiratory Questionnaire y el uso de medicamentos de rescate.[100] La revefenacina es un LAMA nebulizado aprobado para el tratamiento de mantenimiento de la EPOC de moderada a grave. Se ha sugerido un aumento de la mortalidad cardiovascular en algunos estudios de pacientes que reciben antagonistas muscarínicos de acción corta y en algunos estudios de pacientes que reciben LAMA.[101][102] Un estudio llegó a la conclusión de que el aclidinio no estaba asociado con un aumento de los principales eventos cardiovasculares adversos, en comparación con el placebo.[103] Un estudio de cohorte basado en la población encontró que los hombres de edad más avanzada con EPOC recién iniciados en LAMA presentan un mayor riesgo de infecciones del tracto urinario.[104] ]
[Evidence A] En casos de EPOC estable, si se toma la decisión de utilizar una monoterapia, los LAMA pueden presentar mejores resultados en comparación a los fármacos LABA.[105] Los LAMA presentan un mayor efecto en la reducción de la exacerbación que los LABA en pacientes con EPOC moderada a muy grave.[106][107] En el ensayo UPLIFT, se demostró la seguridad a largo plazo de los LAMA.[108]
]
[Evidence A] En casos de EPOC estable, si se toma la decisión de utilizar una monoterapia, los LAMA pueden presentar mejores resultados en comparación a los fármacos LABA.[105] Los LAMA presentan un mayor efecto en la reducción de la exacerbación que los LABA en pacientes con EPOC moderada a muy grave.[106][107] En el ensayo UPLIFT, se demostró la seguridad a largo plazo de los LAMA.[108] ]
]
 ]
]
 ]
Una revisión sistemática y un metanálisis de la red encontraron que todas las combinaciones de dosis fija de LABA/LAMA presentaron una eficacia y seguridad similares.[115]
]
Una revisión sistemática y un metanálisis de la red encontraron que todas las combinaciones de dosis fija de LABA/LAMA presentaron una eficacia y seguridad similares.[115] ]
El riesgo es mayor con fluticasona en comparación con budesonida.[122][123][124] Un estudio realizado en una cohorte de gran tamaño de pacientes daneses descubrió que el riesgo de contraer Pseudomonas aeruginosa, una causa común de neumonía hospitalaria, dependía de la dosis, y que los CSI de dosis altas eran los que presentaban mayor riesgo. El estudio también descubrió que los pacientes con P aeruginosa eran más propensos a tener un IMC y un VEF₁ más bajos que los pacientes sin P aeruginosa.[125] Una revisión sistemática y un metanálisis encontraron que, a pesar de un aumento significativo del riesgo no ajustado de neumonía asociado al uso de CSI, la mortalidad por neumonía y la mortalidad global no aumentaron en los ensayos aleatorizados controlados y disminuyeron en los estudios observacionales.[126] Por lo tanto, se debe implementar un método de tratamiento individualizado que evalúe el riesgo del paciente de tener neumonía frente al beneficio de disminución de las exacerbaciones.[85][127][128] También es preocupante el aumento del riesgo de tuberculosis y gripe en pacientes adultos con EPOC que reciben tratamiento con CSI, aunque un metanálisis halló que menos del 1% de todos los casos de tuberculosis evaluados eran atribuibles a la exposición a los CSI.[129][130] Los CSI también pueden causar candidiasis orofaríngea y ronquera.[85]
[
]
El riesgo es mayor con fluticasona en comparación con budesonida.[122][123][124] Un estudio realizado en una cohorte de gran tamaño de pacientes daneses descubrió que el riesgo de contraer Pseudomonas aeruginosa, una causa común de neumonía hospitalaria, dependía de la dosis, y que los CSI de dosis altas eran los que presentaban mayor riesgo. El estudio también descubrió que los pacientes con P aeruginosa eran más propensos a tener un IMC y un VEF₁ más bajos que los pacientes sin P aeruginosa.[125] Una revisión sistemática y un metanálisis encontraron que, a pesar de un aumento significativo del riesgo no ajustado de neumonía asociado al uso de CSI, la mortalidad por neumonía y la mortalidad global no aumentaron en los ensayos aleatorizados controlados y disminuyeron en los estudios observacionales.[126] Por lo tanto, se debe implementar un método de tratamiento individualizado que evalúe el riesgo del paciente de tener neumonía frente al beneficio de disminución de las exacerbaciones.[85][127][128] También es preocupante el aumento del riesgo de tuberculosis y gripe en pacientes adultos con EPOC que reciben tratamiento con CSI, aunque un metanálisis halló que menos del 1% de todos los casos de tuberculosis evaluados eran atribuibles a la exposición a los CSI.[129][130] Los CSI también pueden causar candidiasis orofaríngea y ronquera.[85]
[  ]
]
 ]
Esta combinación es práctica y puede ayudar con el cumplimiento del tratamiento a algunos pacientes. La elección del tratamiento en esta categoría se basa en la disponibilidad, y la respuesta y preferencia individuales.[133] La combinación puede proporcionarse en inhaladores separados o en un inhalador combinado.
]
Esta combinación es práctica y puede ayudar con el cumplimiento del tratamiento a algunos pacientes. La elección del tratamiento en esta categoría se basa en la disponibilidad, y la respuesta y preferencia individuales.[133] La combinación puede proporcionarse en inhaladores separados o en un inhalador combinado. ]
]
 ]
No hay datos que demuestren la eficacia o la seguridad del tratamiento crónico con azitromicina después de un año de tratamiento.
]
No hay datos que demuestren la eficacia o la seguridad del tratamiento crónico con azitromicina después de un año de tratamiento. ]
El momento óptimo, los componentes, la duración y los modelos para mejorar la actividad física siguen sin estar claros. Los metanálisis sugieren que el yoga, el Qigong y otros ejercicios respiratorios caseros pueden mejorar la capacidad de ejercicio y la función pulmonar en pacientes con EPOC.[179][180][181] Se ha demostrado que la práctica del Tai Chi mejora la capacidad de ejercicio en comparación con la atención habitual.[182]
]
El momento óptimo, los componentes, la duración y los modelos para mejorar la actividad física siguen sin estar claros. Los metanálisis sugieren que el yoga, el Qigong y otros ejercicios respiratorios caseros pueden mejorar la capacidad de ejercicio y la función pulmonar en pacientes con EPOC.[179][180][181] Se ha demostrado que la práctica del Tai Chi mejora la capacidad de ejercicio en comparación con la atención habitual.[182] ]
Producen una pequeña reducción de la frecuencia de las exacerbaciones agudas y de los días de incapacidad por mes, pero no mejoran la función pulmonar ni la calidad de vida.[190][191][192] La erdosteina y la carbocisteína no están disponibles en los Estados Unidos. El tratamiento con fármacos mucolíticos como la carbocisteína y la acetilcisteína puede reducir las exacerbaciones y mejorar modestamente el estado de salud de los pacientes que no reciben CSI.[1] Sin embargo, la erdosteína puede tener un efecto significativo en las exacerbaciones leves, tanto si el paciente está tomando CSI, como si no.[1]
]
Producen una pequeña reducción de la frecuencia de las exacerbaciones agudas y de los días de incapacidad por mes, pero no mejoran la función pulmonar ni la calidad de vida.[190][191][192] La erdosteina y la carbocisteína no están disponibles en los Estados Unidos. El tratamiento con fármacos mucolíticos como la carbocisteína y la acetilcisteína puede reducir las exacerbaciones y mejorar modestamente el estado de salud de los pacientes que no reciben CSI.[1] Sin embargo, la erdosteína puede tener un efecto significativo en las exacerbaciones leves, tanto si el paciente está tomando CSI, como si no.[1] ]
Hay evidencia que apoya el inicio de la rehabilitación pulmonar dentro de 1 mes después de la aparición de una exacerbación aguda.[196][197]
]
Hay evidencia que apoya el inicio de la rehabilitación pulmonar dentro de 1 mes después de la aparición de una exacerbación aguda.[196][197] ]
]
 ]
Se utilizan para mejorar la dinámica pulmonar, el cumplimiento del régimen de ejercicio y la calidad de vida.[219] La cirugía de reducción del volumen pulmonar se indica en pacientes con limitación del flujo aéreo muy grave y especialmente en los pacientes que presentan enfermedad del lóbulo superior localizada y una capacidad para hacer ejercicio menor de lo normal.[218]
[
]
Se utilizan para mejorar la dinámica pulmonar, el cumplimiento del régimen de ejercicio y la calidad de vida.[219] La cirugía de reducción del volumen pulmonar se indica en pacientes con limitación del flujo aéreo muy grave y especialmente en los pacientes que presentan enfermedad del lóbulo superior localizada y una capacidad para hacer ejercicio menor de lo normal.[218]
[  ]
Un metanálisis encontró un mayor riesgo de mortalidad temprana en los pacientes sometidos a cirugía de reducción del volumen pulmonar, en comparación con la atención estándar; sin embargo, no se observaron diferencias significativas en la mortalidad general.[220] La bullectomía es una opción para los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) que presentan disnea, en quienes la tomografía computarizada (TC) revela una gran cantidad de bullas que ocupan al menos el 30% del hemitórax. Un estado funcional gravemente malo y una disminución grave del VEF₁ (<500 mL) hacen que estas opciones sean menos favorables. La inserción de la válvula endobronquial puede producir mejorías clínicamente significativas en pacientes adecuadamente seleccionados con EPOC.[220][221][222] El procedimiento puede ser más beneficioso en los pacientes cuya disnea se debe principalmente al tórax distendido y al atrapamiento de aire en los espacios aéreos distales a los bronquiolos terminales, que se manifiesta como enfisema con un volumen residual notablemente aumentado. Las contraindicaciones son la infección pulmonar activa y las fisuras lobares incompletas (<80%).[223] Los eventos adversos más frecuentes asociados con la inserción de la válvula endobronquial son neumotórax y exacerbación.[220]
]
Un metanálisis encontró un mayor riesgo de mortalidad temprana en los pacientes sometidos a cirugía de reducción del volumen pulmonar, en comparación con la atención estándar; sin embargo, no se observaron diferencias significativas en la mortalidad general.[220] La bullectomía es una opción para los pacientes con enfermedad pulmonar obstructiva crónica (EPOC) que presentan disnea, en quienes la tomografía computarizada (TC) revela una gran cantidad de bullas que ocupan al menos el 30% del hemitórax. Un estado funcional gravemente malo y una disminución grave del VEF₁ (<500 mL) hacen que estas opciones sean menos favorables. La inserción de la válvula endobronquial puede producir mejorías clínicamente significativas en pacientes adecuadamente seleccionados con EPOC.[220][221][222] El procedimiento puede ser más beneficioso en los pacientes cuya disnea se debe principalmente al tórax distendido y al atrapamiento de aire en los espacios aéreos distales a los bronquiolos terminales, que se manifiesta como enfisema con un volumen residual notablemente aumentado. Las contraindicaciones son la infección pulmonar activa y las fisuras lobares incompletas (<80%).[223] Los eventos adversos más frecuentes asociados con la inserción de la válvula endobronquial son neumotórax y exacerbación.[220]






