Os objetivos do tratamento da doença pulmonar obstrutiva crônica (DPOC) são prevenir e controlar os sintomas, reduzir a gravidade e o número das exacerbações, melhorar a capacidade respiratória a fim de aumentar a tolerância aos exercícios e reduzir a mortalidade.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Revisões sistemáticas relatam uma redução modesta no índice de redução do VEF₁ entre os pacientes que recebem terapia farmacológica.[84]Celli BR, Anderson JA, Cowans NJ, et al. Pharmacotherapy and lung function decline in patients with chronic obstructive pulmonary disease. A systematic review. Am J Respir Crit Care Med. 2021 Mar 15;203(6):689-98.
https://www.atsjournals.org/doi/10.1164/rccm.202005-1854OC
http://www.ncbi.nlm.nih.gov/pubmed/32966751?tool=bestpractice.com
[85]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com
São necessárias pesquisas adicionais para descobrir quais pacientes têm maior probabilidade de se beneficiar.
Há uma abordagem gradativa à terapia, e o tratamento deve ser individualizado com base no estado geral de saúde e nas comorbidades clínicas. Se um paciente com DPOC tiver asma concomitante, ele deve ser tratado primariamente de acordo com as diretrizes para asma.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Consulte Asma em adultos. Para obter mais detalhes sobre o tratamento da deficiência de alfa 1-antitripsina, consulte Deficiência de alfa 1-antitripsina.
A abordagem terapêutica envolve redução da exposição aos fatores de risco, avaliação adequada da doença, educação do paciente, manejo farmacológico e não farmacológico da DPOC estável, prevenção e tratamento das exacerbações da DPOC aguda.
A Organização Mundial da Saúde (OMS) especificou um conjunto mínimo de intervenções para o tratamento da DPOC estável na atenção primária.
WHO: package of essential noncommunicable (PEN) disease interventions for primary health care
Opens in new window
Avaliação contínua e monitoramento da doença
O monitoramento e avaliação contínuos da DPOC garantem que os objetivos do tratamento estejam sendo atingidos. A qualidade de vida e a sensação de bem-estar do paciente irão melhorar, e as internações hospitalares diminuirão significativamente, quando o monitoramento profissional ou o automonitoramento da doença estiverem sendo realizados.[86]Lemmens KM, Nieboer AP, Huijsman R. A systematic review of integrated use of disease-management interventions in asthma and COPD. Respir Med. 2009 May;103(5):670-91.
http://www.ncbi.nlm.nih.gov/pubmed/19155168?tool=bestpractice.com
Essa avaliação da história médica deve incluir:
Exposição aos fatores de risco e medidas preventivas:
Fumaça de tabaco
Poluição do ar em ambientes abertos e fechados
Exposição ocupacional (fumaça, poeira, etc.)
Vacinação contra pneumococos e gripe (influenza)
Progressão da doença e desenvolvimento de complicações:
Redução da tolerância ao exercício
Aumento dos sintomas
Piora da qualidade do sono
Faltas no trabalho ou em outras atividades
Farmacoterapia e outros tratamentos médicos:
Qual a frequência do uso da medicação inalatória de resgate
Uso de qualquer novo medicamento
Adesão ao esquema terapêutico
Habilidade para usar os inaladores adequadamente
Efeitos adversos
História de exacerbação
Visitas ao pronto-socorro ou unidades de pronto atendimento
Uso recente de corticosteroide oral de altas taxas de liberação
Deve-se avaliar a frequência, a gravidade e as prováveis causas das exacerbações
Comorbidades:
Além disso, a avaliação objetiva da função pulmonar deve ser obtida anualmente ou com maior frequência se houver um aumento substancial dos sintomas.
Uma revisão Cochrane demonstrou que o manejo integrado da doença (MID), no qual vários profissionais de saúde (fisioterapeuta, pneumologista, enfermeira, etc.) trabalham junto aos pacientes, provavelmente resulta em melhora na qualidade de vida específica para a doença, capacidade de exercício, internação hospitalar e atendimento em regime de hospital-dia por pessoa.[87]Poot CC, Meijer E, Kruis AL, et al. Integrated disease management interventions for patients with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2021 Sep 8;(9):CD009437.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD009437.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/34495549?tool=bestpractice.com
[  ]
What are the effects of integrated disease management (IDM) interventions for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3877/fullMostre-me a resposta[Evidência A]76ea49b7-0eff-463d-90da-4755f900cedfccaAQuais são os efeitos das intervenções de manejo integral da doença (MID) para indivíduos com doença pulmonar obstrutiva crônica (DPOC)?
]
What are the effects of integrated disease management (IDM) interventions for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3877/fullMostre-me a resposta[Evidência A]76ea49b7-0eff-463d-90da-4755f900cedfccaAQuais são os efeitos das intervenções de manejo integral da doença (MID) para indivíduos com doença pulmonar obstrutiva crônica (DPOC)?
Exacerbações agudas
A exacerbação da DPOC é definida como um evento caracterizado por uma mudança na dispneia, tosse e/ou escarro em relação ao estado basal do paciente que esteja além do normal das variações diárias e seja de início agudo. Ver Exacerbação aguda de doença pulmonar obstrutiva crônica.
Tratamento crônico: terapia escalonada de acordo com o grupo GOLD
As diretrizes da Global Initiative for Chronic Obstructive Lung Disease (GOLD) recomendam que o tratamento inicial seja determinado pelo grupo GOLD do paciente no momento do diagnóstico:[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Broncodilatadores de resgate de ação curta devem ser prescritos para todos os pacientes, para alívio imediato dos sintomas. A ausência de resposta ao broncodilatador de ação curta pode significar uma exacerbação aguda.
Para pacientes do grupo A (poucos sintomas [Modified British Medical Research Council {mMRC} 0-1 ou Teste de Avaliação da DPOC {CAT} <10 ] e baixo risco de exacerbações [0-1 exacerbação por ano, não necessitando de hospitalização]), oferece-se inicialmente um broncodilatador de ação curta ou prolongada. Os beta-2 agonistas de longa duração (BALDs) e antagonistas muscarínicos de longa duração (LAMAs) são preferidos em relação aos broncodilatadores de ação curta, exceto para pacientes com dispneia ocasional apenas.
Para pacientes do grupo B (mais sintomas [mMRC ≥2 ou CAT ≥10] e baixo risco de exacerbações [0-1 exacerbações por ano, sem necessidade de hospitalização]), o tratamento combinado BALD/LAMA deve ser oferecido como primeira linha na ausência de problemas com efeitos adversos ou disponibilidade. Caso contrário, pode ser prescrito um LAMA ou um BALD. Não há evidências que justifiquem recomendar uma classe de broncodilatador de ação prolongada em detrimento de outra. A escolha depende da percepção do paciente quanto ao alívio dos sintomas. Os pacientes do grupo B podem ter comorbidades que agravem seus sintomas e afetem seu prognóstico; assim, qualquer comorbidade potencial deve ser considerada e investigada.
Para pacientes do grupo E (alto risco de exacerbações [≥2 exacerbações por ano ou ≥1 necessitando de hospitalização] e qualquer nível de sintomas), o tratamento combinado BALD/LAMA é a terapia de primeira linha na ausência de problemas com efeitos adversos ou disponibilidade. A adição de um corticosteroide inalatório (CI) a uma combinação BALD/LAMA pode ser considerada se a contagem de eosinófilos no sangue do paciente for ≥300 células/microlitro (terapia tripla).' O uso de CIs com BALD isoladamente não é recomendado.
[Figure caption and citation for the preceding image starts]: Tratamento farmacológico inicial da DPOCGlobal Initiative for Chronic Obstructive Lung Disease (GOLD). Estratégia global para o diagnóstico, tratamento e prevenção da doença pulmonar obstrutiva crônica (relatório de 2025); reproduzido com permissão [Citation ends].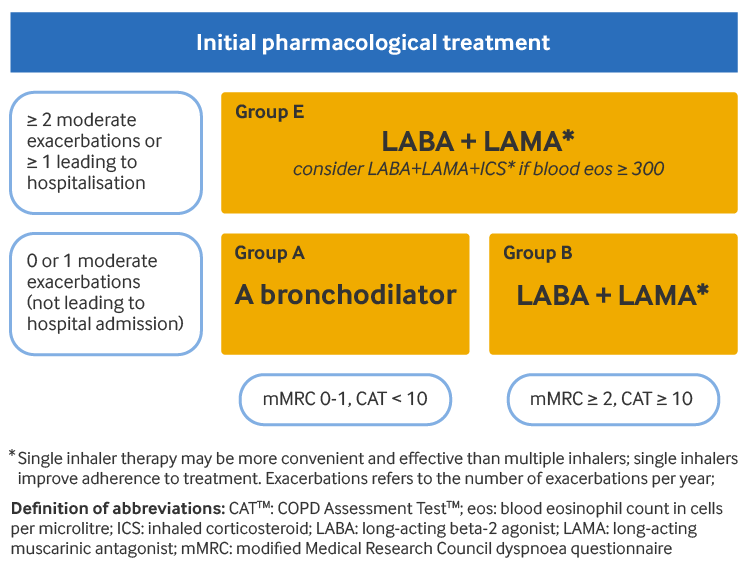
O tratamento adicional é determinado pela carga de sintomas de dispneia/limitação de exercícios do paciente e pela frequência das exacerbações após a revisão e é independente do grupo GOLD do paciente ao diagnóstico. A GOLD recomenda diferentes vias de tratamento, dependendo do objetivo do tratamento primário: aliviar os sintomas de dispneia/limitação para o exercício ou reduzir as exacerbações. Se o tratamento for necessário para ambos os fins, os médicos devem seguir a via da exacerbação.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Antes de qualquer ajuste no tratamento, os pacientes devem ser examinados quanto a sintomas e risco de exacerbação, e sua técnica de inalação e adesão ao tratamento devem ser avaliadas. O papel do tratamento não farmacológico também deve ser avaliado. Se a resposta do paciente ao tratamento inicial for adequada, o tratamento inicial pode ser mantido. O ajuste do tratamento farmacológico pode consistir no aumento ou na redução da terapia, bem como nas trocas de dispositivos inalatórios ou moléculas dentro da mesma classe de medicamentos. Se o tratamento for alterado, os médicos devem avaliar o paciente em relação à resposta clínica e a quaisquer efeitos adversos potenciais.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
O reforço da terapia recomendado para os pacientes com dispneia/limitação para o exercício após a terapia inicial deve ser da seguinte forma:[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Pacientes submetidos a monoterapia com broncodilatador de ação prolongada devem iniciar um segundo broncodilatador de ação prolongada
Se os sintomas persistirem após a adição de um segundo broncodilatador de ação prolongada
considere trocar o dispositivo inalador ou implementação de moléculas
ou escale o tratamento não farmacológico (por exemplo, reabilitação pulmonar)
considere adicionar ensifentrina (um inibidor da fosfodiesterase-3 [PDE-3] e PDE-4)
A dispneia por outras causas deve ser considerada, investigada e tratada. A técnica de inalação e a adesão também devem ser reavaliadas, pois podem levar a uma resposta inadequada ao tratamento.
O escalonamento da terapia recomendado para os pacientes com exacerbações persistentes após a terapia inicial deve ser da seguinte forma:[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Pacientes submetidos à monoterapia com broncodilatador de ação prolongada devem aumentar a terapia para BALD/LAMA. A contagem de eosinófilos no sangue pode identificar os pacientes com maior probabilidade de responderem aos CIs.[76]Bafadhel M, Peterson S, De Blas MA, et al. Predictors of exacerbation risk and response to budesonide in patients with chronic obstructive pulmonary disease: a post-hoc analysis of three randomised trials. Lancet Respir Med. 2018 Feb;6(2):117-26.
http://www.ncbi.nlm.nih.gov/pubmed/29331313?tool=bestpractice.com
[77]Harries TH, Rowland V, Corrigan CJ, et al. Blood eosinophil count, a marker of inhaled corticosteroid effectiveness in preventing COPD exacerbations in post-hoc RCT and observational studies: systematic review and meta-analysis. Respir Res. 2020 Jan 3;21(1):3.
https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1268-7
http://www.ncbi.nlm.nih.gov/pubmed/31900184?tool=bestpractice.com
[78]Oshagbemi OA, Odiba JO, Daniel A, et al. Absolute blood eosinophil counts to guide inhaled corticosteroids therapy among patients with COPD: systematic review and meta-analysis. Curr Drug Targets. 2019;20(16):1670-9.
http://www.ncbi.nlm.nih.gov/pubmed/31393244?tool=bestpractice.com
O escalonamento para terapia tripla com BALD/LAMA/CI pode ser considerado para os pacientes em monoterapia com broncodilatador de ação prolongada se a contagem de eosinófilos periféricos for ≥300 células/microlitro. É improvável que os CI sejam benéficos nos pacientes cuja contagem de eosinófilos no sangue seja <100 células/microlitro.
Pacientes que tomam BALD/LAMA e cujos eosinófilos sanguíneos são ≥100 células/microlitro devem passar para a terapia tripla com BALD/LAMA/CI. Vários estudos respaldam a terapia tríplice com BALDs/LAMAs/CIs como sendo superior à terapia com um ou dois agentes, com BALD/LAMA ou LABA/CI, em relação à taxa de exacerbações moderadas a graves da DPOC e á taxa de hospitalizações.[80]Cazzola M, Rogliani P, Calzetta L, et al. Triple therapy versus single and dual long-acting bronchodilator therapy in COPD: a systematic review and meta-analysis. Eur Respir J. 2018 Dec 13;52(6):1801586.
https://erj.ersjournals.com/content/52/6/1801586
http://www.ncbi.nlm.nih.gov/pubmed/30309975?tool=bestpractice.com
[88]Singh D, Papi A, Corradi M, et al. Single inhaler triple therapy versus inhaled corticosteroid plus long-acting beta2-agonist therapy for chronic obstructive pulmonary disease (TRILOGY): a double-blind, parallel group, randomised controlled trial. Lancet. 2016 Sep 3;388(10048):963-73.
http://www.ncbi.nlm.nih.gov/pubmed/27598678?tool=bestpractice.com
[89]Vestbo J, Papi A, Corradi M, et al. Single inhaler extrafine triple therapy versus long-acting muscarinic antagonist therapy for chronic obstructive pulmonary disease (TRINITY): a double-blind, parallel group, randomised controlled trial. Lancet. 2017 May 13;389(10082):1919-29.
http://www.ncbi.nlm.nih.gov/pubmed/28385353?tool=bestpractice.com
[90]Papi A, Vestbo J, Fabbri L, et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): a double-blind, parallel group, randomised controlled trial. Lancet. 2018 Mar 17;391(10125):1076-84.
http://www.ncbi.nlm.nih.gov/pubmed/29429593?tool=bestpractice.com
[91]Lipson DA, Barnacle H, Birk R, et al. FULFIL Trial: once-daily triple therapy for patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2017 Aug 15;196(4):438-46.
https://www.atsjournals.org/doi/full/10.1164/rccm.201703-0449OC
http://www.ncbi.nlm.nih.gov/pubmed/28375647?tool=bestpractice.com
[92]Lipson DA, Barnhart F, Brealey N, et al. Once-daily single-inhaler triple versus dual therapy in patients with COPD. N Engl J Med. 2018 May 3;378(18):1671-80.
https://www.nejm.org/doi/10.1056/NEJMoa1713901
http://www.ncbi.nlm.nih.gov/pubmed/29668352?tool=bestpractice.com
[93]Rojas-Reyes MX, García Morales OM, Dennis RJ, et al. Combination inhaled steroid and long-acting beta₂-agonist in addition to tiotropium versus tiotropium or combination alone for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2016 Jun 6;(6):CD008532.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD008532.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27271056?tool=bestpractice.com
[94]Lai CC, Chen CH, Lin CYH, et al. The effects of single inhaler triple therapy vs single inhaler dual therapy or separate triple therapy for the management of chronic obstructive pulmonary disease: a systematic review and meta-analysis of randomized controlled trials. Int J Chron Obstruct Pulmon Dis. 2019 Jul 11;14:1539-48. [Erratum in: Int J Chron Obstruct Pulmon Dis. 2020 Jan 21;15:155-6.]
https://www.dovepress.com/the-effects-of-single-inhaler-triple-therapy-vs-single-inhaler-dual-th-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/31371939?tool=bestpractice.com
[95]Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med. 2020 Jul 2;383(1):35-48.
http://www.ncbi.nlm.nih.gov/pubmed/32579807?tool=bestpractice.com
As diretrizes da American Thoracic Society recomendam o uso de terapia tripla nos pacientes que tiverem apresentado uma ou mais exacerbações com necessidade de corticosteroides orais, antibióticos ou hospitalização no último ano e que tiverem sintomas de dispneia ou redução da tolerância ao exercício apesar de uma terapia dupla com BALD/LAMA.[96]Nici L, Mammen MJ, Charbek E, et al. Pharmacologic management of chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 May 1;201(9):e56-69.
https://www.atsjournals.org/doi/10.1164/rccm.202003-0625ST
http://www.ncbi.nlm.nih.gov/pubmed/32283960?tool=bestpractice.com
As diretrizes do Reino Unido recomendam o uso de terapia tripla em pacientes com exacerbação que exija hospitalização ou duas exacerbações moderadas dentro de um ano, apesar da dupla terapia com BALD/LAMA.[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].
https://www.nice.org.uk/guidance/ng115
Pacientes que tomam BALD/LAMA e cujos eosinófilos no sangue são <100 células/microlitro devem acrescentar roflumilaste ou azitromicina.
A combinação BALD/CI não é recomendada pela GOLD. No entanto, o paciente com DPOC que apresentou exacerbação anteriormente e respondeu a BALD/CI (e não apresenta exacerbação atualmente) pode continuar recebendo BALD/CI; alta carga de sintomas pode justificar escalar para BALD/LAMA/CI nessa população de pacientes. Se o paciente que atualmente recebe BALD/CI não apresenta história de exacerbação, considere trocar para BALD/LAMA. Pacientes em tratamento com BALD/CI com exacerbação atual e contagem de eosinófilos no sangue <100 células/microlitro podem ser candidatos para trocar para BALD/LAMA. Aqueles com exacerbação atual e contagem de eosinófilos no sangue ≥100 células/microlitro enquanto usam BALD/CI devem ser escalados para terapia tripla com a adição de LAMA.
Pacientes que recebem BALD/LAMA/CI podem adicionar roflumilaste, azitromicina ou dupilumabe (um anticorpo monoclonal do antagonista do receptor da interleucina [IL]-4). O roflumilaste pode ser considerado para os pacientes com volume expiratório forçado a 1 segundo (VEF₁) <50% do predito e bronquite crônica, particularmente se tiverem tido pelo menos uma hospitalização por causa de exacerbação no ano anterior. O risco de desenvolvimento de organismos resistentes aos antibióticos deve ser considerado ao se prescrever a azitromicina. Dupilumabe pode ser considerado em pacientes com bronquite crônica cuja contagem de eosinófilos no sangue é de ≥300 células/microlitro. Os CIs podem ser descontinuados se forem inefetivos ou causarem efeitos adversos. Os pacientes com eosinófilos no sangue ≥300 células/microlitro têm um maior risco de exacerbações após a suspensão do CI.[81]Chapman KR, Hurst JR, Frent SM, et al. Long-term triple therapy de-escalation to indacaterol/glycopyrronium in patients with chronic obstructive pulmonary disease (SUNSET): a randomized, double-blind, triple-dummy clinical trial. Am J Respir Crit Care Med. 2018 Aug 1;198(3):329-39.
https://www.atsjournals.org/doi/10.1164/rccm.201803-0405OC
http://www.ncbi.nlm.nih.gov/pubmed/29779416?tool=bestpractice.com
Todos os pacientes são candidatos para orientação, vacinação e intervenções para o abandono do hábito de fumar.
[Figure caption and citation for the preceding image starts]: Escalonamento da terapia para pacientes com DPOC. Definição de abreviaturas: CI: corticosteroide inalatório; BALD: beta-2 agonista de longa duração; LAMA: antagonista muscarínico de ação prolongadaGlobal Initiative for Chronic Obstructive Lung Disease (GOLD). Estratégia global para o diagnóstico, tratamento e prevenção da doença pulmonar obstrutiva crônica (relatório de 2025); reproduzido com permissão [Citation ends].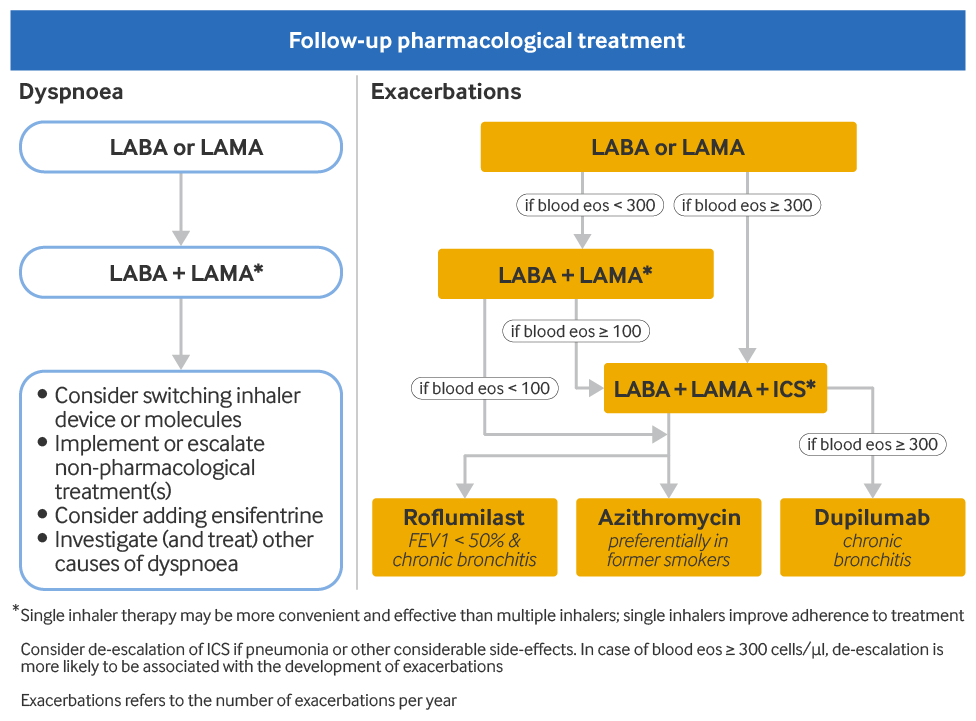
Broncodilatadores
Os beta-2 agonistas são amplamente usados no tratamento da DPOC. Eles aumentam a cAMP (adenosina monofosfato cíclica) intracelular, causando o relaxamento do músculo liso respiratório e a redução da resistência das vias aéreas. Antagonistas muscarínicos (anticolinérgicos) agem como broncodilatadores ao bloquear os receptores colinérgicos no músculo liso respiratório. Isso causa relaxamento muscular e reduz a limitação do fluxo aéreo. Dessa forma, os beta-agonistas e os antagonistas muscarínicos oferecem efeitos broncodilatadores por diferentes vias. Ambos estão disponíveis como preparações de ação curta e de ação prolongada.
Os beta-2 agonistas de ação curta (por exemplo, salbutamol) e os antagonistas muscarínicos de ação curta (por exemplo, ipratrópio) melhoram a função pulmonar, a dispneia e a qualidade de vida. O ipratrópio pode ter um pequeno benefício sobre os beta-2 agonistas de ação curta no que diz respeito à melhoria da qualidade de vida relacionada à saúde.[97]Appleton S, Jones T, Poole P, et al. Ipratropium bromide versus short acting beta-2 agonists for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2006 Apr 19;(2):CD001387.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001387.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/16625543?tool=bestpractice.com
Esses agentes podem ser usados como terapia de resgate quando o paciente estiver usando terapia broncodilatadora de ação prolongada e podem ser usados como tratamento inicial para pacientes do grupo A da GOLD se os pacientes tiverem apenas dispneia ocasional.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[98]Chen AM, Bollmeier SG, Finnegan PM, et al. Long-acting bronchodilator therapy for the treatment of chronic obstructive pulmonary disease. Ann Pharmacother. 2008 Dec;42(12):1832-42.
http://www.ncbi.nlm.nih.gov/pubmed/18957624?tool=bestpractice.com
No entanto, o uso regular dos broncodilatadores de ação curta geralmente não é recomendado.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
O tiotrópio, um LAMA, mostrou reduzir o risco de exacerbações em comparação com o placebo ou com outros tratamentos de manutenção.[99]Halpin DM, Vogelmeier C, Pieper MP, et al. Effect of tiotropium on COPD exacerbations: a systematic review. Respir Med. 2016 May;114:1-8.
https://www.resmedjournal.com/article/S0954-6111(16)30030-0/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/27109805?tool=bestpractice.com
[  ]
How does tiotropium compare with ipratropium bromide for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.2154/fullMostre-me a resposta Os LAMAs mais recentes, tais como o aclidínio, o glicopirrônio e o umeclidínio, têm uma eficácia pelo menos comparável à do tiotrópio, em termos de mudança em relação ao VEF₁ de vale, ao escore focal do índice de dispneia transitória, ao escore St George's Respiratory Questionnaire e ao uso de medicações de resgate basais.[100]Ismaila AS, Huisman EL, Punekar YS, et al. Comparative efficacy of long-acting muscarinic antagonist monotherapies in COPD: a systematic review and network meta-analysis. Int J Chron Obstruct Pulmon Dis. 2015 Nov 16;10(1):2495-517.
https://www.dovepress.com/comparative-efficacy-of-long-acting-muscarinic-antagonist-monotherapie-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/26604738?tool=bestpractice.com
A revefenacina é um LAMA nebulizado aprovado para o tratamento de manutenção da DPOC moderada a grave. Há uma sugestão de aumento na mortalidade relacionada a doenças cardiovasculares em alguns estudos de pacientes que utilizam antagonistas muscarínicos de ação curta e em alguns estudos de pacientes que fazem uso de LAMAs.[101]Hilleman DE, Malesker MA, Morrow LE, et al. A systematic review of the cardiovascular risk of inhaled anticholinergics in patients with COPD. Int J Chron Obstruct Pulmon Dis. 2009 Jun 29;4:253-63.
https://www.dovepress.com/getfile.php?fileID=5012
http://www.ncbi.nlm.nih.gov/pubmed/19657399?tool=bestpractice.com
[102]Wang MT, Liou JT, Lin CW, et al. Association of cardiovascular risk with inhaled long-acting bronchodilators in patients with chronic obstructive pulmonary disease: a nested case-control study. JAMA Intern Med. 2018 Feb 1;178(2):229-38.
https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2666790
http://www.ncbi.nlm.nih.gov/pubmed/29297057?tool=bestpractice.com
Um estudo concluiu que o aclidínio não esteve associado a nenhum aumento nos eventos adversos cardiovasculares importantes, em comparação com o placebo.[103]Wise RA, Chapman KR, Scirica BM, et al. Effect of aclidinium bromide on major cardiovascular events and exacerbations in high-risk patients with chronic obstructive pulmonary disease: the ASCENT-COPD randomized clinical trial. JAMA. 2019 May 7;321(17):1693-701.
https://jamanetwork.com/journals/jama/fullarticle/2732574
http://www.ncbi.nlm.nih.gov/pubmed/31063575?tool=bestpractice.com
Um estudo de coorte de base populacional constatou que homens mais velhos com DPOC recém-iniciados no uso de LAMAs têm maior risco de infecções do trato urinário.[104]Gershon AS, Newman AM, Fischer HD, et al. Inhaled long-acting anticholinergics and urinary tract infection in individuals with COPD. COPD. 2017 Feb;14(1):105-12.
http://www.ncbi.nlm.nih.gov/pubmed/27732117?tool=bestpractice.com
]
How does tiotropium compare with ipratropium bromide for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.2154/fullMostre-me a resposta Os LAMAs mais recentes, tais como o aclidínio, o glicopirrônio e o umeclidínio, têm uma eficácia pelo menos comparável à do tiotrópio, em termos de mudança em relação ao VEF₁ de vale, ao escore focal do índice de dispneia transitória, ao escore St George's Respiratory Questionnaire e ao uso de medicações de resgate basais.[100]Ismaila AS, Huisman EL, Punekar YS, et al. Comparative efficacy of long-acting muscarinic antagonist monotherapies in COPD: a systematic review and network meta-analysis. Int J Chron Obstruct Pulmon Dis. 2015 Nov 16;10(1):2495-517.
https://www.dovepress.com/comparative-efficacy-of-long-acting-muscarinic-antagonist-monotherapie-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/26604738?tool=bestpractice.com
A revefenacina é um LAMA nebulizado aprovado para o tratamento de manutenção da DPOC moderada a grave. Há uma sugestão de aumento na mortalidade relacionada a doenças cardiovasculares em alguns estudos de pacientes que utilizam antagonistas muscarínicos de ação curta e em alguns estudos de pacientes que fazem uso de LAMAs.[101]Hilleman DE, Malesker MA, Morrow LE, et al. A systematic review of the cardiovascular risk of inhaled anticholinergics in patients with COPD. Int J Chron Obstruct Pulmon Dis. 2009 Jun 29;4:253-63.
https://www.dovepress.com/getfile.php?fileID=5012
http://www.ncbi.nlm.nih.gov/pubmed/19657399?tool=bestpractice.com
[102]Wang MT, Liou JT, Lin CW, et al. Association of cardiovascular risk with inhaled long-acting bronchodilators in patients with chronic obstructive pulmonary disease: a nested case-control study. JAMA Intern Med. 2018 Feb 1;178(2):229-38.
https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2666790
http://www.ncbi.nlm.nih.gov/pubmed/29297057?tool=bestpractice.com
Um estudo concluiu que o aclidínio não esteve associado a nenhum aumento nos eventos adversos cardiovasculares importantes, em comparação com o placebo.[103]Wise RA, Chapman KR, Scirica BM, et al. Effect of aclidinium bromide on major cardiovascular events and exacerbations in high-risk patients with chronic obstructive pulmonary disease: the ASCENT-COPD randomized clinical trial. JAMA. 2019 May 7;321(17):1693-701.
https://jamanetwork.com/journals/jama/fullarticle/2732574
http://www.ncbi.nlm.nih.gov/pubmed/31063575?tool=bestpractice.com
Um estudo de coorte de base populacional constatou que homens mais velhos com DPOC recém-iniciados no uso de LAMAs têm maior risco de infecções do trato urinário.[104]Gershon AS, Newman AM, Fischer HD, et al. Inhaled long-acting anticholinergics and urinary tract infection in individuals with COPD. COPD. 2017 Feb;14(1):105-12.
http://www.ncbi.nlm.nih.gov/pubmed/27732117?tool=bestpractice.com
BALDs e LAMAs melhoram significativamente a função pulmonar, a dispneia e o estado de saúde e reduzem as exacerbações.
[  ]
How does umeclidinium bromide compare with placebo for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1829/fullMostre-me a resposta[Evidência A]81c5e462-8f36-4687-93b0-cd4b9989ab2accaAQuais as diferenças entre o umeclidínio e placebo para indivíduos com doença pulmonar obstrutiva crônica (DPOC)? Nos casos de DPOC estável, se a decisão tomada for o uso de monoterapia, os agentes LAMA podem ser superiores aos agentes BALD.[105]Rabe KF, Timmer W, Sagkriotis A, et al. Comparison of a combination of tiotropium plus formoterol to salmeterol plus fluticasone in moderate COPD. Chest. 2008 Aug;134(2):255-62.
http://www.ncbi.nlm.nih.gov/pubmed/18403672?tool=bestpractice.com
Os LAMAs têm maior efeito na redução das exacerbações do que os BALDs em pacientes com DPOC moderada a muito grave.[106]Vogelmeier C, Hederer B, Glaab T, et al; POET-COPD Investigators. Tiotropium versus salmeterol for the prevention of exacerbations of COPD. N Engl J Med. 2011 Mar 24;364(12):1093-103.
https://www.nejm.org/doi/full/10.1056/NEJMoa1008378
http://www.ncbi.nlm.nih.gov/pubmed/21428765?tool=bestpractice.com
[107]Decramer ML, Chapman KR, Dahl R, et al; INVIGORATE investigators. Once-daily indacaterol versus tiotropium for patients with severe chronic obstructive pulmonary disease (INVIGORATE): a randomised, blinded, parallel-group study. Lancet Respir Med. 2013 Sep;1(7):524-33.
http://www.ncbi.nlm.nih.gov/pubmed/24461613?tool=bestpractice.com
A segurança em longo prazo dos LAMAs foi demonstrada no ensaio clínico UPLIFT.[108]Celli B, Decramer M, Kesten S, et al. UPLIFT Study Investigators. Mortality in the 4-year trial of tiotropium (UPLIFT) in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2009 Nov 15;180(10):948-55.
https://www.atsjournals.org/doi/full/10.1164/rccm.200906-0876OC
http://www.ncbi.nlm.nih.gov/pubmed/19729663?tool=bestpractice.com
]
How does umeclidinium bromide compare with placebo for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1829/fullMostre-me a resposta[Evidência A]81c5e462-8f36-4687-93b0-cd4b9989ab2accaAQuais as diferenças entre o umeclidínio e placebo para indivíduos com doença pulmonar obstrutiva crônica (DPOC)? Nos casos de DPOC estável, se a decisão tomada for o uso de monoterapia, os agentes LAMA podem ser superiores aos agentes BALD.[105]Rabe KF, Timmer W, Sagkriotis A, et al. Comparison of a combination of tiotropium plus formoterol to salmeterol plus fluticasone in moderate COPD. Chest. 2008 Aug;134(2):255-62.
http://www.ncbi.nlm.nih.gov/pubmed/18403672?tool=bestpractice.com
Os LAMAs têm maior efeito na redução das exacerbações do que os BALDs em pacientes com DPOC moderada a muito grave.[106]Vogelmeier C, Hederer B, Glaab T, et al; POET-COPD Investigators. Tiotropium versus salmeterol for the prevention of exacerbations of COPD. N Engl J Med. 2011 Mar 24;364(12):1093-103.
https://www.nejm.org/doi/full/10.1056/NEJMoa1008378
http://www.ncbi.nlm.nih.gov/pubmed/21428765?tool=bestpractice.com
[107]Decramer ML, Chapman KR, Dahl R, et al; INVIGORATE investigators. Once-daily indacaterol versus tiotropium for patients with severe chronic obstructive pulmonary disease (INVIGORATE): a randomised, blinded, parallel-group study. Lancet Respir Med. 2013 Sep;1(7):524-33.
http://www.ncbi.nlm.nih.gov/pubmed/24461613?tool=bestpractice.com
A segurança em longo prazo dos LAMAs foi demonstrada no ensaio clínico UPLIFT.[108]Celli B, Decramer M, Kesten S, et al. UPLIFT Study Investigators. Mortality in the 4-year trial of tiotropium (UPLIFT) in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2009 Nov 15;180(10):948-55.
https://www.atsjournals.org/doi/full/10.1164/rccm.200906-0876OC
http://www.ncbi.nlm.nih.gov/pubmed/19729663?tool=bestpractice.com
A combinação BALD/LAMA pode fornecer um melhor efeito terapêutico sem aumentar os efeitos adversos de cada classe.[105]Rabe KF, Timmer W, Sagkriotis A, et al. Comparison of a combination of tiotropium plus formoterol to salmeterol plus fluticasone in moderate COPD. Chest. 2008 Aug;134(2):255-62.
http://www.ncbi.nlm.nih.gov/pubmed/18403672?tool=bestpractice.com
[109]Tashkin DP, Littner M, Andrews CP, et al. Concomitant treatment with nebulized formoterol and tiotropium in subjects with COPD: a placebo-controlled trial. Respir Med. 2008 Apr;102(4):479-87.
http://www.ncbi.nlm.nih.gov/pubmed/18258423?tool=bestpractice.com
[110]Tashkin DP, Pearle J, Iezzoni D, et al. Formoterol and tiotropium compared with tiotropium alone for treatment of COPD. COPD. 2009 Feb;6(1):17-25.
http://www.ncbi.nlm.nih.gov/pubmed/19229704?tool=bestpractice.com
[111]Vogelmeier C, Kardos P, Harari S, et al. Formoterol mono- and combination therapy with tiotropium in patients with COPD: a 6-month study. Respir Med. 2008 Nov;102(11):1511-20.
http://www.ncbi.nlm.nih.gov/pubmed/18804362?tool=bestpractice.com
[112]Maltais F, Bjermer L, Kerwin EM, et al. Efficacy of umeclidinium/vilanterol versus umeclidinium and salmeterol monotherapies in symptomatic patients with COPD not receiving inhaled corticosteroids: the EMAX randomised trial. Respir Res. 2019 Oct 30;20(1):238.
https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1193-9
http://www.ncbi.nlm.nih.gov/pubmed/31666084?tool=bestpractice.com
O umeclidínio/vilanterol, o glicopirrônio/formoterol, o tiotrópio/olodaterol e o aclidínio/formoterol estão aprovados para uso na DPOC. Revisões sistemáticas e metanálises constataram que a terapia combinada com BALD/LAMA:
reduz as exacerbações em comparação com a monoterapia
está associada a uma melhora clinicamente significativa na função pulmonar e na qualidade de vida relacionada à saúde nos pacientes com DPOC leve/moderada, em comparação com placebo[113]Maqsood U, Ho TN, Palmer K, et al. Once daily long-acting beta2-agonists and long-acting muscarinic antagonists in a combined inhaler versus placebo for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 Mar 6;(3):CD012930.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012930.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/30839102?tool=bestpractice.com
[  ]
How does a combined inhaler with once‐daily long‐acting beta2‐agonist (LABA) plus a long‐acting muscarinic antagonist (LAMA) compare with placebo for adults with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2551/fullMostre-me a resposta
]
How does a combined inhaler with once‐daily long‐acting beta2‐agonist (LABA) plus a long‐acting muscarinic antagonist (LAMA) compare with placebo for adults with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2551/fullMostre-me a resposta
melhora o VEF₁ e reduz ligeiramente o risco de pneumonia nos pacientes com doença pulmonar obstrutiva crônica estável, mas aumenta as chances de morte por todas as causas de 1% para 1.4%.[114]Fukuda N, Horita N, Kaneko A, et al. Long-acting muscarinic antagonist (LAMA) plus long-acting beta-agonist (LABA) versus LABA plus inhaled corticosteroid (ICS) for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Jun 5;6(6):CD012066.
https://www.doi.org/10.1002/14651858.CD012066.pub3
http://www.ncbi.nlm.nih.gov/pubmed/37276335?tool=bestpractice.com
[  ]
How does long‐acting muscarinic antagonist (LAMA) plus long‐acting beta‐agonist (LABA) compare with LABA plus inhaled corticosteroid (ICS) for people with stable chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4356/fullMostre-me a resposta
]
How does long‐acting muscarinic antagonist (LAMA) plus long‐acting beta‐agonist (LABA) compare with LABA plus inhaled corticosteroid (ICS) for people with stable chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4356/fullMostre-me a resposta
A combinação umeclidínio/vilanterol diminui o risco de exacerbações em pacientes com DPOC leve/moderada.[113]Maqsood U, Ho TN, Palmer K, et al. Once daily long-acting beta2-agonists and long-acting muscarinic antagonists in a combined inhaler versus placebo for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 Mar 6;(3):CD012930.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012930.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/30839102?tool=bestpractice.com
[  ]
How does a combined inhaler with once‐daily long‐acting beta2‐agonist (LABA) plus a long‐acting muscarinic antagonist (LAMA) compare with placebo for adults with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2551/fullMostre-me a resposta Uma revisão sistemática e metanálise em rede constatou que todas as combinações com doses fixas de BALD/LAMA tiveram eficácia e segurança semelhantes.[115]Schlueter M, Gonzalez-Rojas N, Baldwin M, et al. Comparative efficacy of fixed-dose combinations of long-acting muscarinic antagonists and long-acting beta2-agonists: a systematic review and network meta-analysis. Ther Adv Respir Dis. 2016 Apr;10(2):89-104.
https://journals.sagepub.com/doi/10.1177/1753465815624612
http://www.ncbi.nlm.nih.gov/pubmed/26746383?tool=bestpractice.com
]
How does a combined inhaler with once‐daily long‐acting beta2‐agonist (LABA) plus a long‐acting muscarinic antagonist (LAMA) compare with placebo for adults with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2551/fullMostre-me a resposta Uma revisão sistemática e metanálise em rede constatou que todas as combinações com doses fixas de BALD/LAMA tiveram eficácia e segurança semelhantes.[115]Schlueter M, Gonzalez-Rojas N, Baldwin M, et al. Comparative efficacy of fixed-dose combinations of long-acting muscarinic antagonists and long-acting beta2-agonists: a systematic review and network meta-analysis. Ther Adv Respir Dis. 2016 Apr;10(2):89-104.
https://journals.sagepub.com/doi/10.1177/1753465815624612
http://www.ncbi.nlm.nih.gov/pubmed/26746383?tool=bestpractice.com
Conforme descrito acima, a GOLD faz recomendações para o agente inicial com base no grupo de risco do paciente (A, B ou E).[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
As diretrizes da American Thoracic Society recomendam iniciar a terapia dupla com BALD/LAMA em preferência à monoterapia em pacientes com DPOC com dispneia ou intolerância ao exercício.[96]Nici L, Mammen MJ, Charbek E, et al. Pharmacologic management of chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 May 1;201(9):e56-69.
https://www.atsjournals.org/doi/10.1164/rccm.202003-0625ST
http://www.ncbi.nlm.nih.gov/pubmed/32283960?tool=bestpractice.com
As diretrizes do Reino Unido recomendam iniciar a terapia dupla com um BALD/LAMA ou BALD/CI se o paciente apresentar sintomas ou exacerbações apesar de tratamento não farmacológico, e usar um broncodilatador de ação curta, se necessário. A escolha do regime medicamentoso inicial nas orientações do Reino Unido baseia-se na existência ou não de características de asma no paciente, ou características que sugiram responsividade a corticosteroides.[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].
https://www.nice.org.uk/guidance/ng115
Corticosteroides inalatórios (CI)
Quando indicados para os pacientes com DPOC, os CIs devem sempre ser prescritos em combinação com broncodilatadores de ação prolongada. Acredita-se que os corticosteroides inalatórios (CIs) são eficazes devido aos seus efeitos anti-inflamatórios. O uso de corticosteroides inalatórios (CIs) em longo prazo reduz a necessidade de terapias de resgate e reduz as exacerbações, além de diminuír a mortalidade.[116]Spencer S, Calverley PM, Burge PS, et al. Impact of preventing exacerbations on deterioration of health status in COPD. Eur Respir J. 2004 May;23(5):698-702.
https://erj.ersjournals.com/content/23/5/698
http://www.ncbi.nlm.nih.gov/pubmed/15176682?tool=bestpractice.com
[117]Sin DD, Wu L, Anderson JA, et al. Inhaled corticosteroids and mortality in chronic obstructive pulmonary disease. Thorax. 2005 Dec;60(12):992-7.
http://www.ncbi.nlm.nih.gov/pubmed/16227327?tool=bestpractice.com
[118]Lee HW, Park J, Jo J, et al. Comparisons of exacerbations and mortality among regular inhaled therapies for patients with stable chronic obstructive pulmonary disease: systematic review and Bayesian network meta-analysis. PLoS Med. 2019 Nov;16(11):e1002958.
https://journals.plos.org/plosmedicine/article?id=10.1371/journal.pmed.1002958
http://www.ncbi.nlm.nih.gov/pubmed/31730642?tool=bestpractice.com
O efeito dos esquemas de tratamento que contêm CI é mais elevado nos pacientes com maior risco de exacerbações (duas ou mais exacerbações e/ou uma hospitalização por exacerbação no ano anterior).[90]Papi A, Vestbo J, Fabbri L, et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): a double-blind, parallel group, randomised controlled trial. Lancet. 2018 Mar 17;391(10125):1076-84.
http://www.ncbi.nlm.nih.gov/pubmed/29429593?tool=bestpractice.com
[92]Lipson DA, Barnhart F, Brealey N, et al. Once-daily single-inhaler triple versus dual therapy in patients with COPD. N Engl J Med. 2018 May 3;378(18):1671-80.
https://www.nejm.org/doi/10.1056/NEJMoa1713901
http://www.ncbi.nlm.nih.gov/pubmed/29668352?tool=bestpractice.com
[119]Wedzicha JA, Banerji D, Chapman KR, et al; FLAME Investigators. Indacaterol-glycopyrronium versus salmeterol-fluticasone for COPD. N Engl J Med. 2016 Jun 9;374(23):2222-34.
https://www.nejm.org/doi/10.1056/NEJMoa1516385
http://www.ncbi.nlm.nih.gov/pubmed/27181606?tool=bestpractice.com
A contagem de eosinófilos no sangue pode prever a eficácia da adição de CIs ao tratamento regular com broncodilatadores de ação prolongada para prevenir exacerbações.[77]Harries TH, Rowland V, Corrigan CJ, et al. Blood eosinophil count, a marker of inhaled corticosteroid effectiveness in preventing COPD exacerbations in post-hoc RCT and observational studies: systematic review and meta-analysis. Respir Res. 2020 Jan 3;21(1):3.
https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1268-7
http://www.ncbi.nlm.nih.gov/pubmed/31900184?tool=bestpractice.com
[78]Oshagbemi OA, Odiba JO, Daniel A, et al. Absolute blood eosinophil counts to guide inhaled corticosteroids therapy among patients with COPD: systematic review and meta-analysis. Curr Drug Targets. 2019;20(16):1670-9.
http://www.ncbi.nlm.nih.gov/pubmed/31393244?tool=bestpractice.com
[79]Pascoe S, Barnes N, Brusselle G, et al. Blood eosinophils and treatment response with triple and dual combination therapy in chronic obstructive pulmonary disease: analysis of the IMPACT trial. Lancet Respir Med. 2019 Sep;7(9):745-56.
http://www.ncbi.nlm.nih.gov/pubmed/31281061?tool=bestpractice.com
Pouco ou nenhum efeito é observado nas contagens de eosinófilos <100 células/microlitro, enquanto o efeito máximo é observado nas contagens de eosinófilos >300 células/microlitro.[76]Bafadhel M, Peterson S, De Blas MA, et al. Predictors of exacerbation risk and response to budesonide in patients with chronic obstructive pulmonary disease: a post-hoc analysis of three randomised trials. Lancet Respir Med. 2018 Feb;6(2):117-26.
http://www.ncbi.nlm.nih.gov/pubmed/29331313?tool=bestpractice.com
[80]Cazzola M, Rogliani P, Calzetta L, et al. Triple therapy versus single and dual long-acting bronchodilator therapy in COPD: a systematic review and meta-analysis. Eur Respir J. 2018 Dec 13;52(6):1801586.
https://erj.ersjournals.com/content/52/6/1801586
http://www.ncbi.nlm.nih.gov/pubmed/30309975?tool=bestpractice.com
Estes limiares indicam valores de corte aproximados que podem ajudar os médicos a predizerem a probabilidade de benefício com o tratamento.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Ex-fumantes respondem melhor a corticosteroides do que fumantes atuais com qualquer contagem de eosinófilos.[79]Pascoe S, Barnes N, Brusselle G, et al. Blood eosinophils and treatment response with triple and dual combination therapy in chronic obstructive pulmonary disease: analysis of the IMPACT trial. Lancet Respir Med. 2019 Sep;7(9):745-56.
http://www.ncbi.nlm.nih.gov/pubmed/31281061?tool=bestpractice.com
Tanto fumantes atuais como ex-fumantes com DPOC podem se beneficiar dos CI em termos de função pulmonar e taxas de exacerbação, embora o efeito seja melhor para os fumantes atuais ou compulsivos, comparados com ex-fumantes ou fumantes leves.[92]Lipson DA, Barnhart F, Brealey N, et al. Once-daily single-inhaler triple versus dual therapy in patients with COPD. N Engl J Med. 2018 May 3;378(18):1671-80.
https://www.nejm.org/doi/10.1056/NEJMoa1713901
http://www.ncbi.nlm.nih.gov/pubmed/29668352?tool=bestpractice.com
[120]Sonnex K, Alleemudder H, Knaggs R. Impact of smoking status on the efficacy of inhaled corticosteroids in chronic obstructive pulmonary disease: a systematic review. BMJ Open. 2020 Apr 15;10(4):e037509.
https://bmjopen.bmj.com/content/10/4/e037509
http://www.ncbi.nlm.nih.gov/pubmed/32300001?tool=bestpractice.com
O uso de CIs em curto prazo (≤1 ano) pode estar associado com mais melhoras no VEF₁ que o uso em longo prazo, embora sejam necessários estudos adicionais para entender melhor o efeito do tratamento sobre a função pulmonar.[121]Whittaker HR, Jarvis D, Sheikh MR, et al. Inhaled corticosteroids and FEV1 decline in chronic obstructive pulmonary disease: a systematic review. Respir Res. 2019 Dec 4;20(1):277.
https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1249-x
http://www.ncbi.nlm.nih.gov/pubmed/31801539?tool=bestpractice.com
Diversos estudos apontaram um aumento do risco de pneumonia em pacientes com DPOC que fazem uso de CIs.[85]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com
[  ]
What are the benefits and harms of inhaled corticosteroids (ICS) in people with stable chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4293/fullMostre-me a resposta Esse risco é superior para a fluticasona em comparação com a budesonida.[122]Suissa S, Patenaude V, Lapi F, et al. Inhaled corticosteroids in COPD and the risk of serious pneumonia. Thorax. 2013 Nov;68(11):1029-36.
https://thorax.bmj.com/content/68/11/1029.long
http://www.ncbi.nlm.nih.gov/pubmed/24130228?tool=bestpractice.com
[123]Lodise TP, Li J, Gandhi HN, et al. Intraclass difference in pneumonia risk with fluticasone and budesonide in COPD: a systematic review of evidence from direct-comparison studies. Int J Chron Obstruct Pulmon Dis. 2020 Nov 11;15:2889-900.
https://www.dovepress.com/intraclass-difference-in-pneumonia-risk-with-fluticasone-and-budesonid-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/33204085?tool=bestpractice.com
[124]Yang M, Du Y, Chen H, et al. Inhaled corticosteroids and risk of pneumonia in patients with chronic obstructive pulmonary disease: a meta-analysis of randomized controlled trials. Int Immunopharmacol. 2019 Dec;77:105950.
http://www.ncbi.nlm.nih.gov/pubmed/31629940?tool=bestpractice.com
Um estudo em uma grande coorte de pacientes dinamarqueses revelou que o risco de adquirir Pseudomonas aeruginosa, uma causa comum de pneumonia hospitalar, é dose-dependente, com os CIs em altas doses associados ao maior risco. O estudo também revelou que os pacientes com P aeruginosa tiveram maior probabilidade de terem um IMC e um VEF₁ mais baixos que os pacientes negativos para P aeruginosa.[125]Eklöf J, Ingebrigtsen TS, Sørensen R, et al. Use of inhaled corticosteroids and risk of acquiring Pseudomonas aeruginosa in patients with chronic obstructive pulmonary disease. Thorax. 2022 Jun;77(6):573-80.
https://thorax.bmj.com/content/77/6/573
http://www.ncbi.nlm.nih.gov/pubmed/34446524?tool=bestpractice.com
Uma revisão sistemática e metanálise constatou que, apesar de um aumento significativo do risco não ajustado de pneumonia associada ao uso de CIs, as fatalidades por pneumonia e a mortalidade geral não aumentaram nos ensaios clínicos randomizados e controlados, e foram reduzidas nos estudos observacionais.[126]Festic E, Bansal V, Gupta E, et al. Association of inhaled corticosteroids with incident pneumonia and mortality in COPD patients; systematic review and meta-analysis. COPD. 2016 Jun;13(3):312-26.
https://www.tandfonline.com/doi/full/10.3109/15412555.2015.1081162
http://www.ncbi.nlm.nih.gov/pubmed/26645797?tool=bestpractice.com
Portanto, deve-se implementar uma abordagem de tratamento individualizado que avalie o risco de um paciente ter pneumonia em relação ao benefício da diminuição das exacerbações.[85]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com
[127]Welte T. Inhaled corticosteroids in COPD and the risk of pneumonia. Lancet. 2009 Aug 29;374(9691):668-70.
http://www.ncbi.nlm.nih.gov/pubmed/19716946?tool=bestpractice.com
[128]Kew KM, Seniukovich A. Inhaled steroids and risk of pneumonia for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2014 Mar 10;(3):CD010115.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010115.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/24615270?tool=bestpractice.com
Há, também, dúvidas com relação ao aumento dos riscos de tuberculose e gripe (influenza) em pacientes adultos com DPOC que estejam utilizando corticoterapia inalatória, embora uma metanálise tenha constatado que menos de 1% de todos os casos de tuberculose avaliados podiam ser atribuídos a exposição a CIs.[129]Dong YH, Chang CH, Lin Wu FL, et al. Use of inhaled corticosteroids in patients with COPD and the risk of TB and influenza: a systematic review and meta-analysis of randomized controlled trials. Chest. 2014 Jun;145(6):1286-97.
http://www.ncbi.nlm.nih.gov/pubmed/24504044?tool=bestpractice.com
[130]Castellana G, Castellana M, Castellana C, et al. Inhaled corticosteroids and risk of tuberculosis in patients with obstructive lung diseases: a systematic review and meta-analysis of non-randomized studies. Int J Chron Obstruct Pulmon Dis. 2019 Sep 26;14:2219-27.
https://www.dovepress.com/inhaled-corticosteroids-and-risk-of-tuberculosis-in-patients-with-obst-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/31576118?tool=bestpractice.com
Os CIs podem também causar candidíase orofaríngea e rouquidão.[85]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com
[
]
What are the benefits and harms of inhaled corticosteroids (ICS) in people with stable chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4293/fullMostre-me a resposta Esse risco é superior para a fluticasona em comparação com a budesonida.[122]Suissa S, Patenaude V, Lapi F, et al. Inhaled corticosteroids in COPD and the risk of serious pneumonia. Thorax. 2013 Nov;68(11):1029-36.
https://thorax.bmj.com/content/68/11/1029.long
http://www.ncbi.nlm.nih.gov/pubmed/24130228?tool=bestpractice.com
[123]Lodise TP, Li J, Gandhi HN, et al. Intraclass difference in pneumonia risk with fluticasone and budesonide in COPD: a systematic review of evidence from direct-comparison studies. Int J Chron Obstruct Pulmon Dis. 2020 Nov 11;15:2889-900.
https://www.dovepress.com/intraclass-difference-in-pneumonia-risk-with-fluticasone-and-budesonid-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/33204085?tool=bestpractice.com
[124]Yang M, Du Y, Chen H, et al. Inhaled corticosteroids and risk of pneumonia in patients with chronic obstructive pulmonary disease: a meta-analysis of randomized controlled trials. Int Immunopharmacol. 2019 Dec;77:105950.
http://www.ncbi.nlm.nih.gov/pubmed/31629940?tool=bestpractice.com
Um estudo em uma grande coorte de pacientes dinamarqueses revelou que o risco de adquirir Pseudomonas aeruginosa, uma causa comum de pneumonia hospitalar, é dose-dependente, com os CIs em altas doses associados ao maior risco. O estudo também revelou que os pacientes com P aeruginosa tiveram maior probabilidade de terem um IMC e um VEF₁ mais baixos que os pacientes negativos para P aeruginosa.[125]Eklöf J, Ingebrigtsen TS, Sørensen R, et al. Use of inhaled corticosteroids and risk of acquiring Pseudomonas aeruginosa in patients with chronic obstructive pulmonary disease. Thorax. 2022 Jun;77(6):573-80.
https://thorax.bmj.com/content/77/6/573
http://www.ncbi.nlm.nih.gov/pubmed/34446524?tool=bestpractice.com
Uma revisão sistemática e metanálise constatou que, apesar de um aumento significativo do risco não ajustado de pneumonia associada ao uso de CIs, as fatalidades por pneumonia e a mortalidade geral não aumentaram nos ensaios clínicos randomizados e controlados, e foram reduzidas nos estudos observacionais.[126]Festic E, Bansal V, Gupta E, et al. Association of inhaled corticosteroids with incident pneumonia and mortality in COPD patients; systematic review and meta-analysis. COPD. 2016 Jun;13(3):312-26.
https://www.tandfonline.com/doi/full/10.3109/15412555.2015.1081162
http://www.ncbi.nlm.nih.gov/pubmed/26645797?tool=bestpractice.com
Portanto, deve-se implementar uma abordagem de tratamento individualizado que avalie o risco de um paciente ter pneumonia em relação ao benefício da diminuição das exacerbações.[85]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com
[127]Welte T. Inhaled corticosteroids in COPD and the risk of pneumonia. Lancet. 2009 Aug 29;374(9691):668-70.
http://www.ncbi.nlm.nih.gov/pubmed/19716946?tool=bestpractice.com
[128]Kew KM, Seniukovich A. Inhaled steroids and risk of pneumonia for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2014 Mar 10;(3):CD010115.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010115.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/24615270?tool=bestpractice.com
Há, também, dúvidas com relação ao aumento dos riscos de tuberculose e gripe (influenza) em pacientes adultos com DPOC que estejam utilizando corticoterapia inalatória, embora uma metanálise tenha constatado que menos de 1% de todos os casos de tuberculose avaliados podiam ser atribuídos a exposição a CIs.[129]Dong YH, Chang CH, Lin Wu FL, et al. Use of inhaled corticosteroids in patients with COPD and the risk of TB and influenza: a systematic review and meta-analysis of randomized controlled trials. Chest. 2014 Jun;145(6):1286-97.
http://www.ncbi.nlm.nih.gov/pubmed/24504044?tool=bestpractice.com
[130]Castellana G, Castellana M, Castellana C, et al. Inhaled corticosteroids and risk of tuberculosis in patients with obstructive lung diseases: a systematic review and meta-analysis of non-randomized studies. Int J Chron Obstruct Pulmon Dis. 2019 Sep 26;14:2219-27.
https://www.dovepress.com/inhaled-corticosteroids-and-risk-of-tuberculosis-in-patients-with-obst-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/31576118?tool=bestpractice.com
Os CIs podem também causar candidíase orofaríngea e rouquidão.[85]Yang IA, Ferry OR, Clarke MS, et al. Inhaled corticosteroids versus placebo for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2023 Mar 27;(3):CD002991.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002991.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/36971693?tool=bestpractice.com
[  ]
What are the benefits and harms of inhaled corticosteroids (ICS) in people with stable chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4293/fullMostre-me a resposta
]
What are the benefits and harms of inhaled corticosteroids (ICS) in people with stable chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4293/fullMostre-me a resposta
Embora haja relatos de que o uso dos CIs tanto aumenta quanto reduz o risco de câncer pulmonar, os dados disponíveis não parecem apoiar qualquer conclusão; são necessários estudos adicionais.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Os médicos devem ponderar os possíveis benefícios e riscos da prescrição de CIs e discuti-los com o paciente.[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].
https://www.nice.org.uk/guidance/ng115
Uma história de hospitalização devidas a exacerbações de DPOC, duas ou mais exacerbações moderadas por ano apesar de broncodilatadores de ação prolongada regulares, eosinófilos sanguíneos ≥300 células/microlitro e/ou asma prévia ou concomitante favorecem fortemente que se inicie um CI.[131]Agusti A, Fabbri LM, Singh D, et al. Inhaled corticosteroids in COPD: friend or foe? Eur Respir J. 2018 Dec 13;52(6):1801219.
https://erj.ersjournals.com/content/52/6/1801219
http://www.ncbi.nlm.nih.gov/pubmed/30190269?tool=bestpractice.com
Repetidos e episódios de pneumonia, eosinófilos no sangue <100 células/microlitro e/ou história de infecção por micobactérias são fatores contra o uso de CI.[131]Agusti A, Fabbri LM, Singh D, et al. Inhaled corticosteroids in COPD: friend or foe? Eur Respir J. 2018 Dec 13;52(6):1801219.
https://erj.ersjournals.com/content/52/6/1801219
http://www.ncbi.nlm.nih.gov/pubmed/30190269?tool=bestpractice.com
O uso de CI pode ser considerado nos pacientes com uma exacerbação moderada de DPOC por ano, apesar de terapia broncodilatadora de ação prolongada regular e/ou eosinófilos periféricos de 100-300 células/microlitro.[131]Agusti A, Fabbri LM, Singh D, et al. Inhaled corticosteroids in COPD: friend or foe? Eur Respir J. 2018 Dec 13;52(6):1801219.
https://erj.ersjournals.com/content/52/6/1801219
http://www.ncbi.nlm.nih.gov/pubmed/30190269?tool=bestpractice.com
A European Respiratory Society emitiu diretrizes sobre a supressão de corticosteroides inalatórios na DPOC.[132]Chalmers JD, Laska IF, Franssen FME, et al. Withdrawal of inhaled corticosteroids in COPD: a European Respiratory Society guideline. Eur Respir J. 2020 Jun 4;55(6):2000351.
https://erj.ersjournals.com/content/55/6/2000351
http://www.ncbi.nlm.nih.gov/pubmed/32366483?tool=bestpractice.com
O uso prolongado de corticosteroides orais na DPOC não é recomendado.[96]Nici L, Mammen MJ, Charbek E, et al. Pharmacologic management of chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 May 1;201(9):e56-69.
https://www.atsjournals.org/doi/10.1164/rccm.202003-0625ST
http://www.ncbi.nlm.nih.gov/pubmed/32283960?tool=bestpractice.com
Alguns pacientes com doença grave não podem interromper completamente o tratamento depois de iniciarem o uso de corticosteroides orais para uma exacerbação aguda. Neste caso, a dose deve ser mantida a mais baixa possível, com atenção à profilaxia da osteoporose.[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].
https://www.nice.org.uk/guidance/ng115
Preparações combinadas de broncodilatadores e corticosteroides
Uma preparação combinada de broncodilatador de ação prolongada e CIs pode ser usada para os pacientes que requerem ambos os agentes.
[  ]
What are the effects of long‐acting inhaled therapies for adults with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2364/fullMostre-me a resposta Trata-se de uma alternativa conveniente que pode auxiliar na adesão terapêutica de alguns pacientes. A escolha da terapia desta classe baseia-se na disponibilidade, resposta e preferência individuais.[133]Tricco AC, Strifler L, Veroniki AA, et al. Comparative safety and effectiveness of long-acting inhaled agents for treating chronic obstructive pulmonary disease: a systematic review and network meta-analysis. BMJ Open. 2015 Oct 26;5(10):e009183. [Erratum in: BMJ Open. 2019 May 1;9(4):e009183corr1.]
https://bmjopen.bmj.com/content/5/10/e009183.long
http://www.ncbi.nlm.nih.gov/pubmed/26503392?tool=bestpractice.com
A combinação pode ser fornecida em inaladores separados ou um inalador combinado.
]
What are the effects of long‐acting inhaled therapies for adults with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2364/fullMostre-me a resposta Trata-se de uma alternativa conveniente que pode auxiliar na adesão terapêutica de alguns pacientes. A escolha da terapia desta classe baseia-se na disponibilidade, resposta e preferência individuais.[133]Tricco AC, Strifler L, Veroniki AA, et al. Comparative safety and effectiveness of long-acting inhaled agents for treating chronic obstructive pulmonary disease: a systematic review and network meta-analysis. BMJ Open. 2015 Oct 26;5(10):e009183. [Erratum in: BMJ Open. 2019 May 1;9(4):e009183corr1.]
https://bmjopen.bmj.com/content/5/10/e009183.long
http://www.ncbi.nlm.nih.gov/pubmed/26503392?tool=bestpractice.com
A combinação pode ser fornecida em inaladores separados ou um inalador combinado.
Vários estudos respaldam a terapia tríplice com BALDs/LAMAs/CIs como sendo superior à terapia com um ou dois agentes, com BALD/LAMA ou LABA/CI, em relação à taxa de exacerbações moderadas a graves da DPOC e à taxa de hospitalização.[80]Cazzola M, Rogliani P, Calzetta L, et al. Triple therapy versus single and dual long-acting bronchodilator therapy in COPD: a systematic review and meta-analysis. Eur Respir J. 2018 Dec 13;52(6):1801586.
https://erj.ersjournals.com/content/52/6/1801586
http://www.ncbi.nlm.nih.gov/pubmed/30309975?tool=bestpractice.com
[88]Singh D, Papi A, Corradi M, et al. Single inhaler triple therapy versus inhaled corticosteroid plus long-acting beta2-agonist therapy for chronic obstructive pulmonary disease (TRILOGY): a double-blind, parallel group, randomised controlled trial. Lancet. 2016 Sep 3;388(10048):963-73.
http://www.ncbi.nlm.nih.gov/pubmed/27598678?tool=bestpractice.com
[89]Vestbo J, Papi A, Corradi M, et al. Single inhaler extrafine triple therapy versus long-acting muscarinic antagonist therapy for chronic obstructive pulmonary disease (TRINITY): a double-blind, parallel group, randomised controlled trial. Lancet. 2017 May 13;389(10082):1919-29.
http://www.ncbi.nlm.nih.gov/pubmed/28385353?tool=bestpractice.com
[90]Papi A, Vestbo J, Fabbri L, et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): a double-blind, parallel group, randomised controlled trial. Lancet. 2018 Mar 17;391(10125):1076-84.
http://www.ncbi.nlm.nih.gov/pubmed/29429593?tool=bestpractice.com
[91]Lipson DA, Barnacle H, Birk R, et al. FULFIL Trial: once-daily triple therapy for patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2017 Aug 15;196(4):438-46.
https://www.atsjournals.org/doi/full/10.1164/rccm.201703-0449OC
http://www.ncbi.nlm.nih.gov/pubmed/28375647?tool=bestpractice.com
[92]Lipson DA, Barnhart F, Brealey N, et al. Once-daily single-inhaler triple versus dual therapy in patients with COPD. N Engl J Med. 2018 May 3;378(18):1671-80.
https://www.nejm.org/doi/10.1056/NEJMoa1713901
http://www.ncbi.nlm.nih.gov/pubmed/29668352?tool=bestpractice.com
[93]Rojas-Reyes MX, García Morales OM, Dennis RJ, et al. Combination inhaled steroid and long-acting beta₂-agonist in addition to tiotropium versus tiotropium or combination alone for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2016 Jun 6;(6):CD008532.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD008532.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27271056?tool=bestpractice.com
[94]Lai CC, Chen CH, Lin CYH, et al. The effects of single inhaler triple therapy vs single inhaler dual therapy or separate triple therapy for the management of chronic obstructive pulmonary disease: a systematic review and meta-analysis of randomized controlled trials. Int J Chron Obstruct Pulmon Dis. 2019 Jul 11;14:1539-48. [Erratum in: Int J Chron Obstruct Pulmon Dis. 2020 Jan 21;15:155-6.]
https://www.dovepress.com/the-effects-of-single-inhaler-triple-therapy-vs-single-inhaler-dual-th-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/31371939?tool=bestpractice.com
[95]Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med. 2020 Jul 2;383(1):35-48.
http://www.ncbi.nlm.nih.gov/pubmed/32579807?tool=bestpractice.com
O uso de CIs também reduz a taxa de queda da função pulmonar após as exacerbações nos pacientes com DPOC leve a moderada e eosinófilos sanguíneos elevados.[134]Kerkhof M, Voorham J, Dorinsky P, et al. Association between COPD exacerbations and lung function decline during maintenance therapy. Thorax. 2020 Sep;75(9):744-53.
https://thorax.bmj.com/content/75/9/744
http://www.ncbi.nlm.nih.gov/pubmed/32532852?tool=bestpractice.com
Um ensaio clínico randomizado e controlado relatou redução na mortalidade por todas as causas nos pacientes com VEF₁ <50% e pelo menos uma exacerbação no último ano nos que tomaram furoato de fluticasona/umeclidínio/vilanterol, em comparação com pacientes que tomaram umeclidínio/vilanterol. Os pacientes com DPOC leve e pelo menos duas exacerbações moderadas ou uma grave no último ano também tiveram redução na mortalidade por todas as causas ao tomarem furoato de fluticasona/umeclidínio/vilanterol, em comparação com umeclidínio/vilanterol.[135]Lipson DA, Crim C, Criner GJ, et al. Reduction in all-cause mortality with fluticasone furoate/umeclidinium/vilanterol in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2020 Jun 15;201(12):1508-16.
https://www.atsjournals.org/doi/10.1164/rccm.201911-2207OC
http://www.ncbi.nlm.nih.gov/pubmed/32162970?tool=bestpractice.com
Outro ensaio clínico randomizado controlado apresentou achados similares em termos de mortalidade no braço de terapia tripla (budesonida/glicopirrônio/formoterol), mas apenas com a dose mais alta de CI.[95]Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med. 2020 Jul 2;383(1):35-48.
http://www.ncbi.nlm.nih.gov/pubmed/32579807?tool=bestpractice.com
[136]Martinez FJ, Rabe KF, Ferguson GT, et al. Reduced all-cause mortality in the ETHOS trial of budesonide/glycopyrrolate/formoterol for chronic obstructive pulmonary disease. A randomized, double-blind, multicenter, parallel-group study. Am J Respir Crit Care Med. 2021 Mar 1;203(5):553-64.
https://www.atsjournals.org/doi/10.1164/rccm.202006-2618OC
http://www.ncbi.nlm.nih.gov/pubmed/33252985?tool=bestpractice.com
O mesmo estudo mostrou que aumentar a dose de budesonida na terapia tríplice não diminui a taxa de exacerbações, em comparação com a terapia tripla em dose padrão.[95]Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med. 2020 Jul 2;383(1):35-48.
http://www.ncbi.nlm.nih.gov/pubmed/32579807?tool=bestpractice.com
Em ambos os estudos, não houve diferenças na mortalidade, em comparação com BALD/CI.[95]Rabe KF, Martinez FJ, Ferguson GT, et al. Triple inhaled therapy at two glucocorticoid doses in moderate-to-very-severe COPD. N Engl J Med. 2020 Jul 2;383(1):35-48.
http://www.ncbi.nlm.nih.gov/pubmed/32579807?tool=bestpractice.com
[135]Lipson DA, Crim C, Criner GJ, et al. Reduction in all-cause mortality with fluticasone furoate/umeclidinium/vilanterol in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2020 Jun 15;201(12):1508-16.
https://www.atsjournals.org/doi/10.1164/rccm.201911-2207OC
http://www.ncbi.nlm.nih.gov/pubmed/32162970?tool=bestpractice.com
[136]Martinez FJ, Rabe KF, Ferguson GT, et al. Reduced all-cause mortality in the ETHOS trial of budesonide/glycopyrrolate/formoterol for chronic obstructive pulmonary disease. A randomized, double-blind, multicenter, parallel-group study. Am J Respir Crit Care Med. 2021 Mar 1;203(5):553-64.
https://www.atsjournals.org/doi/10.1164/rccm.202006-2618OC
http://www.ncbi.nlm.nih.gov/pubmed/33252985?tool=bestpractice.com
Uma análise post-hoc combinada de três ensaios clínicos de terapia tripla em pacientes com DPOC e limitação grave do fluxo aéreo e uma história de exacerbações mostrou uma tendência não significativa de redução da mortalidade com a terapia tripla, comparada aos tratamentos sem CI.[137]Vestbo J, Fabbri L, Papi A, et al. Inhaled corticosteroid containing combinations and mortality in COPD. Eur Respir J. 2018 Dec 13;52(6):1801230.
https://erj.ersjournals.com/content/52/6/1801230
http://www.ncbi.nlm.nih.gov/pubmed/30209195?tool=bestpractice.com
Esses resultados são reforçados por achados de uma metanálise de mais de 200 estudos: a terapia tripla proporcionou uma redução significativa na mortalidade, em comparação com a terapia dupla, embora tenha sido associada a aumento do risco de pneumonia. Nenhuma diferença foi observada entre os esquemas na função pulmonar ou na qualidade de vida relacionada com a saúde.[138]Axson EL, Lewis A, Potts J, et al. Inhaled therapies for chronic obstructive pulmonary disease: a systematic review and meta-analysis. BMJ Open. 2020 Sep 29;10(9):e036455.
https://bmjopen.bmj.com/content/10/9/e036455
http://www.ncbi.nlm.nih.gov/pubmed/32994234?tool=bestpractice.com
Antes de prescrever a terapia tripla, os médicos devem avaliar se outra doença física ou mental pode estar causando os sintomas do paciente. As diretrizes do Reino Unido aconselham os médicos a examinarem os pacientes que recebem terapia tripla para alívio dos sintomas diários após 3 meses. O tratamento deve ser alterado para BALD/LAMA se os sintomas do paciente não tiverem melhorado.[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].
https://www.nice.org.uk/guidance/ng115
Os CIs podem ser retirados se o paciente não tiver tido exacerbações no último ano.[96]Nici L, Mammen MJ, Charbek E, et al. Pharmacologic management of chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 May 1;201(9):e56-69.
https://www.atsjournals.org/doi/10.1164/rccm.202003-0625ST
http://www.ncbi.nlm.nih.gov/pubmed/32283960?tool=bestpractice.com
Uma revisão sistemática de dados de estudos da vida real encontrou poucas ou nenhuma evidência de agravamento dos desfechos quando os CIs foram suspensos e seguidos do tratamento farmacológico adequado em pacientes com DPOC moderada a grave.[139]Rogliani P, Ritondo BL, Gabriele M, et al. Optimizing de-escalation of inhaled corticosteroids in COPD: a systematic review of real-world findings. Expert Rev Clin Pharmacol. 2020 Sep;13(9):977-90.
https://www.tandfonline.com/doi/full/10.1080/17512433.2020.1817739
http://www.ncbi.nlm.nih.gov/pubmed/32885691?tool=bestpractice.com
inibidores da fosfodiesterase
O roflumilaste é um inibidor oral da fosfodiesterase (PDE)-4 que inibe a quebra do cAMP. Ele pode ser considerado nos pacientes com VEF₁ <50% do predito e bronquite crônica que fazem uso de BALD/LAMA/CI, particularmente se tiverem apresentado pelo menos uma hospitalização por causa de exacerbação no ano anterior.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
O roflumilaste oferece benefício na melhora da função pulmonar e na redução da probabilidade de exacerbações. No entanto, tem pouco impacto na qualidade de vida ou nos sintomas.[140]Janjua S, Fortescue R, Poole P. Phosphodiesterase-4 inhibitors for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2020 May 1;(5):CD002309.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002309.pub6/full
http://www.ncbi.nlm.nih.gov/pubmed/32356609?tool=bestpractice.com
[  ]
How do phosphodiesterase‐4 inhibitors compare with placebo for people with chronic obstructive pulmonary disease?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3151/fullMostre-me a resposta
]
How do phosphodiesterase‐4 inhibitors compare with placebo for people with chronic obstructive pulmonary disease?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3151/fullMostre-me a resposta
Ensifentrina é um inibidor seletivo de PDE-3 e PDE-4 aprovado nos EUA para o tratamento de manutenção da DPOC em adultos. Ela combina efeitos broncodilatadores e anti-inflamatórios não esteroidais em uma única molécula. Ensifentrina pode ser considerada como um broncodilatador complementar para pacientes com DPOC estável que recebem BALD/LAMA e apresentam sintomas persistentes de dispneia.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Os benefícios clínicos foram aparentes quando usada como monoterapia e com outras terapias de manutenção.[141]Anzueto A, Barjaktarevic IZ, Siler TM, et al. Ensifentrine, a novel phosphodiesterase 3 and 4 inhibitor for the treatment of chronic obstructive pulmonary disease: randomized, double-blind, placebo-controlled, multicenter phase III trials (the ENHANCE trials). Am J Respir Crit Care Med. 2023 Aug 15;208(4):406-16.
https://www.atsjournals.org/doi/10.1164/rccm.202306-0944OC?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
http://www.ncbi.nlm.nih.gov/pubmed/37364283?tool=bestpractice.com
No entanto, o lugar da ensifentrina na terapia requer estudos adicionais.
A - antibióticos
Antibióticos profiláticos, como os macrolídeos, podem ser considerados para reduzir o risco de exacerbação aguda, particularmente em pacientes que apresentam exacerbações frequentes e são refratários à terapia padrão.[142]Simoens S, Laekeman G, Decramer M. Preventing COPD exacerbations with macrolides: a review and budget impact analysis. Respir Med. 2013 May;107(5):637-48.
http://www.ncbi.nlm.nih.gov/pubmed/23352223?tool=bestpractice.com
[143]Lee JS, Park DA, Hong Y, et al. Systematic review and meta-analysis of prophylactic antibiotics in COPD and/or chronic bronchitis. Int J Tuberc Lung Dis. 2013 Feb;17(2):153-62.
http://www.ncbi.nlm.nih.gov/pubmed/23317949?tool=bestpractice.com
[144]Uzun S, Djamin RS, Kluytmans JA, et al. Azithromycin maintenance treatment in patients with frequent exacerbations of chronic obstructive pulmonary disease (COLUMBUS): a randomised, double-blind, placebo-controlled trial. Lancet Respir Med. 2014 May;2(5):361-8.
http://www.ncbi.nlm.nih.gov/pubmed/24746000?tool=bestpractice.com
[145]Janjua S, Mathioudakis AG, Fortescue R, et al. Prophylactic antibiotics for adults with chronic obstructive pulmonary disease: a network meta-analysis. Cochrane Database Syst Rev. 2021 Jan 15;(1):CD013198.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013198.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/33448349?tool=bestpractice.com
Uma revisão Cochrane classificou os macrolídeos em primeiro lugar em relação à redução de exacerbações e eventos adversos graves e à melhora na qualidade de vida, acima das fluoroquinolonas e das tetraciclinas.[145]Janjua S, Mathioudakis AG, Fortescue R, et al. Prophylactic antibiotics for adults with chronic obstructive pulmonary disease: a network meta-analysis. Cochrane Database Syst Rev. 2021 Jan 15;(1):CD013198.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013198.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/33448349?tool=bestpractice.com
O uso de antibióticos macrolídeos profiláticos diminui a frequência de exacerbações em pacientes com DPOC, mas o uso de azitromicina no longo prazo está associado a perda auditiva clinicamente significativa, que, em muitos casos, era reversível.[146]Herath SC, Normansell R, Maisey S, et al. Prophylactic antibiotic therapy for chronic obstructive pulmonary disease (COPD). Cochrane Database Syst Rev. 2018 Oct 30;(10):CD009764.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD009764.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/30376188?tool=bestpractice.com
[  ]
What are the effects of prophylactic antibiotics for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2431/fullMostre-me a resposta Não há dados que demonstrem a eficácia ou a segurança do tratamento crônico com azitromicina por mais de 1 ano.
]
What are the effects of prophylactic antibiotics for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2431/fullMostre-me a resposta Não há dados que demonstrem a eficácia ou a segurança do tratamento crônico com azitromicina por mais de 1 ano.
Acredita-se que a terapia com azitromicina seja a mais eficaz na prevenção da exacerbação aguda, com mais eficácia observada em pacientes mais idosos e estágios mais leves de GOLD. Poucas evidências do benefício do tratamento são observadas em fumantes atuais.[147]Han MK, Tayob N, Murray S, et al. Predictors of chronic obstructive pulmonary disease exacerbation reduction in response to daily azithromycin therapy. Am J Respir Crit Care Med. 2014 Jun 15;189(12):1503-8.
https://www.atsjournals.org/doi/full/10.1164/rccm.201402-0207OC#.V9weczUpW9Y
http://www.ncbi.nlm.nih.gov/pubmed/24779680?tool=bestpractice.com
A azitromicina aumenta o risco de colonização com organismos resistentes a macrolídeos e não deve ser prescrita para pacientes com comprometimento auditivo, taquicardia em repouso ou risco aparente de prolongamento do QTc.[148]Albert RK, Connett J, Bailey WC, et al; COPD Clinical Research Network. Azithromycin for prevention of exacerbations of COPD. N Engl J Med. 2011 Aug 25;365(8):689-98.
https://www.nejm.org/doi/full/10.1056/NEJMoa1104623
http://www.ncbi.nlm.nih.gov/pubmed/21864166?tool=bestpractice.com
A azitromicina deve ser considerada preferencialmente, mas não apenas, nos ex-fumantes com exacerbações persistentes apesar de uma terapia adequada.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
As diretrizes do Reino Unido indicam que a azitromicina profilática pode ser considerada para pacientes com mais de três exacerbações agudas que exijam terapia com corticosteroides e pelo menos uma exacerbação que exija hospitalização durante o ano.[149]Smith D, Du Rand I, Addy CL, et al. British Thoracic Society guideline for the use of long-term macrolides in adults with respiratory disease. Thorax. 2020 May;75(5):370-404.
https://thorax.bmj.com/content/75/5/370
http://www.ncbi.nlm.nih.gov/pubmed/32303621?tool=bestpractice.com
Antes de se iniciarem antibióticos profiláticos, devem ser realizados um ECG e testes da função hepática basais, uma amostra de escarro obtida para cultura e testes de sensibilidade (incluindo testagem para tuberculose), a técnica de eliminação da expectoração do paciente deve ser otimizada e a bronquiectasia deve ser descartada com uma TC.[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].
https://www.nice.org.uk/guidance/ng115
[149]Smith D, Du Rand I, Addy CL, et al. British Thoracic Society guideline for the use of long-term macrolides in adults with respiratory disease. Thorax. 2020 May;75(5):370-404.
https://thorax.bmj.com/content/75/5/370
http://www.ncbi.nlm.nih.gov/pubmed/32303621?tool=bestpractice.com
O ECG e os testes hepáticos devem ser repetidos após 1 mês de tratamento. Uma comparação direta das fluoroquinolonas, tetraciclinas e macrolídeos administrados por 12 a 13 semanas em pessoas com DPOC não identificou nenhuma diferença na eficácia ou na segurança entre as classes de antibióticos, mas os tamanhos das amostras dos estudos incluídos foram pequenos, e os estudos foram de curta duração; mais pesquisas são necessárias nesta área.[150]Threapleton CJ, Janjua S, Fortescue R, et al. Head-to-head oral prophylactic antibiotic therapy for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 May 24;(5):CD013024.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013024.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/31125127?tool=bestpractice.com
A antibioticoterapia profilática deve ser reavaliada aos 6 e 12 meses para determinar se há algum benefício em termos de taxas de exacerbação.[149]Smith D, Du Rand I, Addy CL, et al. British Thoracic Society guideline for the use of long-term macrolides in adults with respiratory disease. Thorax. 2020 May;75(5):370-404.
https://thorax.bmj.com/content/75/5/370
http://www.ncbi.nlm.nih.gov/pubmed/32303621?tool=bestpractice.com
Se a antibioticoterapia não for eficaz, deve-se interrompê-la.
Terapias biológicas
Dupilumabe, um antagonista do receptor de IL-4, pode ser considerado para pacientes com DPOC moderada a grave que recebem BALD/LAMA/CI, com história de exacerbação, bronquite crônica e eosinófilos no sangue ≥300 células/microlitro.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[151]Bhatt SP, Rabe KF, Hanania NA, et al. Dupilumab for COPD with type 2 inflammation indicated by eosinophil counts. N Engl J Med. 2023 Jul 20;389(3):205-14.
https://www.doi.org/10.1056/NEJMoa2303951
http://www.ncbi.nlm.nih.gov/pubmed/37272521?tool=bestpractice.com
[152]Bhatt SP, Rabe KF, Hanania NA, et al. Dupilumab for COPD with blood eosinophil evidence of type 2 inflammation. N Engl J Med. 2024 Jun 27;390(24):2274-83.
http://www.ncbi.nlm.nih.gov/pubmed/38767614?tool=bestpractice.com
Dupilumabe não deve ser usado para alívio do broncoespasmo agudo. O dupilumabe está aprovado nos EUA e na Europa para tratamento de manutenção adjuvante em adultos com DPOC não controlada, caracterizada por eosinófilos elevados no sangue.
Metilxantinas
A teofilina (pertencente à classe das metilxantinas) é um broncodilatador que age aumentando a cAMP (adenosina monofosfato cíclica) e, subsequentemente, o relaxamento do músculo liso respiratório. Ela não é usada comumente em decorrência da sua potência limitada, janela terapêutica estreita, perfil de risco elevado e frequentes interações medicamentosas. A teofilina tem efeitos modestos sobre a função pulmonar na DPOC moderada a grave.[153]Ram FSF, Jones P, Jardim J, et al. Oral theophylline for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2002;(4):CD003902.
http://www.ncbi.nlm.nih.gov/pubmed/12519617?tool=bestpractice.com
Um grande ensaio clínico randomizado e controlado não encontrou efeitos da teofilina oral isolada ou associada a prednisolona sobre as exacerbações da DPOC grave.[154]Jenkins CR, Wen FQ, Martin A, et al; TASCS study investigators. The effect of low-dose corticosteroids and theophylline on the risk of acute exacerbations of COPD: the TASCS randomised controlled trial. Eur Respir J. 2021 Jun 10;57(6):2003338.
https://erj.ersjournals.com/content/57/6/2003338
http://www.ncbi.nlm.nih.gov/pubmed/33334939?tool=bestpractice.com
Os especialistas podem prescrever teofilina quando o paciente já tiver esgotado as opções de terapias inalatórias. A teofilina não é recomendada a menos que outros tratamentos com broncodilatadores em longo prazo não estejam disponíveis ou sejam inacessíveis.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Educação do paciente e autocuidados
Todos os pacientes devem ser muito bem educados sobre a evolução da doença e os sintomas de exacerbação ou descompensação. A expectativa que eles têm da doença, o tratamento e o prognóstico devem ser realistas. É importante lembrar que nenhum medicamento demonstrou alteração da diminuição em longo prazo da função pulmonar, e o principal objetivo da farmacoterapia é controlar os sintomas e prevenir as complicações.
Uma revisão Cochrane constatou que intervenções de autocuidados que incluem um plano de ação para as exacerbações agudas da DPOC estão associadas a melhoras na qualidade de vida relacionada à saúde e a menos hospitalizações por problemas respiratórios. Uma análise exploratória constatou uma taxa pequena, mas significativamente maior, da mortalidade relacionada a fatores respiratórios para o caso de autocuidados em comparação com os cuidados habituais, embora não se tenha observado nenhum aumento no risco de mortalidade por todas as causas.[155]Lenferink A, Brusse-Keizer M, van der Valk PD, et al. Self-management interventions including action plans for exacerbations versus usual care in patients with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017 Aug 4;(8):CD011682.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD011682.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/28777450?tool=bestpractice.com
Um ensaio clínico randomizado controlado mostrou que um programa de 3 meses de autocuidados iniciado em pacientes com exacerbações da DPOC com alta hospitalar recente levou a aumentos nas hospitalizações relacionadas à DPOC e idas ao pronto-socorro ao longo de 6 meses.[156]Aboumatar H, Naqibuddin M, Chung S, et al. Effect of a hospital-initiated program combining transitional care and long-term self-management support on outcomes of patients hospitalized with chronic obstructive pulmonary disease: a randomized clinical trial. JAMA. 2019 Oct 8;322(14):1371-80.
https://jamanetwork.com/journals/jama/fullarticle/2752467
http://www.ncbi.nlm.nih.gov/pubmed/31593271?tool=bestpractice.com
Os planos de autocuidado devem incluir aconselhamento personalizado sobre: técnicas de controle da dispneia e estresse; conservação de energia; evitar fatores agravantes; como monitorizar os sintomas; como controlar os sintomas de agravamento; e informações de contato a serem usadas em caso de uma exacerbação.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
O auxílio para os pacientes se autocuidarem deve, idealmente, abordar as preocupações psicossociais e as crenças pessoais dos pacientes sobre a DPOC e seu tratamento. Muitos pacientes relatam perdas e limitações em seu estilo de vida e sua interação social após um diagnóstico de DPOC. Estima-se que os pacientes com DPOC têm 1.9 vez mais probabilidade de cometerem suicídio que aqueles sem DPOC, e sintomas de ansiedade, depressão e frustração são comuns.[157]Sampaio MS, Vieira WA, Bernardino ÍM, et al. Chronic obstructive pulmonary disease as a risk factor for suicide: a systematic review and meta-analysis. Respir Med. 2019 May;151:11-18.
https://www.resmedjournal.com/article/S0954-6111(19)30093-9/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/31047105?tool=bestpractice.com
[158]Russell S, Ogunbayo OJ, Newham JJ, et al. Qualitative systematic review of barriers and facilitators to self-management of chronic obstructive pulmonary disease: views of patients and healthcare professionals. NPJ Prim Care Respir Med. 2018 Jan 17;28(1):2.
https://www.nature.com/articles/s41533-017-0069-z
http://www.ncbi.nlm.nih.gov/pubmed/29343739?tool=bestpractice.com
Estudos constataram um efeito benéfico da terapia cognitivo-comportamental (TCC) sobre desfechos que incluem sintomas de depressão e ansiedade, qualidade de vida e frequência de idas ao pronto-socorro.[159]Pollok J, van Agteren JE, Esterman AJ, et al. Psychological therapies for the treatment of depression in chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 Mar 6;(3):CD012347.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012347.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/30838649?tool=bestpractice.com
[160]Ma RC, Yin YY, Wang YQ, et al. Effectiveness of cognitive behavioural therapy for chronic obstructive pulmonary disease patients: a systematic review and meta-analysis. Complement Ther Clin Pract. 2020 Feb;38:101071.
http://www.ncbi.nlm.nih.gov/pubmed/31743870?tool=bestpractice.com
[161]Williams MT, Johnston KN, Paquet C. Cognitive behavioral therapy for people with chronic obstructive pulmonary disease: rapid review. Int J Chron Obstruct Pulmon Dis. 2020 Apr 23;15:903-19.
https://www.dovepress.com/cognitive-behavioral-therapy-for-people-with-chronic-obstructive-pulmo-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/32425516?tool=bestpractice.com
São necessárias pesquisas adicionais sobre os efeitos da TCC de alta intensidade versus a TCC de baixa intensidade.[161]Williams MT, Johnston KN, Paquet C. Cognitive behavioral therapy for people with chronic obstructive pulmonary disease: rapid review. Int J Chron Obstruct Pulmon Dis. 2020 Apr 23;15:903-19.
https://www.dovepress.com/cognitive-behavioral-therapy-for-people-with-chronic-obstructive-pulmo-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/32425516?tool=bestpractice.com
Um ensaio clínico randomizado e controlado constatou que uma intervenção de orientação sobre saúde ao telefone, com o objetivo de promover a mudança de comportamento em pacientes com DPOC leve na atenção primária, resultou em melhoras nas atividades de autocuidados, mas não melhorou a qualidade de vida relacionada à saúde.[162]Jolly K, Sidhu MS, Hewitt CA, et al. Self management of patients with mild COPD in primary care: randomised controlled trial. BMJ. 2018 Jun 13;361:k2241.
https://www.bmj.com/content/361/bmj.k2241.long
http://www.ncbi.nlm.nih.gov/pubmed/29899047?tool=bestpractice.com
Uma metanálise constatou que um treinamento em saúde que incluísse definição de metas, entrevistas motivacionais e educação em saúde relacionada à DPOC melhorou significativamente a qualidade de vida relacionada à saúde e reduziu as internações hospitalares decorrentes de exacerbações da DPOC, mas não diminuiu as internações hospitalares por todas as causas.[163]Long H, Howells K, Peters S, et al. Does health coaching improve health-related quality of life and reduce hospital admissions in people with chronic obstructive pulmonary disease? A systematic review and meta-analysis. Br J Health Psychol. 2019 Sep;24(3):515-46.
https://bpspsychub.onlinelibrary.wiley.com/doi/10.1111/bjhp.12366
http://www.ncbi.nlm.nih.gov/pubmed/31033121?tool=bestpractice.com
Os pacientes que usam terapias inalatórias devem receber treinamento sobre a técnica do dispositivo inalador. A maioria dos pacientes comete pelo menos um erro ao usar o inalador, e o uso incorreto do inalador está associado a um pior controle da doença.[164]Cho-Reyes S, Celli BR, Dembek C, et al. Inhalation technique errors with metered-dose inhalers among patients with obstructive lung diseases: a systematic review and meta-analysis of US Studies. Chronic Obstr Pulm Dis. 2019 Jul 24;6(3):267-80.
https://journal.copdfoundation.org/jcopdf/id/1241/Inhalation-Technique-Errors-with-Metered-Dose-Inhalers-Among-Patients-with-Obstructive-Lung-Diseases-A-Systematic-Review-and-Meta-Analysis-of-US-Studies
http://www.ncbi.nlm.nih.gov/pubmed/31342732?tool=bestpractice.com
[165]Melani AS, Bonavia M, Cilenti V, et al. Inhaler mishandling remains common in real life and is associated with reduced disease control. Respir Med. 2011 Jun;105(6):930-8.
https://www.resmedjournal.com/article/S0954-6111(11)00009-6/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/21367593?tool=bestpractice.com
A má aplicação da técnica é mais provável quando os pacientes usam vários dispositivos ou nunca receberam treinamento sobre a técnica de uso do inalador.[166]Rootmensen GN, van Keimpema AR, Jansen HM, et al. Predictors of incorrect inhalation technique in patients with asthma or COPD: a study using a validated videotaped scoring method. J Aerosol Med Pulm Drug Deliv. 2010 Oct;23(5):323-8.
http://www.ncbi.nlm.nih.gov/pubmed/20804428?tool=bestpractice.com
A demonstração do uso do inalador por um médico, a escolha do dispositivo e a revisão da técnica em consultas subsequentes podem melhorar a técnica de uso do inalador.[167]Price D, Keininger DL, Viswanad B, et al. Factors associated with appropriate inhaler use in patients with COPD - lessons from the REAL survey. Int J Chron Obstruct Pulmon Dis. 2018 Feb 26;13:695-702. [Erratum in: Int J Chron Obstruct Pulmon Dis. 2018 Jul 25;13:2253-4.]
https://www.dovepress.com/factors-associated-with-appropriate-inhaler-use-in-patients-with-copd--peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/29520137?tool=bestpractice.com
A demonstração com um dispositivo placebo pode ser o meio mais eficaz para ensinar a técnica inalatória a adultos com idade ≥65 anos.[168]Maricoto T, Monteiro L, Gama JMR, et al. Inhaler technique education and exacerbation risk in older adults with asthma or chronic obstructive pulmonary disease: a meta-analysis. J Am Geriatr Soc. 2019 Jan;67(1):57-66.
http://www.ncbi.nlm.nih.gov/pubmed/30291745?tool=bestpractice.com
Os pacientes devem ser instruídos a trazerem os inaladores para a consulta para facilitar a revisão do uso do inalador.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
As intervenções conduzidas por um farmacêutico e um profissional com treinamento em saúde podem melhorar a técnica de inalação e a adesão em pacientes com DPOC.[169]Jia X, Zhou S, Luo D, et al. Effect of pharmacist-led interventions on medication adherence and inhalation technique in adult patients with asthma or COPD: a systematic review and meta-analysis. J Clin Pharm Ther. 2020 Oct;45(5):904-17.
https://onlinelibrary.wiley.com/doi/10.1111/jcpt.13126
http://www.ncbi.nlm.nih.gov/pubmed/32107837?tool=bestpractice.com
[170]Willard-Grace R, Chirinos C, Wolf J, et al. Lay health coaching to increase appropriate inhaler use in COPD: a randomized controlled trial. Ann Fam Med. 2020 Jan;18(1):5-14.
https://www.annfammed.org/content/18/1/5
http://www.ncbi.nlm.nih.gov/pubmed/31937527?tool=bestpractice.com
Características de dispositivos inaladores, como início rápido do alívio dos sintomas e tamanho reduzido foram relatadas em estudos relativos à preferência dos pacientes.[171]Navaie M, Dembek C, Cho-Reyes S, et al. Inhaler device feature preferences among patients with obstructive lung diseases: a systematic review and meta-analysis. Medicine (Baltimore). 2020 Jun 19;99(25):e20718.
https://journals.lww.com/md-journal/fulltext/2020/06190/inhaler_device_feature_preferences_among_patients.56.aspx
http://www.ncbi.nlm.nih.gov/pubmed/32569208?tool=bestpractice.com
[172]Tervonen T, Hawken N, Hanania NA, et al. Maintenance inhaler therapy preferences of patients with asthma or chronic obstructive pulmonary disease: a discrete choice experiment. Thorax. 2020 Sep;75(9):735-43.
https://thorax.bmj.com/content/75/9/735
http://www.ncbi.nlm.nih.gov/pubmed/32631932?tool=bestpractice.com
Inalador dosimetradoUm farmacêutico mostra a um paciente como usar um inalador dosimetrado e discute maneiras de melhorar a técnica de uso do inalador.
Inaladores de pó secoUm farmacêutico mostra a um paciente como usar dispositivos de pó seco e discute maneiras de melhorar a técnica de uso do inalador.
Inalador de névoa suaveUm farmacêutico mostra a um paciente como usar um inalador de névoa suave e discute maneiras de melhorar a técnica de uso do inalador.
Recomenda-se atividade física para todos os pacientes com DPOC.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Uma revisão sistemática e metanálise de ensaios clínicos randomizados e controlados constatou que o treino com exercícios, por si só, pode melhorar a atividade física na DPOC, sendo possível obter mais melhoras com a adição de orientação sobre as atividades físicas.[173]Lahham A, McDonald CF, Holland AE. Exercise training alone or with the addition of activity counseling improves physical activity levels in COPD: a systematic review and meta-analysis of randomized controlled trials. Int J Chron Obstruct Pulmon Dis. 2016 Dec 8;11:3121-36.
https://www.dovepress.com/exercise-training-alone-or-with-the-addition-of-activity-counseling-im-peer-reviewed-fulltext-article-COPD
http://www.ncbi.nlm.nih.gov/pubmed/27994451?tool=bestpractice.com
Outra revisão sistemática e metanálise constatou que uma combinação de exercícios aeróbicos e treinamento de força foi mais eficaz que o treinamento de força ou treinamento de resistência isolados em aumentar a distância de caminhada em 6 minutos.[174]Vooijs M, Siemonsma PC, Heus I, et al. Therapeutic validity and effectiveness of supervised physical exercise training on exercise capacity in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Clin Rehabil. 2016 Nov;30(11):1037-48.
http://www.ncbi.nlm.nih.gov/pubmed/26451006?tool=bestpractice.com
Outros estudos demonstraram melhoras no pico do consumo de oxigênio, fadiga percebida e qualidade de vida relacionada à saúde após a adesão a programas de exercícios supervisionados e não supervisionados.[175]Ward TJC, Plumptre CD, Dolmage TE, et al. Change in VO2peak in response to aerobic exercise training and the relationship with exercise prescription in people with COPD: a systematic review and meta-analysis. Chest. 2020 Jul;158(1):131-44.
http://www.ncbi.nlm.nih.gov/pubmed/32173489?tool=bestpractice.com
[176]Paneroni M, Vitacca M, Venturelli M, et al. The impact of exercise training on fatigue in patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Pulmonology. 2020 Sep - Oct;26(5):304-13.
http://www.ncbi.nlm.nih.gov/pubmed/32184070?tool=bestpractice.com
[177]Taylor D, Jenkins AR, Parrott K, et al. Efficacy of unsupervised exercise in adults with obstructive lung disease: a systematic review and meta-analysis. Thorax. 2021 Jun;76(6):591-600.
http://www.ncbi.nlm.nih.gov/pubmed/33685962?tool=bestpractice.com
Uma revisão Cochrane constatou evidências limitadas de melhora da atividade física mediante aconselhamento específico, treinamento físico e tratamento farmacológico da DPOC. Os autores comentaram que a avaliação da qualidade foi limitada pela falta de detalhes metodológicos e que a diversidade de intervenções foi avaliada principalmente em estudos únicos.[178]Burge AT, Cox NS, Abramson MJ, et al. Interventions for promoting physical activity in people with chronic obstructive pulmonary disease (COPD). Cochrane Database Syst Rev. 2020 Apr 16;(4):CD012626.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012626.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/32297320?tool=bestpractice.com
[  ]
Which interventions lead to increased regular physical activity for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3155/fullMostre-me a resposta O momento, os componentes, a duração e os modelos ideais para melhorar a atividade física permanecem pouco claros. Metanálises sugerem que ioga, Qigong e outros exercícios respiratórios realizados em casa podem melhorar a capacidade de exercício e a função pulmonar em pacientes com DPOC.[179]Cramer H, Haller H, Klose P, et al. The risks and benefits of yoga for patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Clin Rehabil. 2019 Dec;33(12):1847-62.
http://www.ncbi.nlm.nih.gov/pubmed/31353959?tool=bestpractice.com
[180]Tong H, Liu Y, Zhu Y, et al. The therapeutic effects of qigong in patients with chronic obstructive pulmonary disease in the stable stage: a meta-analysis. BMC Complement Altern Med. 2019 Sep 4;19(1):239.
https://bmccomplementmedtherapies.biomedcentral.com/articles/10.1186/s12906-019-2639-9
http://www.ncbi.nlm.nih.gov/pubmed/31484521?tool=bestpractice.com
[181]Lu Y, Li P, Li N, et al. Effects of home-based breathing exercises in subjects with COPD. Respir Care. 2020 Mar;65(3):377-87.
https://rc.rcjournal.com/content/65/3/377
http://www.ncbi.nlm.nih.gov/pubmed/31719191?tool=bestpractice.com
Ficou comprovado que o Tai Chi melhora a capacidade de exercício, em comparação com os cuidados habituais.[182]Liu X, Fu C, Hu W, et al. The effect of Tai Chi on the pulmonary rehabilitation of chronic obstructive pulmonary disease: a systematic review and meta-analysis. Ann Palliat Med. 2021 Apr;10(4):3763-82.
https://apm.amegroups.org/article/view/67333/html
http://www.ncbi.nlm.nih.gov/pubmed/33894710?tool=bestpractice.com
]
Which interventions lead to increased regular physical activity for people with chronic obstructive pulmonary disease (COPD)?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.3155/fullMostre-me a resposta O momento, os componentes, a duração e os modelos ideais para melhorar a atividade física permanecem pouco claros. Metanálises sugerem que ioga, Qigong e outros exercícios respiratórios realizados em casa podem melhorar a capacidade de exercício e a função pulmonar em pacientes com DPOC.[179]Cramer H, Haller H, Klose P, et al. The risks and benefits of yoga for patients with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Clin Rehabil. 2019 Dec;33(12):1847-62.
http://www.ncbi.nlm.nih.gov/pubmed/31353959?tool=bestpractice.com
[180]Tong H, Liu Y, Zhu Y, et al. The therapeutic effects of qigong in patients with chronic obstructive pulmonary disease in the stable stage: a meta-analysis. BMC Complement Altern Med. 2019 Sep 4;19(1):239.
https://bmccomplementmedtherapies.biomedcentral.com/articles/10.1186/s12906-019-2639-9
http://www.ncbi.nlm.nih.gov/pubmed/31484521?tool=bestpractice.com
[181]Lu Y, Li P, Li N, et al. Effects of home-based breathing exercises in subjects with COPD. Respir Care. 2020 Mar;65(3):377-87.
https://rc.rcjournal.com/content/65/3/377
http://www.ncbi.nlm.nih.gov/pubmed/31719191?tool=bestpractice.com
Ficou comprovado que o Tai Chi melhora a capacidade de exercício, em comparação com os cuidados habituais.[182]Liu X, Fu C, Hu W, et al. The effect of Tai Chi on the pulmonary rehabilitation of chronic obstructive pulmonary disease: a systematic review and meta-analysis. Ann Palliat Med. 2021 Apr;10(4):3763-82.
https://apm.amegroups.org/article/view/67333/html
http://www.ncbi.nlm.nih.gov/pubmed/33894710?tool=bestpractice.com
Foi demonstrado que orientações alimentares e suplementação oral melhoram o peso corporal, a qualidade de vida, a força dos músculos respiratórios e a distância percorrida no teste de caminhada de 6 minutos.[183]Collins PF, Elia M, Stratton RJ. Nutritional support and functional capacity in chronic obstructive pulmonary disease: a systematic review and meta-analysis. Respirology. 2013 May;18(4):616-29.
https://onlinelibrary.wiley.com/doi/10.1111/resp.12070
http://www.ncbi.nlm.nih.gov/pubmed/23432923?tool=bestpractice.com
[184]Ferreira IM, Brooks D, White J, et al. Nutritional supplementation for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2012 Dec 12;(12):CD000998.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD000998.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/23235577?tool=bestpractice.com
No entanto, o suporte nutricional não demonstrou melhorar a função pulmonar de maneira consistente.[184]Ferreira IM, Brooks D, White J, et al. Nutritional supplementation for stable chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2012 Dec 12;(12):CD000998.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD000998.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/23235577?tool=bestpractice.com
Abandono do hábito de fumar
Deve-se encorajar o abandono do hábito de fumar em todos os pacientes, além de se fornecerem orientações sobre como evitar exposições à fumaça de cigarro ambiental ou ocupacional e outros irritantes.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[2]National Institute for Health and Care Excellence. Chronic obstructive pulmonary disease in over 16s: diagnosis and management. Jul 2019 [internet publication].
https://www.nice.org.uk/guidance/ng115
O abandono do hábito de fumar reduz significativamente a taxa de progressão da DPOC e o risco de malignidades. Além disso, reduz o risco de doenças coronárias e cerebrovasculares. Entre as diferentes modalidades terapêuticas para DPOC, os únicos dois fatores que melhoram a sobrevida são o abandono do hábito de fumar e a suplementação de oxigênio.
Os programas usuais para o abandono do hábito de fumar incluem aconselhamento, reuniões de grupo e terapia medicamentosa.[185]Gonzales D, Rennard SI, Nides M, et al; Varenicline Phase 3 Study Group. Varenicline, an alpha4beta2 nicotinic acetylcholine receptor partial agonist, vs sustained-release bupropion and placebo for smoking cessation: a randomized controlled trial. JAMA. 2006 Jul 5;296(1):47-55.
https://jamanetwork.com/journals/jama/fullarticle/211000
http://www.ncbi.nlm.nih.gov/pubmed/16820546?tool=bestpractice.com
Alguns pacientes podem precisar de encaminhamentos frequentes a esses serviços para que sejam bem-sucedidos. O abandono do hábito de fumar com farmacoterapia e aconselhamento intensivo apresenta uma maior taxa de sucesso e é custo-efetivo na DPOC, com baixos custos por ano de vida ajustado à qualidade (QALY) ganho.[186]Hoogendoorn M, Feenstra TL, Hoogenveen RT, et al. Long-term effectiveness and cost-effectiveness of smoking cessation interventions in patients with COPD. Thorax. 2010 Aug;65(8):711-8.
http://www.ncbi.nlm.nih.gov/pubmed/20685746?tool=bestpractice.com
[187]Warnier MJ, van Riet EE, Rutten FH, et al. Smoking cessation strategies in patients with COPD. Eur Respir J. 2013 Mar;41(3):727-34.
http://www.ncbi.nlm.nih.gov/pubmed/22936706?tool=bestpractice.com
[188]van Eerd EA, van der Meer RM, van Schayck OC, et al. Smoking cessation for people with chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2016 Aug 20;(8):CD010744.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD010744.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/27545342?tool=bestpractice.com
O uso de sistemas de fornecimento eletrônico de nicotina (ENDS), incluindo cigarros eletrônicos e produtos de "vaping", como auxiliares para o abandono do hábito de fumar é controverso. As evidências de estudos observacionais não dão suporte atualmente ao uso de ENDS como auxílio para o abandono do hábito de fumar em pessoas com DPOC.[189]Bowler RP, Hansel NN, Jacobson S, et al; for COPDGene and SPIROMICS Investigators. Electronic cigarette use in US adults at risk for or with COPD: analysis from two observational cohorts. J Gen Intern Med. 2017 Dec;32(12):1315-22.
https://link.springer.com/article/10.1007/s11606-017-4150-7
http://www.ncbi.nlm.nih.gov/pubmed/28884423?tool=bestpractice.com
Consulte Abandono do hábito de fumar (Abordagem de tratamento).
Mucolíticos
Os pacientes com fenótipo de bronquite crônica da DPOC geralmente produzem escarro espesso com frequência. Os agentes mucolíticos (erdosteína, carbocisteína e acetilcisteína) não estão associados a um aumento de efeitos adversos e podem ser benéficos durante as exacerbações da DPOC.
[  ]
For people with chronic bronchitis or chronic obstructive pulmonary disease, how do mucolytic agents compare with placebo?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2591/fullMostre-me a resposta Eles proporcionam uma pequena redução na frequência das exacerbações agudas e no número de dias de incapacidade por mês, mas não melhoram a função pulmonar nem a qualidade de vida.[190]Poole P, Sathananthan K, Fortescue R. Mucolytic agents versus placebo for chronic bronchitis or chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 May 20;(5):CD001287.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001287.pub6/full
http://www.ncbi.nlm.nih.gov/pubmed/31107966?tool=bestpractice.com
[191]Rogliani P, Matera MG, Page C, et al. Efficacy and safety profile of mucolytic/antioxidant agents in chronic obstructive pulmonary disease: a comparative analysis across erdosteine, carbocysteine, and N-acetylcysteine. Respir Res. 2019 May 27;20(1):104.
https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1078-y
http://www.ncbi.nlm.nih.gov/pubmed/31133026?tool=bestpractice.com
[192]Wei J, Pang CS, Han J, et al. Effect of orally administered N-acetylcysteine on chronic bronchitis: a meta-analysis. Adv Ther. 2019 Dec;36(12):3356-67.
http://www.ncbi.nlm.nih.gov/pubmed/31598901?tool=bestpractice.com
A erdosteína e a carbocisteína não estão disponíveis nos EUA. O tratamento com agentes mucolíticos, como carbocisteína e acetilcisteína, pode reduzir as exacerbações e melhorar levemente o estado de saúde em pacientes que não fazem uso de CIs.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
No entanto, a erdosteína pode ter um efeito significativo sobre as exacerbações leves, independentemente de o paciente estar ou não tomando CIs.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
]
For people with chronic bronchitis or chronic obstructive pulmonary disease, how do mucolytic agents compare with placebo?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.2591/fullMostre-me a resposta Eles proporcionam uma pequena redução na frequência das exacerbações agudas e no número de dias de incapacidade por mês, mas não melhoram a função pulmonar nem a qualidade de vida.[190]Poole P, Sathananthan K, Fortescue R. Mucolytic agents versus placebo for chronic bronchitis or chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2019 May 20;(5):CD001287.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001287.pub6/full
http://www.ncbi.nlm.nih.gov/pubmed/31107966?tool=bestpractice.com
[191]Rogliani P, Matera MG, Page C, et al. Efficacy and safety profile of mucolytic/antioxidant agents in chronic obstructive pulmonary disease: a comparative analysis across erdosteine, carbocysteine, and N-acetylcysteine. Respir Res. 2019 May 27;20(1):104.
https://respiratory-research.biomedcentral.com/articles/10.1186/s12931-019-1078-y
http://www.ncbi.nlm.nih.gov/pubmed/31133026?tool=bestpractice.com
[192]Wei J, Pang CS, Han J, et al. Effect of orally administered N-acetylcysteine on chronic bronchitis: a meta-analysis. Adv Ther. 2019 Dec;36(12):3356-67.
http://www.ncbi.nlm.nih.gov/pubmed/31598901?tool=bestpractice.com
A erdosteína e a carbocisteína não estão disponíveis nos EUA. O tratamento com agentes mucolíticos, como carbocisteína e acetilcisteína, pode reduzir as exacerbações e melhorar levemente o estado de saúde em pacientes que não fazem uso de CIs.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
No entanto, a erdosteína pode ter um efeito significativo sobre as exacerbações leves, independentemente de o paciente estar ou não tomando CIs.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Reabilitação pulmonar
A reabilitação pulmonar compreende exercício aeróbico, treinamento de força e educação. Ela deve ser iniciada nos pacientes que permanecerem sintomáticos apesar da terapia com broncodilatadores, e recomenda-se que seja iniciada precocemente na evolução da doença, quando eles começam a sentir dispneia em atividades regulares ou caminhadas em superfícies planas.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[193]Rochester CL, Alison JA, Carlin B, et al. Pulmonary rehabilitation for adults with chronic respiratory disease: an official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2023 Aug 15;208(4):e7-26.
https://www.atsjournals.org/doi/10.1164/rccm.202306-1066ST
http://www.ncbi.nlm.nih.gov/pubmed/37581410?tool=bestpractice.com
[194]Man W, Chaplin E, Daynes E, et al. British Thoracic Society Clinical Statement on pulmonary rehabilitation. Thorax. 2023 Oct;78(suppl 5):s2-15.
https://thorax.bmj.com/content/78/Suppl_5/s2
http://www.ncbi.nlm.nih.gov/pubmed/37770084?tool=bestpractice.com
As diretrizes GOLD recomendam a reabilitação pulmonar para os pacientes com carga de sintomas elevada e risco de exacerbação (ou seja, grupos B e E).[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
A reabilitação pulmonar alivia a dispneia e a fadiga, melhora a função emocional e estimula o senso de controle de maneira moderadamente relevante e clinicamente significativa.[195]McCarthy B, Casey D, Devane D, et al. Pulmonary rehabilitation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2015 Feb 23;(2):CD003793.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD003793.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/25705944?tool=bestpractice.com
A reabilitação pulmonar extensiva após uma internação hospitalar por exacerbação aguda da DPOC diminui o risco de nova internação, melhora a qualidade de vida relacionada à saúde e reduz a mortalidade.
[  ]
What are the effects of pulmonary rehabilitation after exacerbation in people with chronic obstructive pulmonary disease?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1650/fullMostre-me a resposta Há evidências que dão suporte ao início da reabilitação pulmonar dentro de 1 mês a partir de uma exacerbação aguda.[196]Marciniuk DD, Brooks D, Butcher S, et al. Canadian Thoracic Society COPD Committee Expert Working Group. Optimizing pulmonary rehabilitation in chronic obstructive pulmonary disease - practical issues: a Canadian Thoracic Society Clinical Practice Guideline. Can Respir J. 2010 Jul-Aug;17(4):159-68.
http://www.ncbi.nlm.nih.gov/pubmed/20808973?tool=bestpractice.com
[197]Puhan MA, Gimeno-Santos E, Cates CJ, et al. Pulmonary rehabilitation following exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2016 Dec 8;(12):CD005305.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD005305.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/27930803?tool=bestpractice.com
]
What are the effects of pulmonary rehabilitation after exacerbation in people with chronic obstructive pulmonary disease?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1650/fullMostre-me a resposta Há evidências que dão suporte ao início da reabilitação pulmonar dentro de 1 mês a partir de uma exacerbação aguda.[196]Marciniuk DD, Brooks D, Butcher S, et al. Canadian Thoracic Society COPD Committee Expert Working Group. Optimizing pulmonary rehabilitation in chronic obstructive pulmonary disease - practical issues: a Canadian Thoracic Society Clinical Practice Guideline. Can Respir J. 2010 Jul-Aug;17(4):159-68.
http://www.ncbi.nlm.nih.gov/pubmed/20808973?tool=bestpractice.com
[197]Puhan MA, Gimeno-Santos E, Cates CJ, et al. Pulmonary rehabilitation following exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2016 Dec 8;(12):CD005305.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD005305.pub4/full
http://www.ncbi.nlm.nih.gov/pubmed/27930803?tool=bestpractice.com
Um grande estudo de coorte realizado nos EUA constatou que o início da reabilitação pulmonar em até 90 dias após a alta hospitalar foi significativamente associado com um risco mais baixo de mortalidade a 1 ano e um número menor de novas hospitalizações a 1 ano.[198]Lindenauer PK, Stefan MS, Pekow PS, et al. Association between initiation of pulmonary rehabilitation after hospitalization for COPD and 1-year survival among medicare beneficiaries. JAMA. 2020 May 12;323(18):1813-23.
https://jamanetwork.com/journals/jama/fullarticle/2765730
http://www.ncbi.nlm.nih.gov/pubmed/32396181?tool=bestpractice.com
[199]Stefan MS, Pekow PS, Priya A, et al. Association between initiation of pulmonary rehabilitation and rehospitalizations in patients hospitalized with chronic obstructive pulmonary disease. Am J Respir Crit Care Med. 2021 Nov 1;204(9):1015-23.
https://www.atsjournals.org/doi/10.1164/rccm.202012-4389OC
http://www.ncbi.nlm.nih.gov/pubmed/34283694?tool=bestpractice.com
Menos de 2% dos pacientes do coorte iniciaram a reabilitação nesse período, o que ressaltou a necessidade de se desenvolverem estratégias mais eficazes para incentivar a participação dos pacientes.[198]Lindenauer PK, Stefan MS, Pekow PS, et al. Association between initiation of pulmonary rehabilitation after hospitalization for COPD and 1-year survival among medicare beneficiaries. JAMA. 2020 May 12;323(18):1813-23.
https://jamanetwork.com/journals/jama/fullarticle/2765730
http://www.ncbi.nlm.nih.gov/pubmed/32396181?tool=bestpractice.com
No entanto, o início da reabilitação pulmonar antes da alta hospitalar pode ser associado a uma taxa mais alta de mortalidade a 12 meses; por isso, não é recomendado.[200]Greening NJ, Williams JE, Hussain SF, et al. An early rehabilitation intervention to enhance recovery during hospital admission for an exacerbation of chronic respiratory disease: randomised controlled trial. BMJ. 2014 Jul 8;349:g4315.
https://www.bmj.com/content/349/bmj.g4315
http://www.ncbi.nlm.nih.gov/pubmed/25004917?tool=bestpractice.com
A reabilitação pulmonar também reduz a depressão e a ansiedade relacionadas com a DPOC, bem como a hospitalização.[201]Casaburi R, ZuWallack R. Pulmonary rehabilitation for management of chronic obstructive pulmonary disease. N Engl J Med. 2009 Mar 26;360(13):1329-35.
http://www.ncbi.nlm.nih.gov/pubmed/19321869?tool=bestpractice.com
Os benefícios da reabilitação pulmonar parecem diminuir após o término do ciclo, a menos que os pacientes sigam um programa de exercícios em casa.[202]Guell R, Casan P, Belda J, et al. Long-term effects of outpatient rehabilitation of COPD: a randomized trial. Chest. 2000 Apr;117(4):976-83.
http://www.ncbi.nlm.nih.gov/pubmed/10767227?tool=bestpractice.com
A reabilitação pulmonar de manutenção, definida como exercícios supervisionados contínuos em menor frequência que o programa de reabilitação original, pode ter um papel na preservação dos benefícios da reabilitação pulmonar ao longo do tempo. Achados de uma revisão Cochrane indicam que os programas de manutenção supervisionados podem melhorar a qualidade de vida relacionada à saúde e a capacidade de exercício em 6 a 12 meses, em comparação com os cuidados habituais.[203]Malaguti C, Dal Corso S, Janjua S, et al. Supervised maintenance programmes following pulmonary rehabilitation compared to usual care for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2021 Aug 17;(8):CD013569.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013569.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/34404111?tool=bestpractice.com
[  ]
For people with chronic obstructive pulmonary disease (COPD), what are the effects of a supervised maintenance program after pulmonary rehabilitation?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4228/fullMostre-me a resposta
]
For people with chronic obstructive pulmonary disease (COPD), what are the effects of a supervised maintenance program after pulmonary rehabilitation?/cca.html?targetUrl=https://www.cochranelibrary.com/cca/doi/10.1002/cca.4228/fullMostre-me a resposta
Os benefícios da reabilitação pulmonar domiciliar ou comunitária, no que diz respeito aos sintomas respiratórios e à qualidade de vida em pacientes com DPOC, podem ser iguais aos dos programas de reabilitação realizados no hospital.[204]Maltais F, Bourbeau J, Shapiro S, et al. Effects of home-based pulmonary rehabilitation in patients with chronic obstructive pulmonary disease: a randomized trial. Ann Intern Med. 2008 Dec 16;149(12):869-78.
http://www.ncbi.nlm.nih.gov/pubmed/19075206?tool=bestpractice.com
[205]Neves LF, Reis MH, Gonçalves TR. Home or community-based pulmonary rehabilitation for individuals with chronic obstructive pulmonary disease: a systematic review and meta-analysis. Cad Saude Publica. 2016 Jun 20;32(6):S0102-311X2016000602001.
http://www.scielo.br/scielo.php?script=sci_arttext&pid=S0102-311X2016000602001&lng=en&nrm=iso&tlng=en
http://www.ncbi.nlm.nih.gov/pubmed/27333130?tool=bestpractice.com
[206]Holland AE, Mahal A, Hill CJ, et al. Home-based rehabilitation for COPD using minimal resources: a randomised, controlled equivalence trial. Thorax. 2017 Jan;72(1):57-65.
https://thorax.bmj.com/content/72/1/57
http://www.ncbi.nlm.nih.gov/pubmed/27672116?tool=bestpractice.com
Uma revisão Cochrane concluiu que tanto a telerreabilitação primária quando a de manutenção alcançaram desfechos similares aos da reabilitação presencial, sem problemas de segurança. As limitações da revisão incluem um número reduzido de pacientes e heterogeneidade nos modelos de telerreabilitação.[207]Cox NS, Dal Corso S, Hansen H, et al. Telerehabilitation for chronic respiratory disease. Cochrane Database Syst Rev. 2021 Jan 29;(1):CD013040.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD013040.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/33511633?tool=bestpractice.com
Oxigenoterapia e suporte ventilatório
As diretrizes GOLD recomendam o uso de oxigenoterapia em longo prazo em pacientes estáveis que apresentam:[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
PaO₂ ≤7.3 kPa (55 mmHg) ou SaO₂ ≤88%, com ou sem hipercapnia confirmada duas vezes em um período de 3 semanas; ou
PaO₂ entre 7.3 kPa (55 mmHg) e 8.0 kPa (60 mmHg), ou SaO₂ de 88%, se houver evidências de hipertensão pulmonar, edema periférico que sugira insuficiência cardíaca congestiva ou policitemia (hematócrito >55%).
As diretrizes da American Thoracic Society (ATS) recomendam a prescrição de oxigenoterapia em longo prazo por pelo menos 15 horas por dia nos adultos com DPOC que apresentem hipoxemia crônica grave em repouso. A ATS define a hipoxemia grave como:[208]Jacobs SS, Krishnan JA, Lederer DJ, et al. Home oxygen therapy for adults with chronic lung disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 Nov 15;202(10):e121-41. [Erratum in: Am J Respir Crit Care Med. 2021 Apr 15;203(8):1045-6.]
https://www.atsjournals.org/doi/10.1164/rccm.202009-3608ST
http://www.ncbi.nlm.nih.gov/pubmed/33185464?tool=bestpractice.com
PaO₂ ≤7.3 kPa (55 mmHg) ou saturação de oxigênio conforme medido pela oximetria de pulso (SpO₂) ≤88%; ou
PaO₂ de 7.5-7.9 kPa (56-59 mmHg) ou SpO₂ de 89% associada a um dos seguintes fatores: edema, hematócrito ≥55%, ou P pulmonale em um ECG.
Para os pacientes com prescrição de oxigenoterapia doméstica, a ATS recomenda que o paciente e seus cuidadores recebam instruções e treinamento sobre o uso e a manutenção de todos os equipamentos de oxigênio e informações sobre segurança em relação ao oxigênio, como o abandono do hábito de fumar, a prevenção de incêndios e o risco de tropeços.[208]Jacobs SS, Krishnan JA, Lederer DJ, et al. Home oxygen therapy for adults with chronic lung disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 Nov 15;202(10):e121-41. [Erratum in: Am J Respir Crit Care Med. 2021 Apr 15;203(8):1045-6.]
https://www.atsjournals.org/doi/10.1164/rccm.202009-3608ST
http://www.ncbi.nlm.nih.gov/pubmed/33185464?tool=bestpractice.com
O oxigênio suplementar deve ser ajustado para atingir uma SaO₂ ≥90%.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
O paciente deve ser reavaliado após 60-90 dias para determinar se o oxigênio ainda é indicado e terapêutico.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Entre as diferentes modalidades terapêuticas para DPOC, os únicos dois fatores que melhoram a sobrevida são o abandono do hábito de fumar e a suplementação de oxigênio.
A oxigenoterapia ajuda a minimizar a hipertensão pulmonar diminuindo a pressão arterial pulmonar; ela aumenta a tolerância aos exercícios e a qualidade de vida. Há relatos de que ela melhore a sobrevida.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[66]Qaseem A, Wilt TJ, Weinberger SE, et al. Diagnosis and management of stable chronic obstructive pulmonary disease: a clinical practice guideline update from the American College of Physicians, American College of Chest Physicians, American Thoracic Society, and European Respiratory Society. Ann Intern Med. 2011 Aug 2;155(3):179-91.
https://www.acpjournals.org/doi/10.7326/0003-4819-155-3-201108020-00008
http://www.ncbi.nlm.nih.gov/pubmed/21810710?tool=bestpractice.com
Há algumas evidências de que o oxigênio possa aliviar a dispneia quando administrado durante a realização de exercícios em pessoas levemente hipoxêmicas ou não hipoxêmicas com DPOC que não se qualifiquem para oxigenoterapia domiciliar.[209]Ekström M, Ahmadi Z, Bornefalk-Hermansson A, et al. Oxygen for breathlessness in patients with chronic obstructive pulmonary disease who do not qualify for home oxygen therapy. Cochrane Database Syst Rev. 2016 Nov 25;(11):CD006429.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD006429.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27886372?tool=bestpractice.com
A ATS sugere prescrever oxigênio ao movimento (fornecimento de oxigênio durante o exercício ou atividades da vida diária) para os adultos com DPOC que apresentem hipoxemia grave por esforço.[208]Jacobs SS, Krishnan JA, Lederer DJ, et al. Home oxygen therapy for adults with chronic lung disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 Nov 15;202(10):e121-41. [Erratum in: Am J Respir Crit Care Med. 2021 Apr 15;203(8):1045-6.]
https://www.atsjournals.org/doi/10.1164/rccm.202009-3608ST
http://www.ncbi.nlm.nih.gov/pubmed/33185464?tool=bestpractice.com
No entanto, a ATS não recomenda a prescrição de oxigenoterapia em longo prazo para adultos com DPOC que apresentem hipoxemia moderada crônica em repouso (SpO₂ de 89%-93%).[208]Jacobs SS, Krishnan JA, Lederer DJ, et al. Home oxygen therapy for adults with chronic lung disease. An official American Thoracic Society clinical practice guideline. Am J Respir Crit Care Med. 2020 Nov 15;202(10):e121-41. [Erratum in: Am J Respir Crit Care Med. 2021 Apr 15;203(8):1045-6.]
https://www.atsjournals.org/doi/10.1164/rccm.202009-3608ST
http://www.ncbi.nlm.nih.gov/pubmed/33185464?tool=bestpractice.com
As viagens aéreas são seguras para a maioria dos pacientes que recebem oxigenoterapia em longo prazo, embora os pacientes devam ser capazes de tolerar períodos curtos sem oxigênio, pois é provável que não esteja disponível em alguns momentos.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[210]British Thoracic Society. Air travel. Mar 2022 [internet publication].
https://www.brit-thoracic.org.uk/quality-improvement/clinical-statements/air-travel
Os pacientes com SaO₂ >95% ao nível do mar e SaO₂ ≥84% após um teste de marcha de 6 minutos podem viajar de avião sem avaliação adicional.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[210]British Thoracic Society. Air travel. Mar 2022 [internet publication].
https://www.brit-thoracic.org.uk/quality-improvement/clinical-statements/air-travel
[211]Edvardsen A, Akerø A, Christensen CC, et al. Air travel and chronic obstructive pulmonary disease: a new algorithm for pre-flight evaluation. Thorax. 2012 Nov;67(11):964-9.
https://thorax.bmj.com/content/67/11/964
http://www.ncbi.nlm.nih.gov/pubmed/22767877?tool=bestpractice.com
O oxigênio suplementar é recomendado para os pacientes com SaO₂ 92% a 95% ao nível do mar e SaO₂ <84% após um teste de marcha de 6 minutos, e para os pacientes com SaO₂ <92% ao nível do mar.[211]Edvardsen A, Akerø A, Christensen CC, et al. Air travel and chronic obstructive pulmonary disease: a new algorithm for pre-flight evaluation. Thorax. 2012 Nov;67(11):964-9.
https://thorax.bmj.com/content/67/11/964
http://www.ncbi.nlm.nih.gov/pubmed/22767877?tool=bestpractice.com
Testes de simulação de hipóxia em altitude (também conhecidos como testes de desafio hipóxico) devem ser realizados para os outros pacientes.[210]British Thoracic Society. Air travel. Mar 2022 [internet publication].
https://www.brit-thoracic.org.uk/quality-improvement/clinical-statements/air-travel
[211]Edvardsen A, Akerø A, Christensen CC, et al. Air travel and chronic obstructive pulmonary disease: a new algorithm for pre-flight evaluation. Thorax. 2012 Nov;67(11):964-9.
https://thorax.bmj.com/content/67/11/964
http://www.ncbi.nlm.nih.gov/pubmed/22767877?tool=bestpractice.com
Para os pacientes que recebem oxigenoterapia em longo prazo, a British Thoracic Society recomenda considerar oxigênio a bordo a 2L/minuto a mais em relação à prescrição habitual do paciente.[210]British Thoracic Society. Air travel. Mar 2022 [internet publication].
https://www.brit-thoracic.org.uk/quality-improvement/clinical-statements/air-travel
Para os pacientes com DPOC e apneia obstrutiva do sono, o suporte ventilatório com pressão positiva contínua nas vias aéreas (CPAP) pode melhorar a sobrevida e reduzir as internações hospitalares.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[73]Marin JM, Soriano JB, Carrizo SJ, et al. Outcomes in patients with chronic obstructive pulmonary disease and obstructive sleep apnea: the overlap syndrome. Am J Respir Crit Care Med. 2010 Aug 1;182(3):325-31.
https://www.atsjournals.org/doi/10.1164/rccm.200912-1869OC
http://www.ncbi.nlm.nih.gov/pubmed/20378728?tool=bestpractice.com
A ventilação não invasiva (VNI) é usada ocasionalmente nos pacientes com DPOC muito grave, porém estável, embora o momento ideal de início e os melhores critérios de seleção dos candidatos não estejam claros.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[212]Wilson ME, Dobler CC, Morrow AS, et al. Association of home noninvasive positive pressure ventilation with clinical outcomes in chronic obstructive pulmonary disease: a systematic review and meta-analysis. JAMA. 2020 Feb 4;323(5):455-65.
https://jamanetwork.com/journals/jama/fullarticle/2760390
http://www.ncbi.nlm.nih.gov/pubmed/32016309?tool=bestpractice.com
[213]Raveling T, Vonk J, Struik FM, et al. Chronic non-invasive ventilation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2021 Aug 9;(8):CD002878.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002878.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/34368950?tool=bestpractice.com
Uma revisão Cochrane constatou que a VNI crônica via máscara facial melhorou a sobrevida e proporcionou qualidade de vida relacionada à saúde na DPOC estável. A VNI crônica também melhorou a duração da sobrevida livre de internações hospitalares em pacientes com hipercapnia persistente após uma exacerbação.[213]Raveling T, Vonk J, Struik FM, et al. Chronic non-invasive ventilation for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2021 Aug 9;(8):CD002878.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD002878.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/34368950?tool=bestpractice.com
Outro estudo relatou uma queda significativa na frequência de exacerbação com VNI em comparação com a terapia de controle, embora nenhuma melhora tenha sido observada na mortalidade, PaO₂, PaCO₂ ou pH.[214]He X, Luo L, Ma Y, et al. Efficacy of domiciliary noninvasive ventilation on clinical outcomes in posthospital chronic obstructive pulmonary disease patients: a meta-analysis of randomized controlled trials. Ann Palliat Med. 2021 May;10(5):5137-45.
http://www.ncbi.nlm.nih.gov/pubmed/33977751?tool=bestpractice.com
As diretrizes da ATS sugerem o uso de VNI noturna em associação com os cuidados habituais para os pacientes com DPOC crônica estável hipercápnica.[215]Macrea M, Oczkowski S, Rochwerg B, et al. Long-term noninvasive ventilation in chronic stable hypercapnic chronic obstructive pulmonary disease. An official American Thoracic Society clinical practice fuideline. Am J Respir Crit Care Med. 2020 Aug 15;202(4):e74-87.
https://www.atsjournals.org/doi/10.1164/rccm.202006-2382ST
http://www.ncbi.nlm.nih.gov/pubmed/32795139?tool=bestpractice.com
A European Respiratory Society e a Canadian Thoracic Society emitiram orientações similares.[216]Ergan B, Oczkowski S, Rochwerg B, et al. European Respiratory Society guidelines on long-term home non-invasive ventilation for management of COPD. Eur Respir J. 2019 Sep 28;54(3):1901003.
https://erj.ersjournals.com/content/54/3/1901003
http://www.ncbi.nlm.nih.gov/pubmed/31467119?tool=bestpractice.com
[217]Kaminska M, Rimmer KP, McKim DA, et al. Long-term non-invasive ventilation in patients with chronic obstructive pulmonary disease (COPD): 2021 Canadian Thoracic Society clinical practice guideline update. Can J Respir Crit Care Sleep Med. 2021 May 7;5(3):160-83.
https://www.tandfonline.com/doi/full/10.1080/24745332.2021.1911218
Cirurgia
As intervenções cirúrgicas são o último passo no tratamento da DPOC e incluem bulectomia, cirurgia redutora de volume pulmonar e transplante de pulmão.[218]van Agteren JE, Hnin K, Grosser D, et al. Bronchoscopic lung volume reduction procedures for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017 Feb 23;(2):CD012158.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012158.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/28230230?tool=bestpractice.com
[219]van Agteren JE, Carson KV, Tiong LU, et al. Lung volume reduction surgery for diffuse emphysema. Cochrane Database Syst Rev. 2016 Oct 14;(10):CD001001.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001001.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27739074?tool=bestpractice.com
[  ]
How does bronchoscopic lung volume reduction compare with medical therapy in people with chronic obstructive pulmonary disease?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1680/fullMostre-me a resposta Elas são usadas para melhorar a dinâmica pulmonar, a adesão a exercícios físicos e a qualidade de vida.[219]van Agteren JE, Carson KV, Tiong LU, et al. Lung volume reduction surgery for diffuse emphysema. Cochrane Database Syst Rev. 2016 Oct 14;(10):CD001001.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001001.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27739074?tool=bestpractice.com
A cirurgia redutora do volume pulmonar é indicada para pacientes com limitação muito grave do fluxo aéreo e, especialmente, em pacientes com doença localizada no lobo superior e capacidade para exercícios abaixo do normal.[218]van Agteren JE, Hnin K, Grosser D, et al. Bronchoscopic lung volume reduction procedures for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017 Feb 23;(2):CD012158.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012158.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/28230230?tool=bestpractice.com
[
]
How does bronchoscopic lung volume reduction compare with medical therapy in people with chronic obstructive pulmonary disease?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1680/fullMostre-me a resposta Elas são usadas para melhorar a dinâmica pulmonar, a adesão a exercícios físicos e a qualidade de vida.[219]van Agteren JE, Carson KV, Tiong LU, et al. Lung volume reduction surgery for diffuse emphysema. Cochrane Database Syst Rev. 2016 Oct 14;(10):CD001001.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001001.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27739074?tool=bestpractice.com
A cirurgia redutora do volume pulmonar é indicada para pacientes com limitação muito grave do fluxo aéreo e, especialmente, em pacientes com doença localizada no lobo superior e capacidade para exercícios abaixo do normal.[218]van Agteren JE, Hnin K, Grosser D, et al. Bronchoscopic lung volume reduction procedures for chronic obstructive pulmonary disease. Cochrane Database Syst Rev. 2017 Feb 23;(2):CD012158.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD012158.pub2/full
http://www.ncbi.nlm.nih.gov/pubmed/28230230?tool=bestpractice.com
[  ]
How does bronchoscopic lung volume reduction compare with medical therapy in people with chronic obstructive pulmonary disease?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1680/fullMostre-me a resposta Uma metanálise constatou um aumento do risco de mortalidade precoce em pacientes submetidos a cirurgia redutora do volume pulmonar, em comparação com a assistência padrão; no entanto, nenhuma diferença significativa foi observada na mortalidade geral.[220]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.
http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com
A bulectomia é uma opção para os pacientes de DPOC com dispneia nos quais a TC revelar bolhas grandes ocupando ao menos 30% do hemitórax. Um status funcionais gravemente comprometido e uma diminuição grave do VEF₁ (<500 mL) tornam estas opções menos favoráveis. A inserção de válvulas endobrônquicas pode produzir melhoras clinicamente significativas em pacientes com DPOC adequadamente selecionados.[220]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.
http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com
[221]Klooster K, Slebos DJ, Zoumot Z, et al. Endobronchial valves for emphysema: an individual patient-level reanalysis of randomised controlled trials. BMJ Open Respir Res. 2017 Nov 2;4(1):e000214.
https://bmjopenrespres.bmj.com/content/4/1/e000214
http://www.ncbi.nlm.nih.gov/pubmed/29441206?tool=bestpractice.com
[222]Labarca G, Uribe JP, Pacheco C, et al. Bronchoscopic lung volume reduction with endobronchial zephyr valves for severe emphysema: a systematic review and meta-analysis. Respiration. 2019 May 22;98(3):268-78.
http://www.ncbi.nlm.nih.gov/pubmed/31117102?tool=bestpractice.com
O procedimento pode ser mais benéfico nos pacientes cuja dispneia decorre principalmente da hiperinsuflação e do aprisionamento de ar nos espaços aéreos distais dos bronquíolos terminais, o que se manifesta como enfisema com volume residual acentuadamente aumentado. As contraindicações incluem infecção pulmonar ativa e fissuras lobares incompletas (<80%).[223]Abia-Trujillo D, Johnson MM, Patel NM, et al. Bronchoscopic lung volume reduction: a new hope for patients with severe emphysema and air trapping. Mayo Clin Proc. 2021 Feb;96(2):464-72.
http://www.ncbi.nlm.nih.gov/pubmed/32829903?tool=bestpractice.com
Os eventos adversos mais comuns associados com a inserção da valva endobrônquica são pneumotórax e exacerbação.[220]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.
http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com
]
How does bronchoscopic lung volume reduction compare with medical therapy in people with chronic obstructive pulmonary disease?/cca.html?targetUrl=https://cochranelibrary.com/cca/doi/10.1002/cca.1680/fullMostre-me a resposta Uma metanálise constatou um aumento do risco de mortalidade precoce em pacientes submetidos a cirurgia redutora do volume pulmonar, em comparação com a assistência padrão; no entanto, nenhuma diferença significativa foi observada na mortalidade geral.[220]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.
http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com
A bulectomia é uma opção para os pacientes de DPOC com dispneia nos quais a TC revelar bolhas grandes ocupando ao menos 30% do hemitórax. Um status funcionais gravemente comprometido e uma diminuição grave do VEF₁ (<500 mL) tornam estas opções menos favoráveis. A inserção de válvulas endobrônquicas pode produzir melhoras clinicamente significativas em pacientes com DPOC adequadamente selecionados.[220]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.
http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com
[221]Klooster K, Slebos DJ, Zoumot Z, et al. Endobronchial valves for emphysema: an individual patient-level reanalysis of randomised controlled trials. BMJ Open Respir Res. 2017 Nov 2;4(1):e000214.
https://bmjopenrespres.bmj.com/content/4/1/e000214
http://www.ncbi.nlm.nih.gov/pubmed/29441206?tool=bestpractice.com
[222]Labarca G, Uribe JP, Pacheco C, et al. Bronchoscopic lung volume reduction with endobronchial zephyr valves for severe emphysema: a systematic review and meta-analysis. Respiration. 2019 May 22;98(3):268-78.
http://www.ncbi.nlm.nih.gov/pubmed/31117102?tool=bestpractice.com
O procedimento pode ser mais benéfico nos pacientes cuja dispneia decorre principalmente da hiperinsuflação e do aprisionamento de ar nos espaços aéreos distais dos bronquíolos terminais, o que se manifesta como enfisema com volume residual acentuadamente aumentado. As contraindicações incluem infecção pulmonar ativa e fissuras lobares incompletas (<80%).[223]Abia-Trujillo D, Johnson MM, Patel NM, et al. Bronchoscopic lung volume reduction: a new hope for patients with severe emphysema and air trapping. Mayo Clin Proc. 2021 Feb;96(2):464-72.
http://www.ncbi.nlm.nih.gov/pubmed/32829903?tool=bestpractice.com
Os eventos adversos mais comuns associados com a inserção da valva endobrônquica são pneumotórax e exacerbação.[220]van Geffen WH, Slebos DJ, Herth FJ, et al. Surgical and endoscopic interventions that reduce lung volume for emphysema: a systemic review and meta-analysis. Lancet Respir Med. 2019 Apr;7(4):313-24.
http://www.ncbi.nlm.nih.gov/pubmed/30744937?tool=bestpractice.com
Os critérios de encaminhamento para transplante de pulmão incluem:[224]Leard LE, Holm AM, Valapour M, et al. Consensus document for the selection of lung transplant candidates: an update from the International Society for Heart and Lung Transplantation. J Heart Lung Transplant. 2021 Nov;40(11):1349-79.
https://www.jhltonline.org/article/S1053-2498(21)02407-4/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/34419372?tool=bestpractice.com
Índice de massa corporal, obstrução do fluxo aéreo, dispneia e índice de exercício (BODE) de 5-6 com fatores adicionais que sugerem aumento do risco de mortalidade:
Exacerbações agudas frequentes
Aumento no índice BODE >1 nos últimos 24 meses
Diâmetro da artéria pulmonar para a aorta >1 na TC
VEF₁ de 20% a 25% do predito
Deterioração clínica apesar de tratamento máximo, incluindo medicação, reabilitação pulmonar, oxigenoterapia e, conforme adequado, ventilação não invasiva com pressão positiva noturna
Qualidade de vida baixa, inaceitável para o paciente
Para um paciente candidato a redução do volume pulmonar (RVP) cirúrgica ou broncoscópica, o encaminhamento simultâneo para transplante de pulmão e avaliação para CRVP é adequado
[
Índice BODE para predição de sobrevida na DPOC
Opens in new window
]
O transplante pulmonar demonstrou aumentar a qualidade de vida e a capacidade funcional.[219]van Agteren JE, Carson KV, Tiong LU, et al. Lung volume reduction surgery for diffuse emphysema. Cochrane Database Syst Rev. 2016 Oct 14;(10):CD001001.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD001001.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27739074?tool=bestpractice.com
No entanto, o transplante pulmonar parece não conferir um benefício de sobrevida.[225]Stavem K, Bjørtuft Ø, Borgan Ø, et al. Lung transplantation in patients with chronic obstructive pulmonary disease in a national cohort is without obvious survival benefit. J Heart Lung Transplant. 2006 Jan;25(1):75-84.
http://www.ncbi.nlm.nih.gov/pubmed/16399534?tool=bestpractice.com
Cuidados paliativos
Terapias paliativas para melhorar os sintomas de dispneia, oferecer suporte nutricional, tratar a ansiedade e a depressão e reduzir a fadiga podem beneficiar pacientes com DPOC que apresentem esses sintomas apesar da terapia medicamentosa ideal. Cuidados no final da vida e internações em hospices devem ser considerados para pacientes com doença muito avançada. Os pacientes e famílias devem ser muito bem educados sobre o processo, e sugere-se que esse assunto seja discutido precocemente durante a evolução da doença antes do desenvolvimento de insuficiência respiratória aguda.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
[226]Janssen DJA, Bajwah S, Boon MH, et al. European Respiratory Society clinical practice guideline: palliative care for people with COPD or interstitial lung disease. Eur Respir J. 2023 Aug;62(2):2202014.
https://erj.ersjournals.com/content/62/2/2202014
http://www.ncbi.nlm.nih.gov/pubmed/37290789?tool=bestpractice.com
Analgésicos opioides, ventilação, estimulação elétrica neuromuscular e vibração da parede torácica podem aliviar a dispneia.[1]Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management, and prevention of chronic obstructive pulmonary disease: 2025 report. 2025 [internet publication].
https://goldcopd.org/2025-gold-report
Um estudo sugeriu que baixas doses de um analgésico opioide e de um benzodiazepínico são seguras e não estão associadas a aumento das internações hospitalares ou da mortalidade.[227]Ekström MP, Bornefalk-Hermansson A, Abernethy AP, et al. Safety of benzodiazepines and opioids in very severe respiratory disease: national prospective study. BMJ. 2014 Jan 30;348:g445.
https://www.bmj.com/content/348/bmj.g445.long
http://www.ncbi.nlm.nih.gov/pubmed/24482539?tool=bestpractice.com
Outro estudo revelou que a morfina oral de liberação sustentada regular, em baixa dosagem, por 4 semanas, melhorou o estado de saúde específico da doença em pacientes com DPOC e dispneia refratária.[228]Verberkt CA, van den Beuken-van Everdingen MHJ, Schols JMGA, et al. Effect of sustained-release morphine for refractory breathlessness in chronic obstructive pulmonary disease on health status: a randomized clinical trial. JAMA Intern Med. 2020 Oct 1;180(10):1306-14.
https://jamanetwork.com/journals/jamainternalmedicine/fullarticle/2769373
http://www.ncbi.nlm.nih.gov/pubmed/32804188?tool=bestpractice.com
Uma revisão Cochrane concluiu não haver nenhuma evidência contra ou a favor dos benzodiazepínicos para o alívio da dispneia em pacientes com câncer avançado e DPOC.[229]Simon ST, Higginson IJ, Booth S, et al. Benzodiazepines for the relief of breathlessness in advanced malignant and non-malignant diseases in adults. Cochrane Database Syst Rev. 2016 Oct 20;(10):CD007354.
https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD007354.pub3/full
http://www.ncbi.nlm.nih.gov/pubmed/27764523?tool=bestpractice.com
A acupuntura e a acupressão também podem melhorar a dispneia e a qualidade de vida em pacientes com DPOC avançada.[230]von Trott P, Oei SL, Ramsenthaler C. Acupuncture for breathlessness in advanced diseases: a systematic review and meta-analysis. J Pain Symptom Manage. 2020 Feb;59(2):327-38.e3.
http://www.ncbi.nlm.nih.gov/pubmed/31539602?tool=bestpractice.com
 ]
[Evidência A]
]
[Evidência A]

 ]
Os LAMAs mais recentes, tais como o aclidínio, o glicopirrônio e o umeclidínio, têm uma eficácia pelo menos comparável à do tiotrópio, em termos de mudança em relação ao VEF₁ de vale, ao escore focal do índice de dispneia transitória, ao escore St George's Respiratory Questionnaire e ao uso de medicações de resgate basais.[100] A revefenacina é um LAMA nebulizado aprovado para o tratamento de manutenção da DPOC moderada a grave. Há uma sugestão de aumento na mortalidade relacionada a doenças cardiovasculares em alguns estudos de pacientes que utilizam antagonistas muscarínicos de ação curta e em alguns estudos de pacientes que fazem uso de LAMAs.[101][102] Um estudo concluiu que o aclidínio não esteve associado a nenhum aumento nos eventos adversos cardiovasculares importantes, em comparação com o placebo.[103] Um estudo de coorte de base populacional constatou que homens mais velhos com DPOC recém-iniciados no uso de LAMAs têm maior risco de infecções do trato urinário.[104]
]
Os LAMAs mais recentes, tais como o aclidínio, o glicopirrônio e o umeclidínio, têm uma eficácia pelo menos comparável à do tiotrópio, em termos de mudança em relação ao VEF₁ de vale, ao escore focal do índice de dispneia transitória, ao escore St George's Respiratory Questionnaire e ao uso de medicações de resgate basais.[100] A revefenacina é um LAMA nebulizado aprovado para o tratamento de manutenção da DPOC moderada a grave. Há uma sugestão de aumento na mortalidade relacionada a doenças cardiovasculares em alguns estudos de pacientes que utilizam antagonistas muscarínicos de ação curta e em alguns estudos de pacientes que fazem uso de LAMAs.[101][102] Um estudo concluiu que o aclidínio não esteve associado a nenhum aumento nos eventos adversos cardiovasculares importantes, em comparação com o placebo.[103] Um estudo de coorte de base populacional constatou que homens mais velhos com DPOC recém-iniciados no uso de LAMAs têm maior risco de infecções do trato urinário.[104] ]
[Evidência A] Nos casos de DPOC estável, se a decisão tomada for o uso de monoterapia, os agentes LAMA podem ser superiores aos agentes BALD.[105] Os LAMAs têm maior efeito na redução das exacerbações do que os BALDs em pacientes com DPOC moderada a muito grave.[106][107] A segurança em longo prazo dos LAMAs foi demonstrada no ensaio clínico UPLIFT.[108]
]
[Evidência A] Nos casos de DPOC estável, se a decisão tomada for o uso de monoterapia, os agentes LAMA podem ser superiores aos agentes BALD.[105] Os LAMAs têm maior efeito na redução das exacerbações do que os BALDs em pacientes com DPOC moderada a muito grave.[106][107] A segurança em longo prazo dos LAMAs foi demonstrada no ensaio clínico UPLIFT.[108] ]
]
 ]
]
 ]
Uma revisão sistemática e metanálise em rede constatou que todas as combinações com doses fixas de BALD/LAMA tiveram eficácia e segurança semelhantes.[115]
]
Uma revisão sistemática e metanálise em rede constatou que todas as combinações com doses fixas de BALD/LAMA tiveram eficácia e segurança semelhantes.[115] ]
Esse risco é superior para a fluticasona em comparação com a budesonida.[122][123][124] Um estudo em uma grande coorte de pacientes dinamarqueses revelou que o risco de adquirir Pseudomonas aeruginosa, uma causa comum de pneumonia hospitalar, é dose-dependente, com os CIs em altas doses associados ao maior risco. O estudo também revelou que os pacientes com P aeruginosa tiveram maior probabilidade de terem um IMC e um VEF₁ mais baixos que os pacientes negativos para P aeruginosa.[125] Uma revisão sistemática e metanálise constatou que, apesar de um aumento significativo do risco não ajustado de pneumonia associada ao uso de CIs, as fatalidades por pneumonia e a mortalidade geral não aumentaram nos ensaios clínicos randomizados e controlados, e foram reduzidas nos estudos observacionais.[126] Portanto, deve-se implementar uma abordagem de tratamento individualizado que avalie o risco de um paciente ter pneumonia em relação ao benefício da diminuição das exacerbações.[85][127][128] Há, também, dúvidas com relação ao aumento dos riscos de tuberculose e gripe (influenza) em pacientes adultos com DPOC que estejam utilizando corticoterapia inalatória, embora uma metanálise tenha constatado que menos de 1% de todos os casos de tuberculose avaliados podiam ser atribuídos a exposição a CIs.[129][130] Os CIs podem também causar candidíase orofaríngea e rouquidão.[85]
[
]
Esse risco é superior para a fluticasona em comparação com a budesonida.[122][123][124] Um estudo em uma grande coorte de pacientes dinamarqueses revelou que o risco de adquirir Pseudomonas aeruginosa, uma causa comum de pneumonia hospitalar, é dose-dependente, com os CIs em altas doses associados ao maior risco. O estudo também revelou que os pacientes com P aeruginosa tiveram maior probabilidade de terem um IMC e um VEF₁ mais baixos que os pacientes negativos para P aeruginosa.[125] Uma revisão sistemática e metanálise constatou que, apesar de um aumento significativo do risco não ajustado de pneumonia associada ao uso de CIs, as fatalidades por pneumonia e a mortalidade geral não aumentaram nos ensaios clínicos randomizados e controlados, e foram reduzidas nos estudos observacionais.[126] Portanto, deve-se implementar uma abordagem de tratamento individualizado que avalie o risco de um paciente ter pneumonia em relação ao benefício da diminuição das exacerbações.[85][127][128] Há, também, dúvidas com relação ao aumento dos riscos de tuberculose e gripe (influenza) em pacientes adultos com DPOC que estejam utilizando corticoterapia inalatória, embora uma metanálise tenha constatado que menos de 1% de todos os casos de tuberculose avaliados podiam ser atribuídos a exposição a CIs.[129][130] Os CIs podem também causar candidíase orofaríngea e rouquidão.[85]
[  ]
]
 ]
Trata-se de uma alternativa conveniente que pode auxiliar na adesão terapêutica de alguns pacientes. A escolha da terapia desta classe baseia-se na disponibilidade, resposta e preferência individuais.[133] A combinação pode ser fornecida em inaladores separados ou um inalador combinado.
]
Trata-se de uma alternativa conveniente que pode auxiliar na adesão terapêutica de alguns pacientes. A escolha da terapia desta classe baseia-se na disponibilidade, resposta e preferência individuais.[133] A combinação pode ser fornecida em inaladores separados ou um inalador combinado. ]
]
 ]
Não há dados que demonstrem a eficácia ou a segurança do tratamento crônico com azitromicina por mais de 1 ano.
]
Não há dados que demonstrem a eficácia ou a segurança do tratamento crônico com azitromicina por mais de 1 ano. ]
O momento, os componentes, a duração e os modelos ideais para melhorar a atividade física permanecem pouco claros. Metanálises sugerem que ioga, Qigong e outros exercícios respiratórios realizados em casa podem melhorar a capacidade de exercício e a função pulmonar em pacientes com DPOC.[179][180][181] Ficou comprovado que o Tai Chi melhora a capacidade de exercício, em comparação com os cuidados habituais.[182]
]
O momento, os componentes, a duração e os modelos ideais para melhorar a atividade física permanecem pouco claros. Metanálises sugerem que ioga, Qigong e outros exercícios respiratórios realizados em casa podem melhorar a capacidade de exercício e a função pulmonar em pacientes com DPOC.[179][180][181] Ficou comprovado que o Tai Chi melhora a capacidade de exercício, em comparação com os cuidados habituais.[182] ]
Eles proporcionam uma pequena redução na frequência das exacerbações agudas e no número de dias de incapacidade por mês, mas não melhoram a função pulmonar nem a qualidade de vida.[190][191][192] A erdosteína e a carbocisteína não estão disponíveis nos EUA. O tratamento com agentes mucolíticos, como carbocisteína e acetilcisteína, pode reduzir as exacerbações e melhorar levemente o estado de saúde em pacientes que não fazem uso de CIs.[1] No entanto, a erdosteína pode ter um efeito significativo sobre as exacerbações leves, independentemente de o paciente estar ou não tomando CIs.[1]
]
Eles proporcionam uma pequena redução na frequência das exacerbações agudas e no número de dias de incapacidade por mês, mas não melhoram a função pulmonar nem a qualidade de vida.[190][191][192] A erdosteína e a carbocisteína não estão disponíveis nos EUA. O tratamento com agentes mucolíticos, como carbocisteína e acetilcisteína, pode reduzir as exacerbações e melhorar levemente o estado de saúde em pacientes que não fazem uso de CIs.[1] No entanto, a erdosteína pode ter um efeito significativo sobre as exacerbações leves, independentemente de o paciente estar ou não tomando CIs.[1] ]
Há evidências que dão suporte ao início da reabilitação pulmonar dentro de 1 mês a partir de uma exacerbação aguda.[196][197]
]
Há evidências que dão suporte ao início da reabilitação pulmonar dentro de 1 mês a partir de uma exacerbação aguda.[196][197] ]
]
 ]
Elas são usadas para melhorar a dinâmica pulmonar, a adesão a exercícios físicos e a qualidade de vida.[219] A cirurgia redutora do volume pulmonar é indicada para pacientes com limitação muito grave do fluxo aéreo e, especialmente, em pacientes com doença localizada no lobo superior e capacidade para exercícios abaixo do normal.[218]
[
]
Elas são usadas para melhorar a dinâmica pulmonar, a adesão a exercícios físicos e a qualidade de vida.[219] A cirurgia redutora do volume pulmonar é indicada para pacientes com limitação muito grave do fluxo aéreo e, especialmente, em pacientes com doença localizada no lobo superior e capacidade para exercícios abaixo do normal.[218]
[  ]
Uma metanálise constatou um aumento do risco de mortalidade precoce em pacientes submetidos a cirurgia redutora do volume pulmonar, em comparação com a assistência padrão; no entanto, nenhuma diferença significativa foi observada na mortalidade geral.[220] A bulectomia é uma opção para os pacientes de DPOC com dispneia nos quais a TC revelar bolhas grandes ocupando ao menos 30% do hemitórax. Um status funcionais gravemente comprometido e uma diminuição grave do VEF₁ (<500 mL) tornam estas opções menos favoráveis. A inserção de válvulas endobrônquicas pode produzir melhoras clinicamente significativas em pacientes com DPOC adequadamente selecionados.[220][221][222] O procedimento pode ser mais benéfico nos pacientes cuja dispneia decorre principalmente da hiperinsuflação e do aprisionamento de ar nos espaços aéreos distais dos bronquíolos terminais, o que se manifesta como enfisema com volume residual acentuadamente aumentado. As contraindicações incluem infecção pulmonar ativa e fissuras lobares incompletas (<80%).[223] Os eventos adversos mais comuns associados com a inserção da valva endobrônquica são pneumotórax e exacerbação.[220]
]
Uma metanálise constatou um aumento do risco de mortalidade precoce em pacientes submetidos a cirurgia redutora do volume pulmonar, em comparação com a assistência padrão; no entanto, nenhuma diferença significativa foi observada na mortalidade geral.[220] A bulectomia é uma opção para os pacientes de DPOC com dispneia nos quais a TC revelar bolhas grandes ocupando ao menos 30% do hemitórax. Um status funcionais gravemente comprometido e uma diminuição grave do VEF₁ (<500 mL) tornam estas opções menos favoráveis. A inserção de válvulas endobrônquicas pode produzir melhoras clinicamente significativas em pacientes com DPOC adequadamente selecionados.[220][221][222] O procedimento pode ser mais benéfico nos pacientes cuja dispneia decorre principalmente da hiperinsuflação e do aprisionamento de ar nos espaços aéreos distais dos bronquíolos terminais, o que se manifesta como enfisema com volume residual acentuadamente aumentado. As contraindicações incluem infecção pulmonar ativa e fissuras lobares incompletas (<80%).[223] Os eventos adversos mais comuns associados com a inserção da valva endobrônquica são pneumotórax e exacerbação.[220]






