Recomendações
Urgente
Este tópico aborda o tratamento da cetoacidose diabética (CAD) em adultos.
Inicie a administração de fluidoterapia intravenosa assim que a CAD for confirmada:[1][2][20][56][64]
Se a pressão arterial sistólica (PAS) inicial for <90 mmHg, administre fluido em bolus de 500 mL de soro fisiológico (cloreto de sódio a 0.9%) durante 10 a 15 minutos através de uma cânula de grosso calibre.[2]
Se a PAS permanecer <90 mmHg, repita os fluidos em bolus e peça ajuda a um colega mais experiente.[2]
Caso não haja melhora após a segunda administração de fluidos em bolus, repita a administração, solicite imediatamente uma avaliação de um profissional sênior e considere a possibilidade de envolver a equipe de terapia intensiva.[2]
Administre 1 litro de soro fisiológico durante 1 hora se a PAS inicial for >90 mmHg OU se a PAS for >90 mmHg após a ressuscitação fluídica.[2]
Administre fluídos com mais cautela e considere monitorar a pressão venosa central em pacientes que:[2]
são jovens (com idades entre 18 e 25 anos), idosos ou grávidas, ou
Apresentam insuficiência cardíaca ou renal ou outras comorbidades graves.
Adicione potássio ao segundo litro de fluidoterapia intravenosa se o potássio sérico for ≤5.0 mmol/L, usando soro fisiológico pré-misturado com cloreto de potássio.[1]
Inicie uma infusão intravenosa de insulina de taxa fixa (FRIII) de acordo com os protocolos locais; continue com FRIII até que a CAD seja resolvida.[1][2][20][56][64]
Continue com a insulina basal de ação prolongada (na dose e horário normais) se o paciente já estiver a utilizá-la.[2]
Certifique-se de que os fluidos intravenosos já tenham sido iniciados antes de administrar a infusão de insulina intravenosa a uma taxa fixa.
Se o nível de potássio for inferior a 3.5 mmol/L, a insulinoterapia deve ser adiada ou suspensa até que o nível de potássio seja corrigido para ≥3.5 mmol/L, a fim de evitar arritmias com risco de vida e fraqueza dos músculos respiratórios.[1]
Garanta o monitoramento cardíaco contínuo e envolva a assistência de profissionais mais experientes e cuidados intensivos se:[2][31]
Houver hipotensão persistente (PAS <90 mmHg) ou oligúria (produção de urina <0.5 ml/kg/hora) apesar da fluidoterapia intravenosa
Estupor e/ou coma ou Escala de Coma de Glasgow <12 [ Escala de coma de Glasgow Opens in new window ]
Cetonas sanguíneas (beta-hidroxibutirato [BOHB]) >6 mmol/L
Bicarbonato venoso <10 mmol/L
pH venoso <7,0
Potássio <3,5 mmol/L na admissão
Saturações de oxigênio <92% no ar ambiente
Pulso >100 bpm ou <60 bpm
Anion gap >16 [ Anion gap Opens in new window ]
A paciente está grávida ou tem insuficiência cardíaca ou renal ou outras comorbidades graves.
Identificar e tratar qualquer doença aguda que tenha desencadeado o quadro.[2]
Principais recomendações
Tratamento da cetoacidose diabética em adultos
[Figure caption and citation for the preceding image starts]: Tratamento da cetoacidose diabética 1. Fluido intravenosoPor BMJ Knowledge Centre [Citation ends].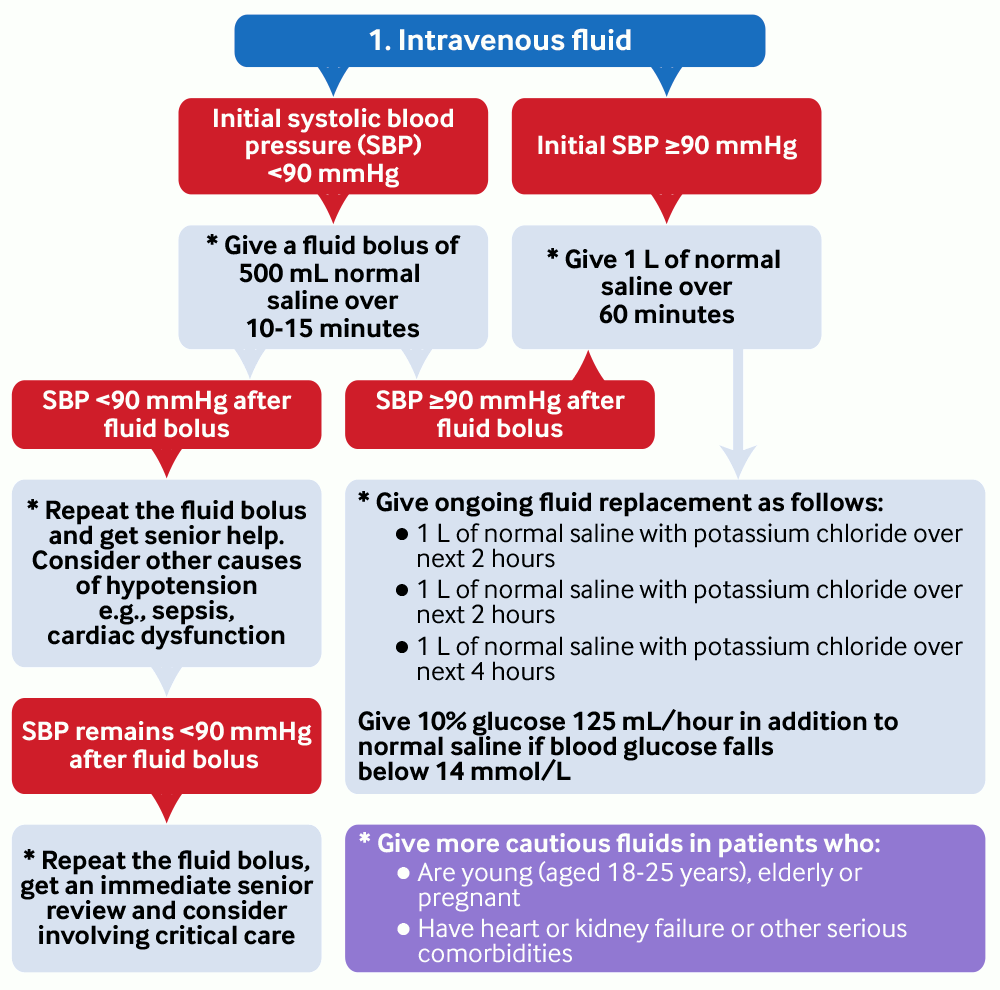 [Figure caption and citation for the preceding image starts]: Tratamento da cetoacidose diabética 2. PotássioCriado pelo BMJ Knowledge Centre [Citation ends].
[Figure caption and citation for the preceding image starts]: Tratamento da cetoacidose diabética 2. PotássioCriado pelo BMJ Knowledge Centre [Citation ends]. [Figure caption and citation for the preceding image starts]: Tratamento da cetoacidose diabética 3. InsulinaCriado pelo BMJ Knowledge Centre [Citation ends].
[Figure caption and citation for the preceding image starts]: Tratamento da cetoacidose diabética 3. InsulinaCriado pelo BMJ Knowledge Centre [Citation ends].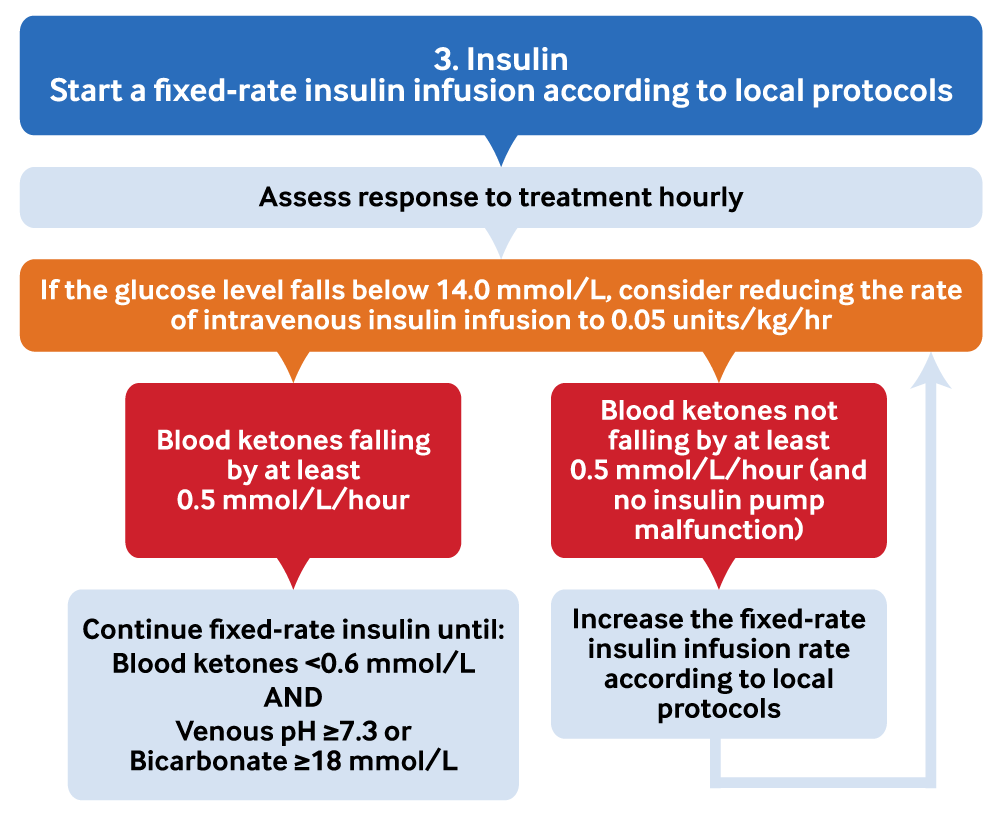 [Figure caption and citation for the preceding image starts]: Tratamento da cetoacidose diabética 4. ResoluçãoCriado pelo BMJ Knowledge Centre [Citation ends].
[Figure caption and citation for the preceding image starts]: Tratamento da cetoacidose diabética 4. ResoluçãoCriado pelo BMJ Knowledge Centre [Citation ends].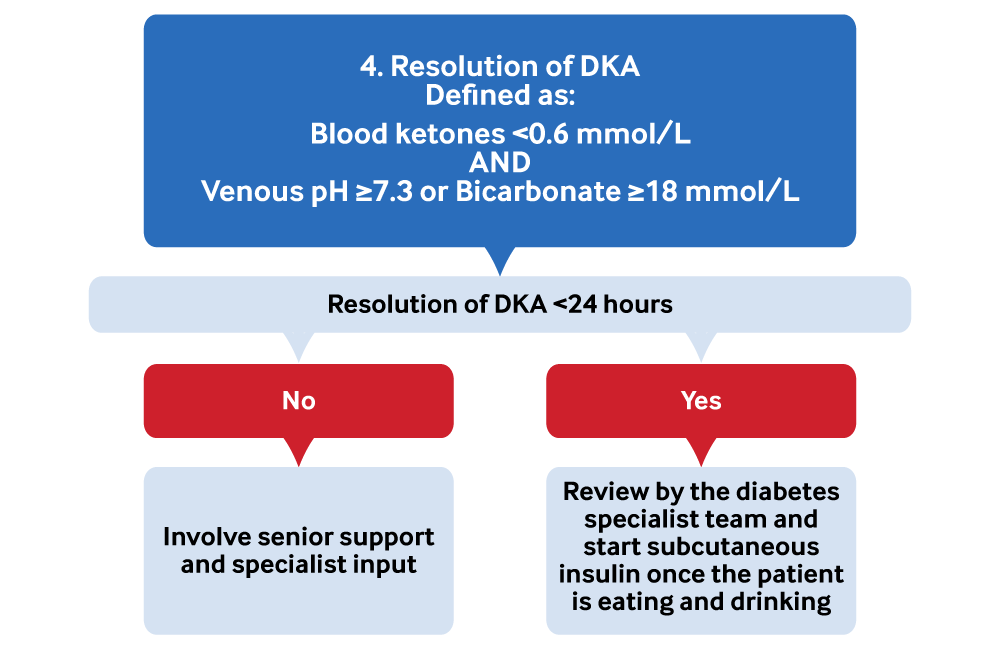
Gestão adicional durante a primeira hora
Proteja as vias aéreas.
Insira uma sonda nasogástrica e aspire se o paciente não responder aos comandos ou estiver vomitando persistentemente.[2][56]
Insira um cateter urinário se houver incontinência ou se não houver urina após 1 hora do início do tratamento.[2][56]
Continue com a insulina basal de ação prolongada se o paciente já a estiver tomando.[2]
Envolva a equipe especializada em diabetes o mais rápido possível e definitivamente, dentro de 24 horas.[2]
Manejo contínuo
Administre a reposição contínua de fluidos após a administração do primeiro litro.
Se o nível de potássio sérico for <3.5 mmol/L, procure atendimento médico especializado ou de cuidados intensivos pois uma dose elevada de potássio precisa ser administrada devido à gravidade da hipocalemia.[2]
A reposição de potássio é feita utilizando bolsas pré-misturadas de soro fisiológico contendo 20-40 mmol/L de cloreto de potássio.[2]
Para administrar uma dose total mais elevada, a velocidade de infusão desta solução contendo potássio pode ser aumentada, caso o equilíbrio hídrico do paciente o permita. Caso haja restrição de volume de fluidos, será necessária uma infusão de potássio mais concentrado.[2]
Se o potássio sérico estiver entre 3.5 e 5.0 mmol/L,adicione 20-40 mmol/L de potássio usando soro fisiológico pré-misturado (cloreto de sódio a 0.9%) com cloreto de potássio.[1][2][20][56] Consulte as diretrizes locais sobre a dosagem de potássio.
Se o nível de potássio sérico for >5.0 mmol/L, evite a administração de fluidoterapia intravenosa que contenha potássio e utilize soro fisiológico em vez disso.[1]
Um esquema típico de reposição de fluidos para um paciente de 70 kg sem outras comorbidades é:[2][56]
Volume de soro fisiológico normal (com cloreto de potássio, se necessário) |
|---|
1 litro em 2 horas |
1 litro nas 2 horas seguintes |
1 litro nas 4 horas seguintes |
1 litro nas 4 horas seguintes |
1 litro nas 6 horas seguintes |
Continue a infusão de insulina intravenosa a uma taxa fixa até que a CAD seja resolvida. Se a glicose sanguínea cair para <14 mmol/L:[1][2][20][56][64]
Adicione glicose a 5% ou 10%. Administre este medicamento juntamente com soro fisiológico para corrigir a desidratação.
Considere reduzir a taxa de infusão intravenosa de insulina para 0.05 unidades/kg/hora para evitar o risco de desenvolver hipoglicemia e hipocalemia.
Monitore os parâmetros bioquímicos para garantir que estejam melhorando.[2][56]
Meça bicarbonato venoso, potássio, pH, glicose no sangue e cetonas sanguíneas da seguinte forma:
Cetonas | Glicose | Bicarbonato | Potássio | potencial hidrogeniônico (pH) | |
|---|---|---|---|---|---|
| 0 hora | ✓ | ✓ | ✓ | ✓ | ✓ |
| 1 hora | ✓ | ✓ | ✓ | ✓ | ✓ |
| 2 horas | ✓ | ✓ | ✓ | ✓ | ✓ |
| 3 horas | ✓ | ✓ | |||
| 4 horas | ✓ | ✓ | ✓ | ✓ | ✓ |
| 5 horas | ✓ | ✓ | |||
| 6 horas | ✓ | ✓ | ✓ | ✓ | ✓ |
| 12 horas | ✓ | ✓ | ✓ | ✓ | ✓ |
Procure uma redução nas cetonas sanguíneas de 0,5 mmol/L/hora se a medição da cetona no sangue estiver disponível.[2]
Use a medição de bicarbonato venoso ou glicose sanguínea se a medição da cetona no sangue não estiver disponível. O objetivo é alcançar um aumento de 3 mmol/L/hora no bicarbonato venoso ou uma redução de 3 mmol/L/hora na glicose sanguínea.
Aumente a FRIII de acordo com os protocolos locais se essas metas não forem atingidas.
Monitorar edema cerebral e pulmonar.[2]
Avalie a escala de coma de Glasgow a cada hora.
Solicite uma radiografia torácica se as saturações de oxigênio caírem e considere realizar uma gasometria arterial.
Como obter uma amostra de sangue arterial da artéria radial.
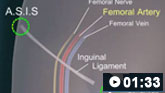
Como realizar uma punção da artéria femoral para coletar uma amostra de sangue arterial.
Resolução da CAD
Em 24 horas, a cetonemia e a acidose devem ter se resolvido. Caso contrário, procure a opinião de um profissional mais experiente ou de um especialista.[2] A resolução da CAD é definida como:[1]
Nível de cetona no sangue <0.6 mmol/L E
pH venoso ≥7.3 ou bicarbonato ≥18 mmol/L
Idealmente, a glicose plasmática também deve ser <11.1 mmol/L. Neste ponto, a dose de insulina pode ser reduzida em 50%.[1]
Mude para a insulina subcutânea assim que a CAD for resolvida e o paciente estiver comendo e bebendo. Isso normalmente deve ser feito pela equipe especializada em diabetes.[2]
Inicie a administração de insulina subcutânea com uma refeição e continue a infusão de insulina intravenosa a uma taxa fixa por 30 a 60 minutos após isso.
Continue com a fluidoterapia intravenosa e mude para uma infusão intravenosa de insulina de taxa variável se a CAD for resolvida, mas o paciente não estiver comendo e bebendo.[2]
Secreção
Certifique-se de que o paciente foi avaliado pela equipe de especialistas em diabetes antes da alta e que o acompanhamento foi agendado.[2]
Aconselhe os pacientes sobre as causas e os sintomas de alerta precoce da CAD. Forneça acesso a apoio psicológico.
O tratamento deve ter como objetivo:[2][64]
Restauração do volume circulatório
Supressão da cetogênese
Correção do desequilíbrio eletrolítico
Normalização da glicose sanguínea
Tratamento da causa precipitante e evite complicações.
Practical tip
Este tópico aborda a CAD em adultos. Lembre-se de que pessoas de 16 a 18 anos de idade podem ser tratadas por uma equipe pediátrica ou por uma equipe médica para adultos, de acordo com a disponibilidade local. A diretriz da Joint British Diabetes Societies for Inpatient Care (JBDS-IP) recomenda seguir as diretrizes pediátricas se o paciente estiver sendo acompanhado por uma equipe pediátrica e seguir as diretrizes para adultos se estiver sendo acompanhado por uma equipe de adultos.[2][3]
No Reino Unido, a British Society for Paediatric Endocrinology and Diabetes publica orientações para o tratamento da CAD em crianças.[3]
Proteja as vias aéreas.
Insira uma sonda nasogástrica e aspire se o paciente não responder aos comandos ou vomitar persistentemente.[2][56]
A aspiração é uma complicação comum da CAD devido à gastroparesia.[56][132]
Insira uma cânula de grande diâmetro e inicie a fluidoterapia intravenosa assim que a CAD for confirmada.[2][64]
Procure ajuda imediata de cuidados intensivos se não conseguir acesso intravenoso.[2]
Como inserir uma cânula venosa periférica no dorso da mão.
Administre fluídos em bolus de 500 mL de soro fisiológico (0.9% de cloreto de sódio) por 10-15 minutos se a PAS inicial for <90 mmHg.[2]
Repita o fluído em bolus se a PAS permanecer <90 mmHg e procure assistência de um colega mais experiente.[2]
Repita o fluído em bolus, solicite uma avaliação imediata de um colega mais experiente e considere envolver a equipe de cuidados intensivos se não houver melhora após a segunda administração de fluído em bolus.
Considere outras causas de hipotensão (por exemplo, sepse, insuficiência cardíaca, infarto agudo do miocárdio).[2]
Practical tip
A maioria dos pacientes com CAD e PAS inicial <90 mmHg necessita de 500 a 1000 mL de fluidos rapidamente após a chegada ao hospital.[2]
Mais informações: tratamento da CAD leve/moderada
Verifique seus protocolos locais para obter recomendações sobre o tratamento da CAD leve.
Globalmente, existem diferenças no manejo entre os países, refletindo o acesso aos recursos de saúde, variações nos critérios de diagnóstico e a falta de evidências publicadas para orientar o tratamento.[20]
Na prática do Reino Unido, é provável que todos os pacientes com CAD, independentemente da gravidade, sejam internados no hospital. De forma notável, um relatório de consenso de 2024 das American Diabetes Association (ADA), European Association for the Study of Diabetes(EASD), JBDS-IP, American Association of Clinical Endocrinology (AACE) e Diabetes Technology Society (DTS) recomenda que pacientes com CAD leve ou moderada não complicada sejam tratados com análogos de insulina de ação rápida por via subcutânea, em vez de insulina intravenosa. Essa recomendação é respaldada por evidências de estudos randomizados e metanálises, que demonstraram que a administração subcutânea de análogos de insulina de ação rápida a cada 1-2 horas é uma alternativa eficaz à insulina intravenosa de ação curta nesse subgrupo de pacientes.[134][135][136] O tratamento pode ser realizado em prontos-socorros e unidades de cuidados intermediários, sem a necessidade de internação em unidade de terapia intensiva (UTI). Isso não representa uma prática comum no Reino Unido.
Administrar 1 litro de soro fisiológico durante 1 hora, assim que a PAS for >90 mmHg OU se a PAS inicial for >90 mmHg.[2]
Os deficits de fluidos típicos na CAD são:[2]
Água - 100 ml/kg
Sódio - 7 a 10 mmol/kg
Cloreto - 3 a 5 mmol/kg
Potássio - 3 a 5 mmol/kg.
O objetivo dos primeiros litros de fluido é:[2]
Correção de qualquer hipotensão
Reabastecer o deficit intravascular
Correção de qualquer distúrbio de eletrólitos.
Administre fluidoterapia intravenosa com mais cautela e considere monitorar a pressão venosa central em pacientes que:[2]
são jovens (com idades entre 18 e 25 anos), pois a reposição rápida de fluidos pode aumentar o risco de edema cerebral nesses pacientes, ou
são idosos ou estão grávidas, ou
Apresentam insuficiência cardíaca ou renal ou outras comorbidades graves.
Inserção guiada por ultrassom de um cateter venoso central (CVC) não tunelizado na veia jugular interna direita, usando a técnica de inserção de Seldinger.
Practical tip
A solução de Hartmann (lactato de Ringer) normalmente não é usada fora dos cuidados intensivos.[2] Isso ocorre porque:
Contém 29 mmol/L de lactato, o que pode exacerbar a alta proporção lactato/piruvato na CAD e causar resultados adversos[147]
Aumenta o lactato plasmático, o que aumenta a produção de glicose[147]
Contém 5 mmol/L de potássio, o que pode causar arritmias cardíacas fatais, como bradicardia ou assistolia, se o paciente tiver hipercalemia na chegada[147]
Contém bicarbonato, que pode piorar a acidose metabólica existente[147]
É uma solução hipotônica. Isso aumenta o risco de edema cerebral em pacientes hiponatrêmicos na chegada.[147][148][149]
Debate: soro fisiológico versus soluções cristaloides balanceadas (por exemplo, solução de Hartmann/Ringer lactato, Plasma-Lyte ® ) para ressuscitação
Existe um debate sobre os benefícios do uso de soro fisiológico (cloreto de sódio a 0.9%) em comparação com soluções cristaloides balanceadas em pacientes com CAD, visto que ambas apresentam vantagens e desvantagens.
No Reino Unido, a diretriz da JBDS-IP recomenda o uso de soro fisiológico para ressuscitação fluídica em pacientes com CAD na enfermaria geral.[2] No entanto, um relatório de consenso de 2024 das ADA, EASD, JBDS-IP, AACE e DTS apoia o uso de soluções cristaloides balanceadas (por exemplo, Ringer lactato, Plasma-Lyte ® ) como alternativa ao soro fisiológico no tratamento da CAD.[1]
Os estudos especificamente discutidos no relatório de consenso de 2024 incluem:
Uma revisão sistemática de quatro ensaios clínicos randomizados e controlados (ECRC; n=369 pacientes, 2 ECRC em adultos) descobriu que, embora o tempo total para atingir os desfechos combinados de CAD fosse comparável entre soluções cristaloides balanceadas e soro fisiológico, as soluções cristaloides balanceadas foram geralmente associadas a uma correção mais rápida do pH.[150] No entanto, os autores observaram que os achados foram estatisticamente limitados devido ao pequeno número de estudos e à pequena população de pacientes.
Uma análise post-hoc de dois ECRC por clusters em adultos sugeriu que a solução cristaloide balanceada pode levar a uma resolução mais rápida da CAD do que o soro fisiológico, mas não quando administrada em um ambiente de enfermaria geral (não UTI).[151]
Uma revisão sistemática e metanálise de 8 ECRCs (n=482 pacientes, 6 ECRCs em adultos) descobriu que o soro fisiológico estava associado a um tempo mais longo para a resolução da CAD (diferença média [DM] de 3.5 horas), internação hospitalar ligeiramente mais longa (DM de 0.89 dias), cloreto sérico pós-ressuscitação mais elevado e bicarbonato sérico mais baixo em comparação com cristaloides balanceados.[152] Os achados, baseados em evidências de baixa a moderada certeza, sugerem que cristaloides balanceados podem ser preferíveis ao soro fisiológico para ressuscitação fluídica no tratamento da CAD.
Outra metanálise de 3 ECRCs em adultos descobriu que as soluções cristaloides balanceadas estavam associadas a uma resolução significativamente mais rápida da CAD em comparação com o soro fisiológico, com uma razão de riscos agrupada de 1.46 (IC de 95%: 1.10 a 1.94).[153] No entanto, não houve diferença estatisticamente significativa no tempo de resolução (DM: 3.02 horas; IC de 95%: 6.78 a 0.74).
Solução salina para ressuscitação fluídica em pacientes com CAD
Vantagens:
A solução salina está prontamente disponível nas enfermarias gerais, e os médicos têm experiência com esse produto.[2]
A solução salina está disponível com potássio pré-misturado e, portanto, está em conformidade com as recomendações da National Patient Safety Agency (NPSA) do Reino Unido. A NPSA afirma que as soluções diluídas e prontas para uso, preparadas comercialmente que contenham potássio devem ser usadas sempre que possível para reduzir o risco de uma administração inadequada de potássio, de maneira que a solução salina normal é recomendada no Reino Unido.[2][154]
É importante evitar a necessidade de adicionar potássio concentrado à fluidoterapia, pois há um risco de morte por administração incorreta de potássio concentrado.[155]
Desvantagens:
A acidose metabólica hiperclorêmica é uma possível complicação, devido ao grande volume de cloreto de sódio necessário para a ressuscitação fluídica na CAD.[2]
A acidose metabólica hiperclorêmica pode atrasar a resolução da acidose, pois pode causar vasoconstrição arterial nos rins e subsequente oligúria.[2]
Solução de Hartmann (Ringer com lactato) para ressuscitação fluídica em pacientes com CAD
Vantagens:
A solução de Hartmann tem uma tendência mínima de causar acidose metabólica hiperclorêmica, por causa do menor teor de cloreto em comparação com a solução salina.[2]
Desvantagens:
Em geral, os médicos no Reino Unido estão menos familiarizados com o uso clínico da solução de Hartmann, e ela não está tão prontamente disponível nas áreas clínicas.[2]
A solução de Hartmann contém potássio, o qual pode ser prejudicial no início da CAD.[147]
No entanto, ela também não contém potássio suficiente, se usada isoladamente, quando os níveis de potássio começam a cair. Além disso, ela não está comercialmente disponível com potássio pré-misturado e, portanto, não está em conformidade com as recomendações da NPSA do Reino Unido.[2]
A solução de Hartmann pode aumentar a relação lactato/piruvato, que já está elevada na CAD, agravar a acidose devido ao seu teor de bicarbonato e piorar o edema cerebral por ser hipotônica.[147]
Se o potássio sérico estiver entre 3.5 e 5.0 mmol/L, adicione 20-40 mmol/L de potássio ao segundo litro de fluidoterapia intravenosa utilizando soro fisiológico pré-misturado com cloreto de potássio, de acordo com as diretrizes locais sobre dosagem de potássio.[1][2][56] Em seguida, continue a terapia com fluidoterapia intravenosa e reposição de potássio de acordo com o nível de potássio na gasometria venosa, conforme a seguir:[1][2][56]
Nível de potássio (mmol/L) | Reposição de potássio (mmol/L de solução para infusão) |
|---|---|
<3.5 | Envolva a assistência de profissionais mais experientes ou de cuidados intensivos, pois é necessário administrar mais potássio |
3.5 a 5.0 | 20-40 |
>5.0 | Nenhum |
Utilize soro fisiológico com cloreto de potássio pré-misturado como fluido padrão para ressuscitação em casos de CAD.
A adição manual de potássio à fluidoterapia intravenosa nas áreas clínicas gerais não é segura, pois pode resultar em superdosagem acidental de potássio, a qual pode ser fatal.[154]
A hipercalemia e a hipocalemia são complicações potencialmente fatais, e comuns na CAD.[2][20]
Podem desencadear arritmias cardíacas com risco à vida.
Geralmente o potássio sérico está elevado no momento da internação (embora o potássio corporal total esteja baixo).
Inicie uma infusão de insulina intravenosa a uma taxa fixa de acordo com os protocolos locais.[2][20][64][56]
Certifique-se de que a fluidoterapia intravenosa tenha sido iniciada antes de administrar a infusão de insulina intravenosa a uma taxa fixa.
Se o nível de potássio for <3.5 mmol/L, a insulinoterapia deve ser adiada ou suspensa até que o nível de potássio aumente para ≥3.5 mmol/L, a fim de evitar arritmias com risco de vida e fraqueza dos músculos respiratórios.[1]
Procure orientação da equipe de especialistas em diabetes se forem necessárias >15 unidades/hora de insulina.[2][68]
Practical tip
Só administre insulina intramuscular em bolus se houver atraso na preparação da infusão de insulina intravenosa a uma taxa fixa.[2]
Escreva “unidades” ao prescrever insulina. Nunca use abreviações como 'U' ou 'UI'.[2]
Estime o peso do paciente, se necessário.[2]
Se a paciente estiver grávida, use o peso atualizado na gestação e peça auxílio imediato de um obstetra experiente.[2]
Evite uma correção rápida da hiperglicemia, pois isso aumenta o risco de edema cerebral.[79]
Garanta o monitoramento cardíaco contínuo e busque suporte de um profissional sênior ou de cuidados intensivos se:[2][31]
Houver hipotensão persistente (PAS <90 mmHg) ou oligúria (produção de urina <0.5 ml/kg/hora) apesar da fluidoterapia intravenosa
Estupor e/ou coma ou Escala de Coma de Glasgow <12 [ Escala de coma de Glasgow Opens in new window ]
Cetonas sanguíneas (beta-hidroxibutirato [BOHB]) >6 mmol/L
Bicarbonato venoso <10 mmol/L
pH venoso <7,0
Potássio <3,5 mmol/L na admissão
Saturações de oxigênio <92% no ar ambiente
Pulso >100 bpm ou <60 bpm
Anion gap >16 [ Anion gap Opens in new window ]
A paciente está grávida ou tem insuficiência cardíaca ou renal ou outras comorbidades graves.
Considere administrar bicarbonato apenas se o pH venoso for <7.0 e após discussão com um especialista sênior.[1] Monitorar o paciente em um ambiente de cuidados intensivos.[156]
O bicarbonato tem sido associado a desenvolvimento de edema cerebral.[156]
Evidências: bicarbonato intravenoso
A diretriz da JBDS-IP do Reino Unido sobre o tratamento da CAD não recomenda o uso rotineiro de bicarbonato intravenoso para CAD em adultos, afirmando que a acidose se resolve com terapia adequada de fluidos e insulina.[2]
A diretriz da JBDS-IP cita uma revisão sistemática que relatou dados de 44 estudos do tratamento com bicarbonato para a acidemia grave em pacientes com CAD, incluindo três ensaios clínicos randomizados e controlados (ECRCs) em adultos (número total: 73 adultos).[157]
Dois dos ECRCs incluídos, realizados em adultos, mostraram uma melhora transitória da acidose metabólica com bicarbonato nas primeiras 2 horas, mas nenhuma evidência de melhora do controle glicêmico ou da eficácia clínica[157]
A diretriz não encontrou estudos que relatassem edema cerebral em adultos ou em pacientes com pH de admissão <6.85[157]
Estudos retrospectivos em crianças que receberam bicarbonato para CAD constataram um aumento dos riscos de edema cerebral e hospitalização prolongada[157]
A administração rotineira de bicarbonato também não é recomendada em um relatório de consenso de 2024 das ADA, EASD, JBDS-IP, AACE e DTS.[1]
Busque orientação de um especialista se o paciente tiver acidose grave, ou se o tratamento com bicarbonato estiver sendo considerado.
Practical tip
Não reponha o fosfato de maneira rotineira.[2]
No entanto, esteja ciente de que a deficiência grave de fosfato pode agravar a insuficiência respiratória, precipitar arritmias cardíacas e causar rabdomiólise.[2]
Se alguma dessas características clínicas estiver presente, considere a medição e a reposição do fosfato de acordo com as orientações locais.[2]
Discuta a hipomagnesemia elevada com um especialista; talvez seja necessário repor o magnésio, mas não há orientações sobre os valores de corte.
Insira um cateter urinário se houver incontinência ou se não houver urina após 1 hora do início do tratamento.[2][56]
Administre uma dose de insulina de ação prolongada para evitar uma hiperglicemia de rebote quando a CAD estiver resolvida e a infusão de insulina intravenosa a uma taxa fixa for interrompida.[2]
Continue com a insulina basal de ação prolongada se o paciente já a estiver tomando.
Se esta for a primeira apresentação de diabetes, inicie uma insulina basal de ação prolongada o mais rápido possível.
Practical tip
Nunca suspenda a insulina em nenhum paciente com diabetes do tipo 1, para não desencadear CAD.[20]
Em uma pesquisa realizada no Reino Unido, mais de 7% dos episódios de CAD ocorreram em pacientes hospitalizados.[158] Muitas vezes, presume-se erroneamente que os pacientes com mais de 50 anos de idade têm diabetes do tipo 2 e podem tolerar períodos de suspensão da insulina quando hospitalizados.
A continuação da insulina de ação prolongada durante a CAD evita também a hiperglicemia de rebote quando a infusão de insulina intravenosa a uma taxa fixa é interrompida.[2]
Envolva a equipe especializada em diabetes o mais rápido possível e definitivamente, dentro de 24 horas.[2]
A equipe especializada em diabetes também deve estar envolvida na avaliação da causa da CAD.
Não é seguro tratar a CAD sem a equipe especializada em diabetes, o que pode comprometer o atendimento ao paciente.[2]
Identificar e tratar qualquer doença aguda que tenha desencadeado o quadro.[2]
Considere a tromboprofilaxia com heparina de baixo peso molecular em todos os pacientes, a menos que haja contraindicação.[2] Consulte as diretrizes locais. Consulte Profilaxia do tromboembolismo venoso.
Assegure-se de que a transferência dos pacientes com CAD seja efetiva.
Forneça os detalhes relevantes sobre o progresso clínico e bioquímico do paciente e o plano de tratamento adicional.
Practical tip
A transferência é uma fonte comum de erro no tratamento da CAD.
Manejo de 1 a 6 horas
Reavalie o paciente de hora em hora para verificar a melhora clínica e bioquímica e continue com a infusão de insulina intravenosa a uma taxa fixa.[2][56]
Solicite um teste de glicemia e das cetonas sanguíneas de hora em hora.
Faça uma gasometria venosa para aferição do pH, bicarbonato e potássio a 60 minutos, 2 horas e, daí em diante, a cada 2 horas.
Procure uma redução nas cetonas sanguíneas de 0,5 mmol/L/hora se a medição da cetona no sangue estiver disponível.
Use a medição do bicarbonato venoso ou da glicose sanguínea se a medição das cetonas no sangue não estiver disponível.
O objetivo é alcançar um aumento de 3 mmol/L/hora no bicarbonato venoso ou uma redução de 3 mmol/L/hora na glicose sanguínea.
Se as taxas alvo de cetonas no sangue, glicemia e bicarbonato venoso não forem atingidas:[2]
Verifique se a bomba de infusão de insulina está funcionando e conectada e se o volume residual de insulina está correto (para verificar se há algum problema no funcionamento da bomba)
Aumente a infusão de insulina de acordo com os protocolos locais (se não houver nenhum problema no funcionamento da bomba de insulina) até que as taxas alvo de cetonas, glicose e bicarbonato sejam atingidas.
Practical tip
Monitore todos os pacientes com CAD de maneira rigorosa:
A CAD é complexa de controlar e requer monitoramento rigoroso e ajustes oportunos no tratamento.[20]
O uso de diretrizes e protocolos padronizados, tanto em papel quanto computadorizados, para o tratamento da CAD demonstrou reduzir o tempo necessário para o fechamento do anion gap, diminuir o tempo de internação hospitalar e minimizar as complicações. No entanto, os protocolos de tratamento muitas vezes não são seguidos.[20]
É importante reconhecer que, apesar de sua utilidade, as diretrizes e os protocolos não devem substituir o bom senso clínico.[20]
Continue a fluidoterapia intravenosa.
Um esquema típico para um adulto de 70 kg sem outras comorbidades é:[2][20][56]
Volume de soro fisiológico normal (com cloreto de potássio, se necessário) |
|---|
1 litro em 2 horas |
1 litro nas 2 horas seguintes |
1 litro nas 4 horas seguintes |
1 litro nas 4 horas seguintes |
1 litro nas 6 horas seguintes |
Administre fluidoterapia intravenosa com mais cautela e considere monitorar a pressão venosa central em pacientes que:[2]
são jovens (com idades entre 18 e 25 anos), pois a reposição rápida de fluidos pode aumentar o risco de edema cerebral nesses pacientes, ou
são idosos ou estão grávidas, ou
Apresentam insuficiência cardíaca ou renal ou outras comorbidades graves.
Inserção guiada por ultrassom de um cateter venoso central (CVC) não tunelizado na veia jugular interna direita, usando a técnica de inserção de Seldinger.
Mantenha um quadro de equilíbrio hídrico acurado.[2]
Vise um débito urinário mínimo de 0.5 mL/kg/hora.
Mantenha o nível de potássio entre 4.0 e 5.0 mmol/L. Reponha o potássio por meio de fluidoterapia intravenosa se o potássio sérico for ≤5.0 mmol/L, usando soro fisiológico pré-misturado com cloreto de potássio.[1][2] Ajuste a reposição de potássio da seguinte forma:[1][2]
Nível de potássio (mmol/L) | Reposição de potássio (mmol/L de solução para infusão) |
|---|---|
<3.5 | Envolva a assistência de profissionais mais experientes ou de cuidados intensivos, pois é necessário administrar mais potássio |
3.5 a 5 | 20-40 |
>5 | Nenhum |
Consulte as diretrizes locais sobre a dosagem de potássio.
Se o nível de glicose cair para <14 mmol/L:[1][2][64]
Administre glicose a 5% ou 10% além do soro fisiológico e continue até que o paciente esteja se alimentando e bebendo líquidos normalmente
Considere reduzir a taxa de infusão intravenosa de insulina para 0,05 unidades/kg/hora para evitar o risco de desenvolver hipoglicemia e hipocalemia.
Practical tip
Um erro comum é permitir que a hipoglicemia se desenvolva, pois os níveis de glicose no sangue podem cair rapidamente durante a correção da cetoacidose.[2]
Isso pode levar a uma cetose de rebote (impulsionada por hormônios contrarreguladores) e prolongar a duração do tratamento.
A hipoglicemia grave está associada a arritmias cardíacas, lesão cerebral aguda e morte.
É importante administrar soluções de glicose e cloreto de sódio simultaneamente se o nível de glicose cair para <14 mmol/L.[2] Considere também a redução da taxa de infusão de insulina.[2]
Evidências: redução da taxa de insulina quando as concentrações de glicose caem a <14 mmol/L
Em pessoas com CAD, reduzir a taxa de insulina quando a glicose sanguínea cai abaixo de 14 mmol/L pode ajudar a diminuir o risco de hipoglicemia e hipercalemia.
A diretriz da JBDS-IP sobre o tratamento da CAD abordou especificamente as preocupações em torno da hipoglicemia e da hipocalemia, que haviam sido identificadas como complicações comuns em um levantamento nacional no Reino Unido, apesar da ampla implementação de recomendações anteriores da JBDS-IP.[2][158]
A principal causa foi o uso da insulina.
Embora não haja evidências de ensaios clínicos em adultos com CAD, o painel observou que diversas outras diretrizes para adultos sugerem a redução da taxa de infusão intravenosa de insulina à medida que os níveis de glicose no sangue diminuem.[2]
Um ECRC em crianças com CAD (n=50) descobriu que uma taxa mais baixa de infusão de insulina (0.05 unidades/kg/hora em comparação com 0.1 unidades/kg/hora) não atrasou significativamente a resolução da acidose, mas foi associada a taxas mais baixas de hipocalemia (20% vs. 48%) e hipoglicemia (4% vs. 20%).[159][160]
Um segundo ECRC pediátrico (n=60) relatou achados semelhantes.[161]
Com base em recomendações de outras diretrizes e em evidências indiretas de estudos pediátricos, o painel da JBDS-IP recomendou que, em adultos com CAD, a taxa de infusão de insulina seja reduzida para 0.05 unidades/kg/hora quando a glicose sanguínea cair abaixo de 14 mmol/L.[2] Essa recomendação é ainda corroborada por um relatório de consenso de 2024 elaborado pelas ADA, EASD, JBDS-IP, AACE e DTS.[1]
Monitore regularmente a presença de complicações durante o tratamento da CAD.[2][56]
Avalie a Escala de Coma de Glasgow de hora em hora para monitorar quanto à presença de edema cerebral.[2]
Monitore rigorosamente os sinais vitais de acordo com os protocolos locais.
Solicite uma radiografia torácica se as saturações de oxigênio caírem, pois isso pode ser um sinal de edema pulmonar. Considere realizar uma gasometria arterial.
O edema pulmonar e a síndrome do desconforto respiratório agudo (SDRA) são complicações raras, mas significativas, do tratamento da CAD, e manifestam-se com sobrecarga hídrica e baixas saturações de oxigênio.[163] Elas ocorrem mediante uma administração excessiva de fluidos, mesmo nos pacientes com função cardíaca normal.
Fique atento a qualquer aumento do gradiente alveolar de oxigênio (AaO2) e ausculte para verificar a presença de crepitações pulmonares.
O edema pulmonar e a SDRA são mais comuns nos pacientes intensamente desidratados ou com níveis mais altos de glicose à chegada.
Como obter uma amostra de sangue arterial da artéria radial.
Como realizar uma punção da artéria femoral para coletar uma amostra de sangue arterial.
Practical tip
Outras características do edema cerebral são vômitos recorrentes, incontinência, irritabilidade, respirações anormais e disfunção de nervos cranianos. Geralmente elas ocorrem várias horas após o início do tratamento.[2][79]
A causa exata do edema cerebral é desconhecida. Ele é mais comum nas crianças e adolescentes, sendo raro após os 28 anos de idade. Ele é a causa mais comum de mortalidade na CAD.[2][63][79]
Considere a tromboprofilaxia com heparina de baixo peso molecular em todos os pacientes, a menos que haja contraindicação.[2][56] Consulte o protocolo local.
Manejo de 6 a 12 horas
Continue com fluidoterapia intravenosa, correção do potássio e infusão de insulina intravenosa a uma taxa fixa.[2][20] Busque aconselhamento de um médico experiente se os marcadores clínicos e bioquímicos não melhorarem.
Verifique as cetonas, a glicemia, o pH venoso, o bicarbonato e o potássio em 6 horas.
Avalie quanto à resolução da CAD. A resolução é definida como:[1]
Nível de cetona no sangue <0.6 mmol/L E
pH venoso ≥7.3 ou bicarbonato ≥18 mmol/L
Idealmente, a glicose plasmática também deve ser <11.1 mmol/L. Neste ponto, a dose de insulina pode ser reduzida em 50%.[1]
Practical tip
Não confie apenas no bicarbonato ou no anion gap para avaliar a resolução da CAD.[1][2][79]
A acidose hiperclorêmica geralmente persiste secundariamente a altos volumes de soro fisiológico. Isso reduz o bicarbonato e dificulta a avaliação da resolução da cetose.
A acidose hiperclorêmica pode causar vasoconstrição renal e oligúria.
Aproximadamente um terço dos pacientes que apresentam CAD têm um distúrbio ácido-base misto devido à diurese osmótica e natriurese induzidas pela hiperglicemia, náuseas e vômitos, e hiperventilação (respiração de Kussmaul).
Não confie no clearance urinário das cetonas para avaliar a resolução da CAD.[2]
A presença de cetonúria persistirá mesmo após a resolução da CAD.
Manejo de 12 a 24 horas
Verifique o pH venoso, o bicarbonato, o potássio, as cetonas e a glicemia em 12 horas. Verifique se a CAD se resolveu dentro de 24 horas.[2][56]
Solicite a intervenção de um profissional mais experiente ou especialista caso a CAD não se resolva em 24 horas.[2]
É incomum os pacientes não responderem ao tratamento. Por isso, é importante identificar e tratar a causa da CAD.
Continue a infusão de insulina intravenosa a uma taxa fixa e a fluidoterapia intravenosa.
Monitore as cetonas e a glicose sanguíneas de hora em hora e o pH, o potássio e o bicarbonato a cada 2 horas, para garantir que estejam dentro das taxas-alvo especificadas.
Inicie a administração regular de insulina subcutânea quando a CAD estiver resolvida e o paciente estiver se alimentando e bebendo normalmente. A administração deve normalmente ser feita pela equipe especializada em diabetes, e junto com uma refeição.[2][79]
Se possível, troque a insulina intravenosa pela insulina subcutânea pela administração matinal, pois a maioria dos hospitais conta com melhor equipe durante o dia, caso a CAD recorra.[132]
Continue a administração de insulina intravenosa por 30 a 60 minutos após a administração de insulina subcutânea para prevenir a recidiva da CAD.[2]
É um erro comum interromper a insulina intravenosa muito precocemente ou antes de se decidir sobre o momento certo e as doses de insulina subcutânea.[20]
Se o paciente estava tomando insulina basal em bolus:[2]
Ela deve ser continuada se ele estiver tomando um análogo de insulina de ação prolongada[20]
Reinicie a insulina subcutânea de ação curta normal na próxima refeição
Em geral, reinicie o esquema de insulina anterior do paciente se o seu exame de HbA1c mais recente mostrar um nível aceitável de controle (ou seja, HbA1c ≥64 mmol/mol).[2]
Não interrompa a insulina intravenosa se a insulina de ação prolongada tiver sido interrompida por engano até que uma forma de insulina de base tenha sido administrada.[2]
Administre metade da dose diária usual de insulina basal (usando insulina isofana) pela manhã se o análogo basal estiver sendo normalmente tomado uma vez ao dia, à noite, e a intenção for converter em insulina subcutânea pela manhã.
Verifique regularmente os níveis de cetonas e glicose no sangue.
Se o paciente estava anteriormente tomando insulina em mistura fixa duas vezes ao dia:[2]
Reintroduza a insulina subcutânea antes do café da manhã ou antes da refeição da noite. Não mude em nenhum outro momento.
Se o paciente estava sob infusão subcutânea contínua de insulina (ISCI):[2]
Reinicie a ISCI à taxa basal normal
Continue a infusão intravenosa de insulina até que o bolus da refeição tenha sido administrado
Não reinicie a ISCI ao deitar.
Estime a dose diária total (DDT) de insulina para os pacientes que não estavam tomando insulina anteriormente.[2]
Leve em consideração a sensibilidade à insulina, o grau de controle glicêmico, a resistência insulínica e a idade do paciente.[2]
Uma fórmula com a dose calculada de acordo com o peso pode ser considerada, utilizando 0.5 a 0.6 unidades/kg/dia em pacientes que nunca utilizaram insulina, tendo em mente que a composição corporal e/ou a resistência insulínica podem ter impacto nessa estimativa.[1] Para pessoas com fatores de risco para hipoglicemia, incluindo insuficiência renal ou fragilidade, um cálculo usando aproximadamente 0.3 unidades/kg/dia pode ser mais apropriado.[1] Use 0.75 unidades/kg para as pessoas consideradas mais resistentes à insulina (por exemplo, adolescentes, pessoas com obesidade).[2]
Se estiver-se usando um esquema basal em bolus:
Administre 50% da DDT com a refeição da noite como insulina de ação prolongada e divida a dose restante igualmente entre antes do café da manhã, antes do almoço e antes da refeição da noite.
Administre a primeira dose de insulina subcutânea de ação rápida, de preferência antes do café da manhã.
Só administre a primeira dose antes da refeição da noite se houver monitoramento.
Nunca mude para um esquema subcutâneo ao deitar.
Se estiver-se usando um esquema pré-misturado duas vezes ao dia:
Administre dois terços da DDT no café da manhã e o terço restante no jantar.
Practical tip
Use um esquema basal em bolus para a maioria dos pacientes, especialmente os jovens e em boa forma física.
Considere um esquema pré-misturado duas vezes ao dia para os pacientes idosos, pois eles podem não conseguir lidar com um esquema basal em bolus.
Continue com a fluidoterapia intravenosa se o paciente não estiver se alimentando e bebendo líquidos.[2][20]
Inicie uma infusão intravenosa de insulina em taxas variáveis nesses pacientes se a CAD tiver se resolvido.
Meça a glicemia regularmente.
Oriente os pacientes sobre a causa desencadeante e os sintomas iniciais de alerta da CAD. Considere:[2][20]
Revisão de seu controle glicêmico usual
Revisão de sua técnica de injeção, monitoramento da glicose no sangue, equipamentos e locais de injeção
Prevenção da recorrência (por exemplo, forneça “regras escritas para dias de doença”)
Verificar a insulina do paciente antes da reutilização (pode estar vencida ou desnaturada)
Avaliação da necessidade de fornecimento de medidores portáteis de cetona para uso doméstico
Fornecer um número de contato para entrar em contato com a equipe de especialistas em diabetes fora do horário de expediente
Fornecer um plano de cuidados por escrito que permita ao paciente ter um papel ativo no controle do diabetes, com uma cópia enviada ao seu clínico geral.
Tenha em mente que, no Reino Unido, todos os pacientes com diabetes mellitus do tipo 1 devem ter acesso ao monitoramento contínuo de glicose, com base na discussão de diversos fatores, incluindo se a glicose sanguínea instável está afetando sua qualidade de vida.[56]
Garanta acompanhamento adequado dos pacientes com a equipe de especialistas em diabetes e acesso a apoio psicológico.[2]
Inserção guiada por ultrassom de um cateter venoso central (CVC) não tunelizado na veia jugular interna direita, usando a técnica de inserção de Seldinger.
Como obter uma amostra de sangue arterial da artéria radial.
Como realizar uma punção da artéria femoral para coletar uma amostra de sangue arterial.
Como inserir uma cânula venosa periférica no dorso da mão.
ამ მასალის გამოყენება ექვემდებარება ჩვენს განცხადებას