Etiología
Los orthoebolaviruses pertenecen a la familia Filoviridae (género Orthoebolavirus; orden:Mononegavirales). Estos virus son estructuras alargadas y filamentosas de longitud variable.[Figure caption and citation for the preceding image starts]: Microscopía electrónica de transmisión que muestra parte de la morfología ultraestructural de un virión del virus del ÉbolaCenters for Disease Control and Prevention [Citation ends].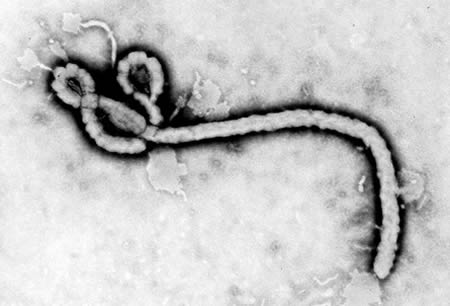
Se cree que el virus se contrajo inicialmente por la exposición a fluidos corporales o al tejido de animales infectados, como murciélagos y primates no humanos; sin embargo, el reservorio natural y modo de transmisión a humanos aún no se ha confirmado.[39] Los análisis clínicos de la competencia del reservorio muestran que la infección es posible en murciélagos y roedores, pero no en plantas y artrópodos.[40][41][42] La transmisión de animales a seres humanos puede ocurrir durante la caza y el consumo de especies del reservorio o primates no humanos infectados. Asimismo, se considera factor contribuyente la práctica local de comer carne de animales salvajes o alimentos contaminados con heces de murciélago (se implicaron como reservorio 3 especies de murciélagos que se refugian en árboles).
[Figure caption and citation for the preceding image starts]: Ecología del virus del Ébola que muestra los ciclos enzoótico y epizoóticoCenters for Disease Control and Prevention [Citation ends].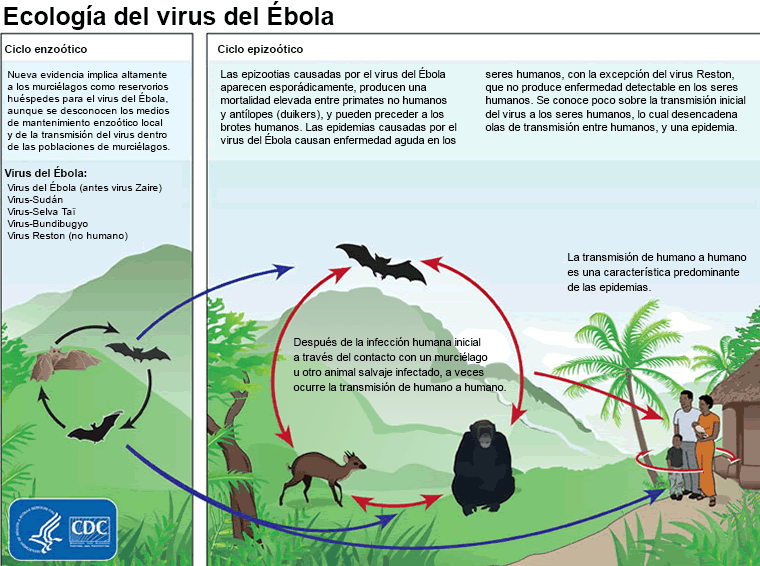
La transmisión entre seres humanos se produce por contacto directo con fluidos corporales de pacientes infectados u objetos contaminados con fluidos corporales infectados.[43][44] En las epidemias iniciales, la reutilización de inyecciones no estériles fue responsable por muchas transmisiones asociadas a los cuidados de la salud.[24] Sin embargo, aunque continúa siendo un riesgo, la mayoría de los casos resultan de contacto físico próximo o contacto con fluidos corporales (p. ej., sudor, sangre, heces, vómito, saliva, secreciones genitales [incluido semen], liquido amniótico y leche materna) de pacientes infectados.
El nivel de virus en la sangre aumenta durante la evolución de la enfermedad y los pacientes son más infecciosos en las etapas posteriores de la enfermedad (es decir, durante los periodos de diarrea, vómitos y hemorragia).[45] Grandes cantidades de virus se encuentran en la piel y, como el sudor también puede contener el virus, tocar a un paciente infectado puede generar la transmisión.[46]
Los eventos de superpropagación en el entorno comunitario también se reconocen cada vez más como un factor contribuyente: un funeral de un curandero tradicional en Sierra Leona en 2015 se asoció a 300 casos.[47] En un estudio, se encontró que los superpropagadores fueron responsables de aproximadamente el 61% de las infecciones en el brote de 2014.[48]
En un estudio para identificar la tasa de replicación viral en varios fluidos corporales, se aisló el virus en saliva, leche materna, heces, lágrimas y semen hasta 40 días luego del inicio de la enfermedad.[44][49][50] El virus aún puede detectarse en el semen más de 12 meses después de la recuperación de la infección, posiblemente debido a que el tejido testicular es un sitio inmunológicamente protegido.[51] Esto significa que la transmisión sexual puede ser posible mucho después de que la infección se haya resuelto, y que tales casos se confirmaron durante y después del brote de 2014.[44][49][50][52][53][54][55][56] El virus también se detectó en el fluido vaginal.[57] Otros sitios inmunológicamente protegidos son el interior de los ojos, la placenta y el sistema nervioso central, en particular el líquido cefalorraquídeo.[58] La replicación viral puede continuar en la orina y el sudor. En un paciente que se recuperó en Alemania, se detectó el virus en la orina 14 días después de no haberse detectado en el suero, y en el sudor hasta 19 días después de no haberse detectado en el suero.[46]
Se demostró que la infección por vía inhalatoria es posible en primates no humanos; sin embargo, no hay evidencia de transmisión aérea en seres humanos.[14][59] Aún debe considerarse la posibilidad de transmisión oportunista del virus en el aire durante los vómitos fuertes (similar a la observada con la infección por norovirus) y durante los procedimientos con aerosoles generadores de partículas asociados a las intervenciones de medicina intensiva.
Fuera de las zonas endémicas, la enfermedad del Ébola es rara y es generalmente una infección importada.[60] Los viajeros que provienen de áreas afectadas, así como también científicos de laboratorio y otras personas que trabajan con materiales o animales posiblemente infectados, tienen riesgo alto.
Fisiopatología
Hubo avances importantes para esclarecer la patogénesis de la infección; sin embargo, la mayoría de los estudios se han realizado en modelos de primates no humanos y roedores.[7] Esto se debe a las dificultades para conducir estudios con seres humanos en contextos de pocos recursos donde esas infecciones ocurren naturalmente.
El genoma del virus consiste en una cadena simple de 19 kb de ácido ribonucléico (ARN) de sentido negativo con 7 genes virales que transcribe la ARN polimerasa viral dependiente de ARN presente en el virión. La cadena simple de ARN está cubierta de nucleoproteínas virales NP o VP30 organizadas en hélice que están ligadas por las proteínas de la matriz VP24 y VP4 a la bicapa lipídica que reviste el virión.[14] Hubo una rápida mutación del virus en el brote de 2014, que planteó preocupación sobre su capacidad para evadir las respuestas inmunitarias del huésped y evolucionar bajo la presión de nuevos tratamientos.[61][62]
El periodo de incubación después de la infección es de 2 a 21 días.[3] El número básico de reproducción (R₀), el número de casos secundarios generados por un caso primario en una población totalmente susceptible, se ha estimado en 1.3 a 2. Sin embargo, la R₀ varía significativamente según los países y los brotes. Se ha estimado que la R₀ media combinada general es de 1.95, pero ha llegado a 10 en algunos brotes. En los países donde se importaron casos, el valor osciló entre 1.5 en Estados Unidos, 1.6 en el Reino Unido y 2.4 en Gambia.[63]
La invasión tisular ocurre a través del contacto del fluido infectado con rupturas en la mucosa o la piel. Esto puede ocurrir con la transmisión animal a humano o entre humanos. Los monocitos, macrófagos y células dendríticas son los sitios de replicación preferidos por los filovirus en la infección inicial. Las células infectadas migran hacia los ganglios linfáticos regionales, el hígado y el bazo, diseminando así la infección. El virus del Ébola tiene un amplio tropismo celular y es capaz de infectar diversos tipos de células, pero la replicación viral extensiva ocurre en el tejido linfoide, el hígado y el bazo.[7][14][64] También tiene la notable capacidad de modular la expresión de los genes involucrados en la respuesta inmunitaria del huésped, lo que causa apoptosis de linfocitos y atenuación de los efectos protectores del interferón.[65][66][67][68][69]
La respuesta inmunitaria del huésped es crucial y determina el desenlace de la infección. El avance a la etapa grave del espectro de la enfermedad se produce cuando el virus desencadena la expresión de un huésped de citocinas proinflamatorias, que incluyen: interferones; interleucinas (IL), tales como IL-2, IL- 6, IL-8 y IL-10; proteína inducible por interferón, y factor de necrosis tumoral alfa (FNT).[7][14][70] Esto, a su vez, causa activación endotelial y reducción de la integridad vascular, liberación del factor tisular (con inicio de coagulopatía asociado) y aumento de los niveles de óxido nítrico (con hipotensión asociada).[71] La infección conduce a la disminución de linfocitos por medio de apoptosis indirecta (debido a que el virus no se replica en linfocitos) y supresión de neutrófilos mediante glucoproteína (GP).[72] La causa más común de trombocitopenia es la desaparición de plaquetas del tejido dañado o la coagulación intravascular diseminada más generalizada inducida por el virus, donde hay agotamiento de los factores de coagulación.[73] La coagulación intravascular diseminada, junto con la insuficiencia hepática aguda, predispone al paciente a complicaciones por sangrado. Otras complicaciones de la enfermedad grave incluyen daño renal agudo, hepatitis y pancreatitis.[14] La respuesta temprana de los anticuerpos, junto con un agotamiento reducido de linfocitos, está asociada con la depuración viral eficaz y la supervivencia.[74] La citometría de flujo empleada en un centro de tratamiento en Guinea durante el brote de 2014, demostró que la desregulación de las células T (caracterizada por una expresión más alta de CTLA-4 y PD-1 en las células CD4 y CD8) estuvo asociada a fallecimientos. Esto confirma la sugerencia inicial de que una respuesta inmunitaria adecuada, pero controlada, es clave para la sobreviviencia.[75]
Aún no se comprende bien el proceso de desarrollo del choque. Diversos factores pueden contribuir, incluyendo: sepsis bacteriana, posiblemente por medio de translocación intestinal de bacteria; un efecto directo del virus; coagulación intravascular diseminada; o hemorragia.[70]
Clasificación
Taxonomía del virus
Los orthoebolavirus, pertenecen a la familia Filoviridae (género Orthoebolavirus).[1]
Actualmente hay seis especies conocidas de Orthoebolavirus (nota: los nombres de las especies se actualizaron en abril de 2023):[2]
Virus del Ébola (EBOV) - Orthoebolavirus zairense (anteriormente conocido como virus del Ébola-Zaire)
Virus de Sudán (SUDV) - Orthoebolavirus sudanense (anteriormente conocido como virus del ébola-Sudán)
Virus del Bosque de Tai (TAFV) - Orthoebolavirus taiense (anteriormente conocido como virus del Ébola del Bosque de Tai o Virus del Ébola de Costa de Marfil)
Virus Bundibugyo (BDBV) - Orthoebolavirus bundibugyoense (anteriormente conocido como virus del Ébola de Bundibugyo)
Virus de Reston (RESTV) - Orthoebolavirus restonense (anteriormente conocido como virus del Ébola de Reston)
Virus de Bombali (BOMV) - Orthoebolavirus bombaliense (anteriormente conocido como virus del ébola de Bombali).
No se sabe que el virus de Reston y el virus de Bombali causan enfermedades en los seres humanos.[1]
Las cuatro especies que causan enfermedades en los seres humanos causan síndromes clínicos ligeramente diferentes y de gravedad variable, y se ha notificado una tasa de letalidad de entre el 25% y el 90% en los distintos brotes (la tasa media es de aproximadamente el 50%).[3] El virus del Ébola y el virus de Sudán son especialmente conocidos por su virulencia; los otros tipos se consideran menos virulentos.
Virus del Ébola (Orthoebolavirus zairense):
Fue aislado por primera vez en 1976 durante un brote en el norte de Zaire (actualmente conocido como República Democrática del Congo [RDC]).[1] Esa parece ser la más virulenta de las seis especies y presenta la tasa de letalidad más alta de todas las especies.[4] Es responsable del mayor brote que comenzó en África Occidental en 2014.
Virus del Sudán (Orthoebolavirus sudanense):
Se aisló por primera vez en 1976 durante un brote en el sur de Sudán. Provoca un síndrome idéntico al Orthoebolavirus zairense; sin embargo, la tasa de letalidad es menor.[4]
Virus del bosque de Tai (Orthoebolavirus taiense):
Se ha documentado únicamente un caso en 1994 en una investigadora suiza que realizó una autopsia a un chimpancé muerto en el Tai National Park en Costa de Marfil.[5] La investigadora se recuperó de la fase febril de la enfermedad sin ninguna complicación hemorrágica.
Virus de Bundibugyo (Orthoebolavirus bundibugyoense):
Se descubrió en 2007 durante un brote aislado en el distrito de Bundibugyo en el oeste de Uganda. El virus aislado se identificó como una especie distinta, vagamente relacionada con el Orthoebolavirus taiense.[6]
Virus de Reston (Orthoebolavirus restonense):
Se lo aisló por primera vez en Reston, Virginia, EE. UU. en 1989, donde se encontró en monos Cynomolgus importados de las Filipinas. Se descubrió que varios trabajadores expuestos a animales infectados presentaban serología positiva, pero ningún síntoma clínico. Desde entonces, el virus también se aisló en puercos en las Filipinas.[7][8]
Virus de Bombali (Orthoebolavirus bombaliense):
Se descubrió por primera vez en Sierra Leona en 2018 en los órganos del murciélago de cola libre angoleño (Mops condylurus) y del murciélago pequeño de cola libre (Chaerephon pumilus). También se ha identificado en murciélagos en Kenya y Guinea.[9][10] Se desconoce si este virus es patógeno en los humanos.[11]
Otras infecciones filovirales
La familia de virus Filoviridae incluye orthoebolavirus, orthomarburgvirus y Cuevavirus, entre otros. Los orthomarburgvirus son los únicos otros integrantes de este grupo conocido por causar infección en seres humanos. Se lo aisló en murciélagos y causa un síndrome similar a la enfermedad del Ébola. Se reportó sobre varios brotes, a menudo relacionados con la exposición a animales en minas o cavernas.[2][12]
ამ მასალის გამოყენება ექვემდებარება ჩვენს განცხადებას
