辅助检查
首要检查
实时逆转录聚合酶链反应 (RT-PCR)
检查
条件允许时,应始终对疑似感染患者针对 SAR-CoV-2 进行 RT-PCR(详见“诊断标准”部分)[385]
应基于临床和流行病学因素做出哪些人应进行检测的决策。[385] 应询问当地卫生部门以获取指南,因为检测优先级取决于地方建议和可用资源。
在英国,建议对以下人群进行检测:(1)新发持续咳嗽、高热或嗅觉/味觉改变症状的社区人群;(2)需要入院且存在肺炎、急性呼吸窘迫综合征、流感样疾病或嗅觉/味觉改变的临床或放射学证据(伴或不伴有任何其他症状)的人群。[383][424]
在美国,建议对以下人群进行检测:(1) 有症状者,即使症状为轻度;(2) 无症状,但与明确感染者产生密切接触者(24 小时内在距感染者 2 米[6 英尺]范围内停留时间总计达 15 分钟以上);(3) 无症状,且与明确感染者密切接触未达 15 分钟者(仅在医务人员或公共卫生官员要求的情况下)。[425]
美国儿科学会建议对症状与 COVID-19 一致的儿童,与可能或确诊感染个体产生密切接触的儿童,以及计划进行侵入性医学操作的儿童,给予检测。检测决定不因儿童年龄而异。不建议对不具相同症状的其他疾病(例如尿路感染、蜂窝织炎)或与受感染个体产生密切接触的儿童进行检测,除非密切接触者本身的后续检测呈阳性。[426]
用于检测的最佳样本取决于患者临床表现和症状持续时间。世界卫生组织建议早期感染患者(尤其是无症状病例和轻度病例)使用上呼吸道样本(鼻咽拭子和/或口咽拭子),中晚期感染患者和强烈怀疑感染但上呼吸道样本检测阴性的患者则使用下呼吸道样本(患有更严重呼吸道疾病患者的痰液和/或气管抽吸物或支气管肺泡灌洗液)。其他样本选择(例如鼻部中鼻甲拭子、鼻前孔拭子、鼻咽/鼻部冲洗液/抽吸液、唾液、粪便)可能推荐用于一些特定情境;请查阅当地指南。[385][431]
RT-PCR 阳性结果可确诊 SARS-CoV-2 感染(在 RT-PCR 检测带来限制的情况下)。若为阴性结果,但仍临床怀疑感染(例如存在流行病学关联、存在典型 X 线表现、没有其他可能病因),则应再次对患者进行取样并重复检测。阳性结果可确诊感染。如果第二次检测仍为阴性,应考虑血清学检测(见下方)。[385]
合并灵敏度估计为 87.8%,特异度估计为 87.7%-100%。[435]
检测结果需谨慎解读。使用 RT-PCR 诊断 COVID-19 的证据仍在不断出现,其有效性和准确性尚不确定。[435] 目前并未完全了解阳性结果是否一定表明存在传染性病毒。[436] 对结果的解读取决于检测本身的准确性,以及疾病的验前概率和验后概率。[438] 当验前概率低时,应谨慎解读阳性结果,理想情况下应再测试一个样本以进行确认。[439] 特定人群疾病患病率越低,验后概率就越低。[440] 假阳性结果可能为实验室误差,或当前和过去暴露于季节性人类冠状病毒感染(例如普通感冒)而形成的抗体交叉反应所致,并且当患病率为中等至较低时,可能性更高。[442][443] 初步估计英国假阳性率为 0.8%-4%。[444] 据报道,假阴性率在 2% 至 29% 之间。[438]
同时也应采集鼻咽拭子以根据当地指南排除流感和其他呼吸道感染。重要的是,要注意可能出现混合感染,非 COVID-19 病原体的阳性检测结果不能排除 COVID-19。[2][434] 当 SARS-CoV-2 与流感病毒同时传播时,需在所有住院急性呼吸道疾病患者中对这两种病毒进行检测,如果检测结果将改变患者临床管理,则仅对急性呼吸道疾病门诊患者进行流感病毒检测。[3] 在美国,可进行单项检测多重分析,诊断感染是由甲型流感、乙型流感亦或 SARS-CoV-2 引发。[494]
结果
严重急性呼吸综合征冠状病毒 2(Severe Acute Respiratory Syndrome Coronavirus 2, SARS-CoV-2)病毒 RNA 检查结果呈阳性;甲型和乙型流感病毒,以及其他呼吸道病原体检查结果可呈阳性
脉搏血氧测定
检查
应安排重症患者进行测定。
建议呼吸窘迫和紫绀患者进行测定。
临床医生应意识到,COVID-19 患者可出现“沉默性低氧”:他们的血氧饱和度可能降至低水平,并引发急性呼吸衰竭,但却无明显呼吸窘迫症状。仅有一小部分患者出现其他器官功能障碍,这意味着在急性恶化初始阶段之后,对于进一步恶化的传统识别方法(例如英国国家早期预警评分 2 [National Early Warning Score 2, NEWS2] 评分)可能对于哪些患者将进展至呼吸衰竭无法进行预测。[416]
结果
可能显示低氧饱和度(SpO₂ <90%)
动脉血气分析(ABG)
检查
用于重症患者,以检测高碳酸血症或酸中毒。
推荐用于低氧饱和度(SpO₂ <90%)的呼吸窘迫和紫绀患者。
结果
可表现氧分压过低
全血细胞计数(FBC)
检查
应安排重症患者进行测定。
淋巴细胞减少、白细胞增多、血小板减少、嗜酸性粒细胞减少、血红蛋白减少以及嗜中性粒细胞:淋巴细胞比率高与罹患重症显着相关,可用于预测疾病进展。严重病例更可能出现淋巴细胞减少和血小板减少,而不是白细胞减少。[495]
已发现住院患者红细胞分布宽度升高(入院时发现并在住院期间不断升高)与死亡风险显著升高有关。[496]
重症患者主要淋巴细胞亚群绝对计数(特别是 CD4+ 和 CD8+ T 细胞计数)显著降低。[497]
晚期血小板减少症(即症状发作后 3 周或更长时间发病)已有报道,但并不常见。[498]
结果
淋巴细胞减少;白细胞增多;白细胞减少;血小板减少症;血红蛋白减少;嗜酸性粒细胞减少;血红蛋白减少
生化全项
凝血筛查
心脏生物标志物
血清 C 反应蛋白
结果
可能升高
血清红细胞沉降率
结果
可能升高
血清乳酸脱氢酶
结果
可能升高
血清降钙素原
血清淀粉样蛋白 A 水平
结果
可能升高
血清肌酸激酶和肌红蛋白
结果
可能升高
血液和痰液培养
需考虑的检查
胸部计算机体层成像(Computed Tomography, CT)
检查
考虑进行胸部 CT 扫描。应查阅当地指南,决定是否行 CT扫描。 英国胸科影像学会(British Society of Thoracic Imaging, BSTI)建议对于临床疑似 COVID-19 的重症患者,若胸部 X 线检查无法确定或正常,则进行 CT 影像学检查。 BSTI: radiology decision tool for suspected COVID-19 Opens in new window 英国部分医疗机构针对临床高度疑似 COVID-19 的病例推荐了一个更务实的检测方法,即仅在胸部 X 线检查结果正常或两次结果不确定,以及联合 RT-PCR 检测呈阴性之后,才建议行胸部 CT 检查。[459] 美国放射学会建议为有 CT 特定临床指征的住院有症状患者保留 CT 检查,并强调正常的胸部 CT 并不意味着患者无 COVID-19,而异常的胸部 CT 亦并不对 COVID -19 诊断具有特异性。[460]
多达 97% 的住院患者据报道出现胸部 CT 异常。[461] 部分患者通过 CT 检查得到肺炎证据的时间可能早于 RT-PCR 检测得到 SARS-CoV-2 阳性结果的时间。[462] 无症状患者可出现 CT 影像学异常。在无症状病例中,胸部 CT 检查阳性率总体估计为 62%,而在出现症状的患者中则为 90%。[463] 尽管 RT-PCR 阳性,但某些患者仍可表现为胸部检查结果正常。[464] 同样,RT-PCR 结果可能呈假阴性,因此有典型 CT 表现的患者应重复接受 RT-PCR 检测以确认诊断。[465]
最常见的影像学发现是毛玻璃样混浊,无论是孤立还是与其他影像学发现(例如实变、小叶间间隔增厚或铺路石征)共存。最常见分布模式为双侧性、周边/胸膜下、混浊呈后分布,肺叶为主的特征较不明显。广泛/多叶受累合并实变在老年患者和重症患者中更为常见。肺血管扩张、小叶间或小叶内间隔增厚、相邻胸膜增厚、空气支气管征、胸膜下线征、铺路石征、支气管扭曲、支气管扩张、液泡回缩征和晕征为非典型特征。胸腔积液、心包积液、空腔、气胸和纵隔淋巴结肿大也较少被报道。[466]
儿童胸部 CT 检查常表现为正常或轻度病变。儿童中最常见征象为斑片状毛玻璃样混浊,非特异性斑片影、区域实变和晕征则不甚常见。异常表现在下叶更为常见,且主要呈单侧。胸腔积液较为罕见。[469]
CT 扫描通常显示,早期随访时段中,毛玻璃样混浊的大小、数量和密度都有所增加,并在 10 至 11 天逐渐进展为毛玻璃样混浊、实变和铺路石征混合病灶,而后逐渐消退或持续呈现片状纤维化。[466]
一项荟萃分析显示此项检测在疾病低流行地区的阳性预测值较低(1.5% 至 30.7%),阴性预测值为 95.4% 至 99.8%,合并敏感度与特异性分别为 94% 至 96% 和 37%。[516][517] 毛玻璃样混浊和病毒性肺炎其他特征同时存在,对 COVID-19 检测最具意义(敏感性为 90%,特异性为 89%)。[467]
在中国高流行地区的 1000 多名患者队列研究中,与最初以拭子样本进行 RT-PCR 者相比,胸部 CT 对 COVID-19 的诊断敏感性更高(88% 对 59%)。该病患队列在恢复期间,异常 CT 表现得到改善,出现于 RT-PCR由阳性转阴之前。对于 RT-PCR 最终结果呈阳性的患者,胸部 CT 敏感性为97%。然而,在此研究中,RT-PCR 结果呈阴性的患者中,亦有 75% 胸部 CT 检查结果呈阳性。这些患者中,48% 被认定为高度可疑病例,33% 被认定为可能病例。[518][Figure caption and citation for the preceding image starts]: 一名 32 岁男性横断面 CT 扫描显示,症状发作第 1 天右肺下叶胸膜附近毛玻璃样混浊和实变(上图),以及症状发作第 7 天双侧肺毛玻璃样混浊和实变Xu XW et al.BMJ.2020;368:m606 [Citation ends].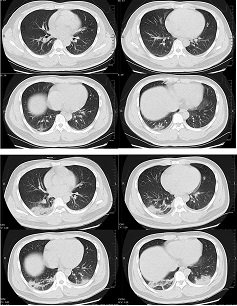
结果
毛玻璃样混浊,孤立性或与其他影像学发现(例如实变、小叶间间隔增厚或铺路石征)共存;双侧性、周边/胸膜下、混浊呈后分布,肺叶为主的特征较不明显
血清学
检查
不能用作急性感染的独立诊断方法;但可用于多种情境(例如分子检测阴性时、诊断延迟就诊或症状持续时间长的患者、用于血清抗体监测研究)[385][446]
BMJ practice pointer: testing for SARS-CoV-2 antibodies Opens in new window
对于强烈怀疑感染且 RT-PCR 结果阴性的患者,世界卫生组织(World Health Organization, WHO)建议采集配对血清样本,即在急性期和 2-4 周后的恢复期各采集一次样本。配对血清中出现血清转换或抗体滴度升高有助于确认感染为近期和/或急性感染。如果仅前一次样本的检测结果为阳性,这可能是因为感染为与当前疾病无关的既往感染。比起轻度感染或无症状感染患者,重症患者的血清转换会更快、程度会更大。[385]
美国疾病预防控制中心建议将血清学检测用作一种支持性诊断方法,用于在其他病毒检测方法(例如 RT-PCR、抗体检测)的基础上支持诊断延迟就诊(即症状发作 9-14 天后才就诊)的急性感染患者或就诊时伴有晚期并发症(例如儿童中的小儿炎性多系统综合征)。[447]
美国传染病学会推荐在以下情况中使用血清学检测:评估临床高度怀疑感染但诊断性分子检测为阴性且距症状发作至少 2 周的患者;评估儿童中的小儿炎性多系统综合征;血清抗体监测研究。[448]
SARS-CoV-2 的抗体反应通常发生于疾病前 1 至 3 周,IgG 抗体的血清转换时间常早于 IgM 抗体。[449][450]
抗体检测灵敏度估计为 18.4%-96.1%(报告的最低灵敏度来自即时检测,尽管一项实验室检查报告灵敏度 <50%),特异度为 88.9%-100%。在缺乏诊断或排除 COVID-19 的明确参考标准情况下,应谨慎解读对诊断准确性的估计。[435]
局限性:血清学检测无法用于确定急性感染;检测结果无法确定目前或既往是否存在感染;通常只有到了恢复期才可能得出可靠的诊断,而到那时已经错过了治疗或切断传播的机会;会与其他冠状病毒发生交叉反应,这可能导致假阳性结果。[385][447]
虽然快速抗体检测试剂盒已获批用于定性检测血清、血浆或全血中 SARS-CoV-2 IgG/IgM 抗体,但由于这些检测尚未得到验证,WHO 不推荐其在研究环境外使用。[452]
结果
SARS-CoV-2 病毒抗体阳性;配对血清中出现血清转换或抗体滴度升高
抗原检测
检查
快速诊断试验基于使用侧向流免疫测定法直接发现鼻拭子和其他呼吸道样本中的 SARS-CoV-2 病毒蛋白。通常能在 30 分钟内得到结果。虽然抗原检测的灵敏度明显低于 RT-PCR,但前者提供了一种在适当情况下以低廉的费用快速和早期发现大部分感染病例的可能性。如果要用这种方法,应在症状发作后 5-7 天内进行检测。世界卫生组织建议应仅在无法进行 RT-PCR 或较长的周转时间妨碍了临床实用性的特定情境中使用抗原检测,条件是与 RT-PCR 参考检测相比,达到灵敏度 ≥80%、特异度 ≥97% 这一最低效能要求。[454]
美国食品药品监督管理局警告称,抗原检测可能会导致假阳性结果,包括检测者不遵循试剂使用说明而产生假阳性结果,而且,假阳性检测结果数量会随着疾病患病率降低而增加。[455]
结果
SARS-CoV-2 病毒抗原呈阳性
新兴检查
逆转录环介导等温扩增(RT-LAMP)
肺部超声
检查
在某些中心,肺部超声被用作诊断工具,以替代胸部 X 线检查和胸部 CT。尽管只有确定性极低的证据支持其诊断准确性,但它作为补充或替代性影像检查方式,可有所帮助。[458]
具有诸多优点,包括便携、可床边评估、医务工作者暴露减少、消毒流程更便捷、无电离辐射暴露,以及随访期间的可重复性。资源受限环境中,它也可能更易使用。但是,它亦有某些局限性(例如无法分辨病变是否为长期慢性),因此可能需要结合其他影像学检查。
B 线是 COVID-19 患者主要表现,汇总出现频率为 97%。胸膜线异常也很常见,汇总出现频率为 70%。尽管此类发现并非 COVID-19 特异性表现,但在特征性临床表现背景下,它们增加了疾病诊断的可能性。其他发现包括实变、胸膜增厚和胸腔积液。[473]
BSTI: lung ultrasound (LUS) for COVID-19 patients in critical care areas Opens in new window
结果
B 线;胸膜线异常
内容使用需遵循免责声明
