正埃博拉病毒属于丝状病毒科(正埃博拉病毒属;单股负链病毒目)这些病毒拥有细长丝状结构且长度不一。[Figure caption and citation for the preceding image starts]: 透射电子显微镜图像显示的埃博拉病毒粒子的一些超微结构美国疾病预防控制中心 (Centers for Disease Control and Prevention) [Citation ends].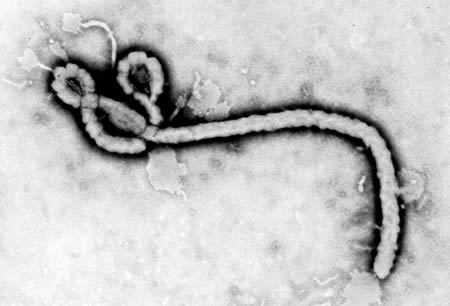
该病毒被认为最初是从接触感染动物(例如蝙蝠和非人灵长类动物)的体液或组织接触过程中获得的;然而尚未明确自然宿主和传播至人类的方式。[38]Peters CJ, LeDuc JW. An introduction to Ebola: the virus and the disease. J Infect Dis. 1999 Feb;179 Suppl 1:ix-xvi.
https://jid.oxfordjournals.org/content/179/Supplement_1/ix.full.pdf+html
http://www.ncbi.nlm.nih.gov/pubmed/9988154?tool=bestpractice.com
关于储备能力 (reservoir competence) 的实验室检查表明,蝙蝠和啮齿动物的感染有可能成功,但是植物或节肢动物的感染不可能成功。[39]Swanepoel R, Leman PA, Burt FJ, et al. Experimental inoculation of plants and animals with Ebola virus. Emerg Infect Dis. Oct-Dec 1996;2(4):321-5.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2639914/pdf/8969248.pdf
http://www.ncbi.nlm.nih.gov/pubmed/8969248?tool=bestpractice.com
[40]Reiter P, Turell M, Coleman R, et al. Field investigations of an outbreak of Ebola hemorrhagic fever, Kikwit, Democratic Republic of the Congo, 1995: arthropod studies. J Infect Dis. 1999 Feb;179 Suppl 1:S148-54.
https://jid.oxfordjournals.org/content/179/Supplement_1/S148.long
http://www.ncbi.nlm.nih.gov/pubmed/9988178?tool=bestpractice.com
[41]Pigott DM, Golding N, Mylne A, et al. Mapping the zoonotic niche of Ebola virus disease in Africa. Elife. 2014 Sep 8;3:e04395.
https://elifesciences.org/content/3/e04395
http://www.ncbi.nlm.nih.gov/pubmed/25201877?tool=bestpractice.com
在狩猎和摄入宿主物种或感染的非人类灵长类动物过程中,可能会发生动物与人之间的传播。吃受到蝙蝠粪便(3 种栖息在树上的蝙蝠已被描述为宿主)污染的灌木丛动物肉或食物的地方风俗也被认为有助于导致感染。
[Figure caption and citation for the preceding image starts]: 埃博拉病毒生态学显示地方性动物病和地方性动物病流行周期美国疾病预防控制中心 (Centers for Disease Control and Prevention) [Citation ends].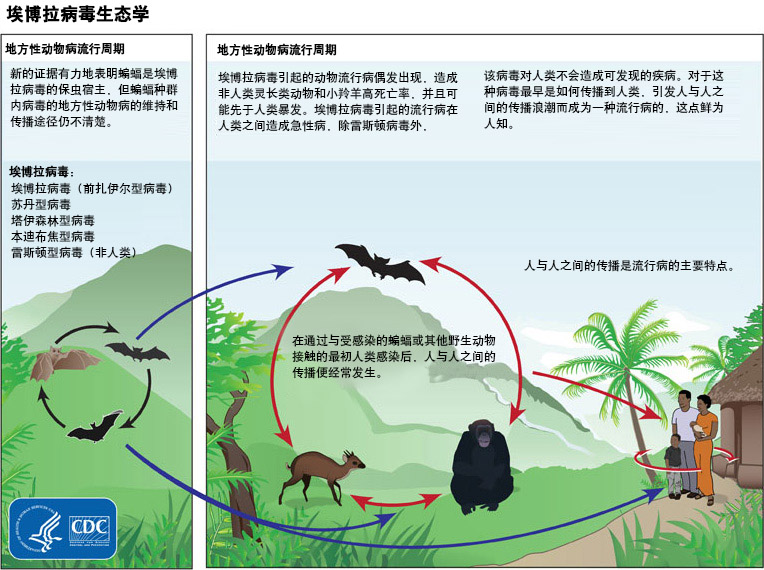
人际传播通过直接接触感染者的体液或感染者体液污染的物品而发生。[42]Dowell SF, Mukunu R, Ksiazek TG, et al. Transmission of Ebola hemorrhagic fever: a study of risk factors in family members, Kikwit, Democratic Republic of the Congo, 1995. Commission de Lutte contre les Epidémies à Kikwit. J Infect Dis. 1999 Feb;179 Suppl 1:S87-91.
https://jid.oxfordjournals.org/content/179/Supplement_1/S87.long
http://www.ncbi.nlm.nih.gov/pubmed/9988169?tool=bestpractice.com
[43]Bausch DG, Towner JS, Dowell SF, et al. Assessment of the risk of Ebola virus transmission from bodily fluids and fomites. J Infect Dis. 2007 Nov 15;196 Suppl 2:S142-7.
https://jid.oxfordjournals.org/content/196/Supplement_2/S142.long
http://www.ncbi.nlm.nih.gov/pubmed/17940942?tool=bestpractice.com
在早期流行病暴发期间,许多医疗护理相关性传播可归因于非灭菌注射剂的重复使用。[24]Report of an International Commission. Ebola haemorrhagic fever in Zaire, 1976. Bull World Health Organ. 1978;56(2):271-93.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2395567/pdf/bullwho00439-0113.pdf
http://www.ncbi.nlm.nih.gov/pubmed/307456?tool=bestpractice.com
虽然这仍然存在风险,但大多数病例均由密切身体接触或接触感染患者体液(例如汗液、血液、粪便、呕吐物、唾液、生殖器分泌物 [包括精液]、羊水和母乳)导致。
血液中的病毒水平随病程而增加,患者在疾病较后期(即,出现腹泻、呕吐和出血症状期间)最具传染性。[44]Osterholm MT, Moore KA, Kelley NS, et al. Transmission of Ebola viruses: what we know and what we do not know. MBio. 2015 Feb 19;6(2):e00137.
https://mbio.asm.org/content/6/2/e00137-15.full
http://www.ncbi.nlm.nih.gov/pubmed/25698835?tool=bestpractice.com
大量病毒可见于皮肤中,由于汗液也可能含有病毒,触摸感染患者可能导致疾病传播。[45]Kreuels B, Wichmann D, Emmerich P, et al. A case of severe Ebola virus infection complicated by gram-negative septicemia. N Engl J Med. 2014 Dec 18;371(25):2394-401.
https://www.nejm.org/doi/full/10.1056/NEJMoa1411677#t=article
http://www.ncbi.nlm.nih.gov/pubmed/25337633?tool=bestpractice.com
社区中的超级传播事件也日益被视为一个促进因素:2015 年塞拉利昂一位传统治疗师的葬礼就与 300 例感染相关。[46]World Health Organization. Sierra Leone: a traditional healer and a funeral. 2015 [internet publication].
https://www.who.int/news/item/01-09-2015-sierra-leone-a-traditional-healer-and-a-funeral
一项研究显示,在 2014 年暴发中,超级传播者造成约 61% 的感染。[47]Lau MS, Dalziel BD, Funk S, et al. Spatial and temporal dynamics of superspreading events in the 2014-2015 West Africa Ebola epidemic. Proc Natl Acad Sci U S A. 2017 Feb 28;114(9):2337-42.
https://www.pnas.org/content/114/9/2337.long
http://www.ncbi.nlm.nih.gov/pubmed/28193880?tool=bestpractice.com
一项旨在确定各种体液病毒脱落率的研究表明,在发病之后长达 40 日内,可从唾液、乳汁、粪便、眼泪和精液中分离出埃博拉病毒。[43]Bausch DG, Towner JS, Dowell SF, et al. Assessment of the risk of Ebola virus transmission from bodily fluids and fomites. J Infect Dis. 2007 Nov 15;196 Suppl 2:S142-7.
https://jid.oxfordjournals.org/content/196/Supplement_2/S142.long
http://www.ncbi.nlm.nih.gov/pubmed/17940942?tool=bestpractice.com
[48]Emond RT, Evans B, Bowen ET, et al. A case of Ebola virus infection. Br Med J. 11977 Aug 27;2(6086):541-4.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1631428/pdf/brmedj00478-0011.pdf
http://www.ncbi.nlm.nih.gov/pubmed/890413?tool=bestpractice.com
[49]Rowe AK, Bertolli J, Khan AS, et al. Clinical, virologic, and immunologic follow-up of convalescent Ebola hemorrhagic fever patients and their household contacts, Kikwit, Democratic Republic of the Congo. Commission de Lutte contre les Epidémies à Kikwit. J Infect Dis. 1999 Feb;179 Suppl 1:S28-35.
http://www.ncbi.nlm.nih.gov/pubmed/9988162?tool=bestpractice.com
在感染康复 12 个月后,仍可在精液中检测到该病毒,这可能是由于睾丸组织是一个免疫保护部位。[50]World Health Organization. Clinical care for survivors of Ebola virus disease: interim guidance. Apr 2016 [internet publication].
https://apps.who.int/iris/handle/10665/204235
这意味着感染消退后仍可能长时间存在性传播风险,并且在 2014 年疫情暴发期间和之后有此类病例确诊。[43]Bausch DG, Towner JS, Dowell SF, et al. Assessment of the risk of Ebola virus transmission from bodily fluids and fomites. J Infect Dis. 2007 Nov 15;196 Suppl 2:S142-7.
https://jid.oxfordjournals.org/content/196/Supplement_2/S142.long
http://www.ncbi.nlm.nih.gov/pubmed/17940942?tool=bestpractice.com
[48]Emond RT, Evans B, Bowen ET, et al. A case of Ebola virus infection. Br Med J. 11977 Aug 27;2(6086):541-4.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC1631428/pdf/brmedj00478-0011.pdf
http://www.ncbi.nlm.nih.gov/pubmed/890413?tool=bestpractice.com
[49]Rowe AK, Bertolli J, Khan AS, et al. Clinical, virologic, and immunologic follow-up of convalescent Ebola hemorrhagic fever patients and their household contacts, Kikwit, Democratic Republic of the Congo. Commission de Lutte contre les Epidémies à Kikwit. J Infect Dis. 1999 Feb;179 Suppl 1:S28-35.
http://www.ncbi.nlm.nih.gov/pubmed/9988162?tool=bestpractice.com
[51]Rogstad KE, Tunbridge A. Ebola virus as sexually transmitted infection. Curr Opin Infect Dis. 2015 Feb;28(1):83-5.
http://www.ncbi.nlm.nih.gov/pubmed/25501666?tool=bestpractice.com
[52]Sonnenberg P, Field P. Sexual and mother-to-child transmission of Ebola virus in the post-convalescent period. Clin Infect Dis. 2015 Mar 15;60(6):974-5.
http://www.ncbi.nlm.nih.gov/pubmed/25501984?tool=bestpractice.com
[53]Mate SE, Kugelman JR, Nyenswah TG, et al. Molecular evidence of sexual transmission of Ebola virus. N Engl J Med. 2015 Dec 17;373(25):2448-54.
https://www.nejm.org/doi/full/10.1056/NEJMoa1509773#t=article
http://www.ncbi.nlm.nih.gov/pubmed/26465384?tool=bestpractice.com
[54]Crozier I. Ebola virus RNA in the semen of male survivors of Ebola virus disease: the uncertain gravitas of a privileged persistence. J Infect Dis. 2016 Nov 15;214(10):1467-9.
https://jid.oxfordjournals.org/content/early/2016/05/03/infdis.jiw079.long
http://www.ncbi.nlm.nih.gov/pubmed/27142203?tool=bestpractice.com
[55]Thorson A, Formenty P, Lofthouse C, et al. Systematic review of the literature on viral persistence and sexual transmission from recovered Ebola survivors: evidence and recommendations. BMJ Open. 2016 Jan 7;6(1):e008859.
https://bmjopen.bmj.com/content/6/1/e008859
http://www.ncbi.nlm.nih.gov/pubmed/26743699?tool=bestpractice.com
在阴道分泌物中也检出了该病毒。[56]Rodriguez LL, De Roo A, Guimard Y, et al. Persistence and genetic stability of Ebola virus during the outbreak in Kikwit, Democratic Republic of the Congo, 1995. J Infect Dis. 1999 Feb;179 Suppl 1:S170-6.
https://jid.oxfordjournals.org/content/179/Supplement_1/S170.long
http://www.ncbi.nlm.nih.gov/pubmed/9988181?tool=bestpractice.com
其他免疫保护部位包括眼内部、胎盘和中枢神经系统,特别是脑脊液。[57]Centers for Disease Control and Prevention. Caring for Ebola disease survivors in the US. Apr 2024 [internet publication].
https://www.cdc.gov/ebola/hcp/management-of-survivors/index.html
可继续从尿液和汗液排出病毒。以一名德国的康复患者为例,在其血清未检出病毒后 14 日仍在尿液中检出病毒,并且在血清未检出病毒后长达 19 日仍在汗液检出病毒。[45]Kreuels B, Wichmann D, Emmerich P, et al. A case of severe Ebola virus infection complicated by gram-negative septicemia. N Engl J Med. 2014 Dec 18;371(25):2394-401.
https://www.nejm.org/doi/full/10.1056/NEJMoa1411677#t=article
http://www.ncbi.nlm.nih.gov/pubmed/25337633?tool=bestpractice.com
有证据表明,非人灵长类动物有可能经由吸入途径感染;然而,没有证据表明人类会经由空气传播感染。[14]Mahanty S, Bray M. Pathogenesis of filoviral haemorrhagic fevers. Lancet Infect Dis. 2004 Aug;4(8):487-98.
https://www.thelancet.com/journals/laninf/article/PIIS1473-3099(04)01103-X/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/15288821?tool=bestpractice.com
[58]Judson S, Prescott J, Munster V. Understanding Ebola virus transmission. Viruses. 2015 Feb 3;7(2):511-21.
https://www.mdpi.com/1999-4915/7/2/511/htm
http://www.ncbi.nlm.nih.gov/pubmed/25654239?tool=bestpractice.com
在剧烈呕吐(类似于诺如病毒感染表现)期间,以及进行危重症诊疗干预相关的可产生气溶胶操作期间,仍应考虑病毒发生机会性空气传播的可能性。
在非疫区,埃博拉病毒病较罕见,且通常为输入性感染。[59]Beeching NJ, Fletcher TE, Hill DR, et al. Travellers and viral haemorrhagic fevers: what are the risks? Int J Antimicrob Agents. 2010 Nov;36 Suppl 1:S26-35.
https://www.ijaaonline.com/article/S0924-8579(10)00258-X/fulltext
http://www.ncbi.nlm.nih.gov/pubmed/20705436?tool=bestpractice.com
从疫区来的旅行者、实验室科学家以及与工作中与潜在感染材料和动物接触的其他人员是高危易感人群。


