The World Health Organization (WHO) was informed of cases of pneumonia of unknown microbial etiology associated with Wuhan City, Hubei Province, China on 31 December 2019. The WHO later announced that a novel coronavirus had been detected in samples taken from these patients. Since then, the epidemic escalated and rapidly spread around the world, with the WHO first declaring a public health emergency of international concern (PHEIC) on 30 January 2020, and then formally declaring it a pandemic on 11 March 2020. The WHO declared that COVID-19 no longer constitutes a PHEIC in May 2023.
Cases have been reported across all continents since the beginning of the pandemic, with over 777 million confirmed cases and over 7 million deaths reported globally.[17]World Health Organization. Coronavirus disease (COVID-19) epidemiological updates and monthly operational updates. Mar 2025 [internet publication].
https://www.who.int/emergencies/diseases/novel-coronavirus-2019/situation-reports
[Figure caption and citation for the preceding image starts]: Number of COVID-19 cases reported weekly by WHO Region, and global deaths, as of 2 February 2025World Health Organization [Citation ends].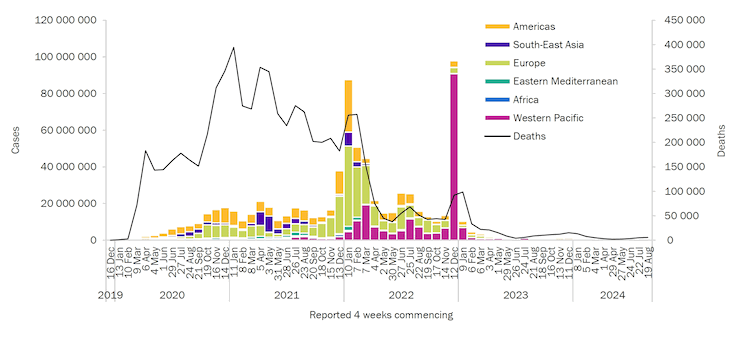
Updated case counts are available from the WHO and the Centers for Disease Control and Prevention (CDC):
Older people age ≥70 years and males are at increased risk for infection and severe disease.[18]Pijls BG, Jolani S, Atherley A, et al. Demographic risk factors for COVID-19 infection, severity, ICU admission and death: a meta-analysis of 59 studies. BMJ Open. 2021 Jan 11;11(1):e044640.
https://bmjopen.bmj.com/content/11/1/e044640.long
http://www.ncbi.nlm.nih.gov/pubmed/33431495?tool=bestpractice.com
Adolescents appear to have similar susceptibility to infection as adults, and children have a lower susceptibility. However, evidence is conflicting.[19]Viner RM, Mytton OT, Bonell C, et al. Susceptibility to SARS-CoV-2 infection among children and adolescents compared with adults: a systematic review and meta-analysis. JAMA Pediatr. 2021 Feb 1;175(2):143-56.
https://jamanetwork.com/journals/jamapediatrics/fullarticle/2771181
http://www.ncbi.nlm.nih.gov/pubmed/32975552?tool=bestpractice.com
[20]World Health Organization. COVID-19 disease in children and adolescents: scientific brief, 29 September 2021. Sep 2021 [internet publication].
https://www.who.int/publications/i/item/WHO-2019-nCoV-Sci_Brief-Children_and_adolescents-2021.1
Unlike adults, children do not seem to be at higher risk for severe disease based on age or sex.[21]Castagnoli R, Votto M, Licari A, et al. Severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) infection in children and adolescents: a systematic review. JAMA Pediatr. 2020 Sep 1;174(9):882-9.
https://jamanetwork.com/journals/jamapediatrics/fullarticle/2765169
http://www.ncbi.nlm.nih.gov/pubmed/32320004?tool=bestpractice.com
Variants may have spread more effectively and rapidly among young children compared with the wild-type virus, although hospitalization rates decreased.[22]Somekh I, Stein M, Karakis I, et al. Characteristics of SARS-CoV-2 infections in Israeli children during the circulation of different SARS-CoV-2 variants. JAMA Netw Open. 2021 Sep 1;4(9):e2124343.
https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2783851
http://www.ncbi.nlm.nih.gov/pubmed/34491353?tool=bestpractice.com
[23]Chen F, Tian Y, Zhang L, et al. The role of children in household transmission of COVID-19: a systematic review and meta-analysis. Int J Infect Dis. 2022 May 11;122:266-75.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC9091150
http://www.ncbi.nlm.nih.gov/pubmed/35562045?tool=bestpractice.com
The incidence of infection in healthcare workers ranged from 0% to 49.6%, and the prevalence of seropositivity ranged from 1.6% to 31.6%. There was no association between age, sex, or healthcare worker role (i.e., nurse versus physician) and the risk for infection, based on moderate-certainty evidence. There was an association between black race or Hispanic ethnicity and increased risk for infection in healthcare workers compared with white race or non-Hispanic ethnicity, based on moderate-certainty evidence. There was an association between use of personal protective equipment and decreased risk for infection, based on moderate-certainty evidence.[24]Chou R, Dana T, Buckley DI, et al. Epidemiology of and risk factors for coronavirus infection in health care workers: a living rapid review. Ann Intern Med. 2020 Jul 21;173(2):120-36.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7240841
http://www.ncbi.nlm.nih.gov/pubmed/32369541?tool=bestpractice.com
[25]Chou R, Dana T, Buckley DI, et al. Update alert 11: epidemiology of and risk factors for coronavirus infection in health care workers. Ann Intern Med. 2022 Aug;175(8):W83-4.
https://www.acpjournals.org/doi/10.7326/L22-0235
http://www.ncbi.nlm.nih.gov/pubmed/35816711?tool=bestpractice.com

