Resumo
Definição
História e exame físico
Principais fatores diagnósticos
- presença de fatores de risco
- pletora facial
- preenchimento supraclavicular
- estrias violáceas
- ausência de gestação
- irregularidades menstruais
- ausência de desnutrição
- ausência de alcoolismo
- ausência de estresse fisiológico
- desaceleração do crescimento linear em crianças
Outros fatores diagnósticos
- sexo feminino
- hipertensão
- intolerância à glicose ou diabetes mellitus
- osteoporose prematura ou fraturas não explicadas
- ganho de peso e obesidade central
- acne
- sintomas psiquiátricos
- diminuição da libido
- facilidade de formação de hematomas
- fraqueza
- arredondamento facial
- adiposidade na região dorsocervical
- nefrolitíase inexplicada
- evento venotrombólico
- hirsutismo
Fatores de risco
- uso de corticosteroide exógeno
- adenoma hipofisário
- adenoma adrenal
- carcinoma adrenal
- tumores neuroendócrinos
- carcinoma torácico ou broncogênico
Investigações diagnósticas
Primeiras investigações a serem solicitadas
- teste de gravidez na urina
- glicose sérica
- cortisol salivar noturno
- teste de supressão noturna com dexametasona 1 mg
- cortisol urinário livre de 24 horas
- teste de supressão com dexametasona 2 mg (baixa dose) por 48 horas
Investigações a serem consideradas
- hormônio adrenocorticotrófico (ACTH) plasmático matinal
- nível de sulfato de prasterona (DHEA-S) plasmático
- ressonância nuclear magnética (RNM) da hipófise
- imagem adrenal
- teste de supressão com dexametasona de alta dose
- amostra de sangue dos seios petrosos inferiores
- TC do tórax, abdome e pelve
- ressonância nuclear magnética (RNM) do tórax
- exame com octreotida
- PET/TC com gálio (Ga)-68 DOTATATE
Algoritmo de tratamento
Doença de Cushing (tumor hipofisário secretor de hormônio adrenocorticotrófico [ACTH])
síndrome de secreção ectópica do hormônio adrenocorticotrópico (ACTH) ou do hormônio liberador de corticotropina (CRH)
independente de hormônio adrenocorticotrópico (ACTH) devido a carcinoma ou adenoma adrenal unilateral
independente de hormônio adrenocorticotrópico (ACTH) devido a doença adrenal bilateral (hiperplasia ou adenoma)
secreção autônoma leve de cortisol (anteriormente conhecida como síndrome de Cushing subclínica)
Colaboradores
Autores
Maria Fleseriu, MD, FACE
Professor of Medicine (Endocrinology) and Neurological Surgery
Director
Pituitary Center
Oregon Health & Science University
Portland
OR
Declarações
MF is on the Endocrine Society's Board of Directors. She holds a research grant to the university for clinical studies as principal investigator for Crinetics and Sparrow Pharmaceuticals, and is an occasional scientific consultant for Crinetics, Recordati, Sparrow Pharmaceuticals, and Xeris Pharmaceuticals. MF is an author of several references cited in this topic.
Agradecimentos
Dr Maria Fleseriu would like to gratefully acknowledge Dr Ty Carroll and Dr James Findling, contributors to a previous version of this topic.
Declarações
TC is an author of a number of references cited in this topic. He is an investigator in clinical trials sponsored by Corcept. JF is an author of a number of references cited in this topic. He is a consultant for, and investigator in, clinical trials sponsored by Corcept and Novartis.
Revisores
Paul M. Stewart, FRCP FMedSci
Professor of Medicine
Director of Research
College of Medical and Dental Sciences
University of Birmingham
Honorary Consultant Physician
Queen Elizabeth Hospital
Birmingham
UK
Divulgaciones
PMS declares that he has no competing interests.
Antoine Tabarin, MD
Head
Department of Endocrinology
University Hospital of Bordeaux
Pessac
France
Divulgaciones
AT declares that he has no competing interests.
Liliana Contrersas, MD
Chief
Endocrine Research Department
Instituto de Investigaciones Médicas A. Lanari
University of Buenos Aires and IDIM-CONICET
Buenos Aires
Argentina
Divulgaciones
LC declares that she has no competing interests.
Philip R. Orlander, MD
Professor of Medicine
Director
Division of Endocrinology, Diabetes & Metabolism
University of Texas Medical School
Houston
TX
Divulgaciones
PRO declares that he has no competing interests.
Mouhammed Amir Habra, MD, FACP, FACE
Assistant Professor
Department of Endocrine Neoplasia and Hormonal Disorders
Division of Internal Medicine
University of Texas MD Anderson Cancer Center
Houston
TX
Divulgaciones
MAH declares that he has no competing interests.
Agradecimiento de los revisores por pares
Los temas de BMJ Best Practice se actualizan de forma continua de acuerdo con los desarrollos en la evidencia y en las guías. Los revisores por pares listados aquí han revisado el contenido al menos una vez durante la historia del tema.
Divulgaciones
Las afiliaciones y divulgaciones de los revisores por pares se refieren al momento de la revisión.
Referencias
Artículos principales
Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.Texto completo Resumen
Nieman LK, Biller BM, Findling JW, et al. Treatment of Cushing’s syndrome: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2015 Aug;100(8):2807-31.Texto completo Resumen
Feelders RA, Newell-Price J, Pivonello R, et al. Advances in the medical treatment of Cushing's syndrome. Lancet Diabetes Endocrinol. 2019 Apr;7(4):300-12. Resumen
Artículos de referencia
Una lista completa de las fuentes a las que se hace referencia en este tema está disponible para los usuarios con acceso a todo BMJ Best Practice.
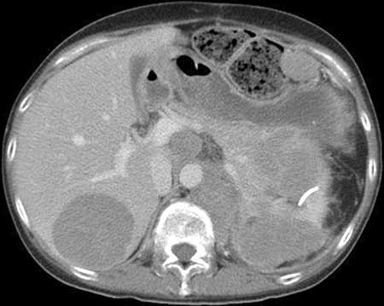
Diferenciales
- Obesidade
- Síndrome metabólica
- Aldosteronismo primário
Más DiferencialesGuías de práctica clínica
- NCCN clinical practice guidelines in oncology: neuroendocrine and adrenal tumors
- Clinical practice guideline on the management of adrenal incidentalomas
Más Guías de práctica clínicaFolletos para el paciente
Diabetes do tipo 2: devo tomar insulina?
Diabetes: o que posso fazer para me manter saudável?
Más Folletos para el pacienteInicie sesión o suscríbase para acceder a todo el BMJ Best Practice
El uso de este contenido está sujeto a nuestra cláusula de exención de responsabilidad