Summary
Definition
History and exam
Key diagnostic factors
- presença de fatores de risco
- pletora facial
- preenchimento supraclavicular
- estrias violáceas
- ausência de gestação
- irregularidades menstruais
- ausência de desnutrição
- ausência de alcoolismo
- ausência de estresse fisiológico
- desaceleração do crescimento linear em crianças
Other diagnostic factors
- sexo feminino
- hipertensão
- intolerância à glicose ou diabetes mellitus
- osteoporose prematura ou fraturas não explicadas
- ganho de peso e obesidade central
- acne
- sintomas psiquiátricos
- diminuição da libido
- facilidade de formação de hematomas
- fraqueza
- arredondamento facial
- adiposidade na região dorsocervical
- nefrolitíase inexplicada
- evento venotrombólico
- hirsutismo
Risk factors
- uso de corticosteroide exógeno
- adenoma hipofisário
- adenoma adrenal
- carcinoma adrenal
- tumores neuroendócrinos
- carcinoma torácico ou broncogênico
Diagnostic tests
1st tests to order
- teste de gravidez na urina
- glicose sérica
- cortisol salivar noturno
- teste de supressão noturna com dexametasona 1 mg
- cortisol urinário livre de 24 horas
- teste de supressão com dexametasona 2 mg (baixa dose) por 48 horas
Tests to consider
- hormônio adrenocorticotrófico (ACTH) plasmático matinal
- nível de sulfato de prasterona (DHEA-S) plasmático
- ressonância nuclear magnética (RNM) da hipófise
- imagem adrenal
- teste de supressão com dexametasona de alta dose
- amostra de sangue dos seios petrosos inferiores
- TC do tórax, abdome e pelve
- ressonância nuclear magnética (RNM) do tórax
- exame com octreotida
- PET/TC com gálio (Ga)-68 DOTATATE
Treatment algorithm
Doença de Cushing (tumor hipofisário secretor de hormônio adrenocorticotrófico [ACTH])
síndrome de secreção ectópica do hormônio adrenocorticotrópico (ACTH) ou do hormônio liberador de corticotropina (CRH)
independente de hormônio adrenocorticotrópico (ACTH) devido a carcinoma ou adenoma adrenal unilateral
independente de hormônio adrenocorticotrópico (ACTH) devido a doença adrenal bilateral (hiperplasia ou adenoma)
secreção autônoma leve de cortisol (anteriormente conhecida como síndrome de Cushing subclínica)
Contributors
Authors
Maria Fleseriu, MD, FACE
Professor of Medicine (Endocrinology) and Neurological Surgery
Director
Pituitary Center
Oregon Health & Science University
Portland
OR
Divulgaciones
MF is on the Endocrine Society's Board of Directors. She holds a research grant to the university for clinical studies as principal investigator for Crinetics and Sparrow Pharmaceuticals, and is an occasional scientific consultant for Crinetics, Recordati, Sparrow Pharmaceuticals, and Xeris Pharmaceuticals. MF is an author of several references cited in this topic.
Agradecimientos
Dr Maria Fleseriu would like to gratefully acknowledge Dr Ty Carroll and Dr James Findling, contributors to a previous version of this topic.
Divulgaciones
TC is an author of a number of references cited in this topic. He is an investigator in clinical trials sponsored by Corcept. JF is an author of a number of references cited in this topic. He is a consultant for, and investigator in, clinical trials sponsored by Corcept and Novartis.
Revisores por pares
Paul M. Stewart, FRCP FMedSci
Professor of Medicine
Director of Research
College of Medical and Dental Sciences
University of Birmingham
Honorary Consultant Physician
Queen Elizabeth Hospital
Birmingham
UK
Divulgaciones
PMS declares that he has no competing interests.
Antoine Tabarin, MD
Head
Department of Endocrinology
University Hospital of Bordeaux
Pessac
France
Divulgaciones
AT declares that he has no competing interests.
Liliana Contrersas, MD
Chief
Endocrine Research Department
Instituto de Investigaciones Médicas A. Lanari
University of Buenos Aires and IDIM-CONICET
Buenos Aires
Argentina
Divulgaciones
LC declares that she has no competing interests.
Philip R. Orlander, MD
Professor of Medicine
Director
Division of Endocrinology, Diabetes & Metabolism
University of Texas Medical School
Houston
TX
Divulgaciones
PRO declares that he has no competing interests.
Mouhammed Amir Habra, MD, FACP, FACE
Assistant Professor
Department of Endocrine Neoplasia and Hormonal Disorders
Division of Internal Medicine
University of Texas MD Anderson Cancer Center
Houston
TX
Declarações
MAH declares that he has no competing interests.
Créditos aos pareceristas
Os tópicos do BMJ Best Practice são constantemente atualizados, seguindo os desenvolvimentos das evidências e das diretrizes. Os pareceristas aqui listados revisaram o conteúdo pelo menos uma vez durante a história do tópico.
Declarações
As afiliações e declarações dos pareceristas referem--se ao momento da revisão.
Referências
Principais artigos
Fleseriu M, Auchus R, Bancos I, et al. Consensus on diagnosis and management of Cushing's disease: a guideline update. Lancet Diabetes Endocrinol. 2021 Dec;9(12):847-75.Texto completo Resumo
Nieman LK, Biller BM, Findling JW, et al. Treatment of Cushing’s syndrome: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2015 Aug;100(8):2807-31.Texto completo Resumo
Feelders RA, Newell-Price J, Pivonello R, et al. Advances in the medical treatment of Cushing's syndrome. Lancet Diabetes Endocrinol. 2019 Apr;7(4):300-12. Resumo
Artigos de referência
Uma lista completa das fontes referenciadas neste tópico está disponível para os usuários com acesso total ao BMJ Best Practice.
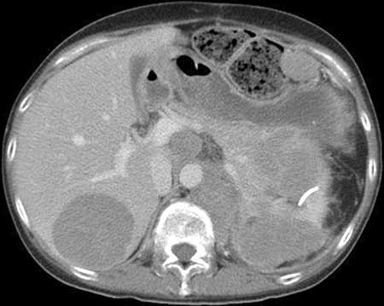
Diagnósticos diferenciais
- Obesidade
- Síndrome metabólica
- Aldosteronismo primário
Mais Diagnósticos diferenciaisDiretrizes
- NCCN clinical practice guidelines in oncology: neuroendocrine and adrenal tumors
- Clinical practice guideline on the management of adrenal incidentalomas
Mais DiretrizesFolhetos informativos para os pacientes
Diabetes do tipo 2: devo tomar insulina?
Diabetes: o que posso fazer para me manter saudável?
Mais Folhetos informativos para os pacientesConectar-se ou assinar para acessar todo o BMJ Best Practice
O uso deste conteúdo está sujeito ao nosso aviso legal