Summary
Definition
History and exam
Key diagnostic factors
- presencia de factores de riesgo
- sangrado rectal
- diarrea
- sangre en las heces
Other diagnostic factors
- dolor abdominal
- artritis y espondilitis
- desnutrición
- abdomen doloroso a la palpación
- fiebre
- pérdida de peso
- estreñimiento
- erupción cutánea
- uveítis y epiescleritis
- palidez
Risk factors
- antecedentes familiares de enfermedad inflamatoria intestinal
- antígeno leucocitario humano-B27
- infección
- uso de fármacos antiinflamatorios no esteroideos (AINE)
- no fumar o ser un exfumador
Diagnostic tests
1st tests to order
- estudios de heces para patógenos infecciosos
- calprotectina fecal (CF)
- hemograma completo (HC)
- perfil metabólico completo (incluidas las pruebas de función hepática [PFH])
- velocidad de sedimentación globular (VSG)
- proteína C-reactiva
- radiografía simple de abdomen
- sigmoidoscopia flexible
- colonoscopia
- biopsias
Tests to consider
- exploración por tomografía computarizada (TC)
- ecografía intestinal
Treatment algorithm
colitis ulcerosa aguda grave
enfermedad moderada a grave:
enfermedad leve
enfermedad en remisión
Contributors
Authors
Andrew Poullis, BSc, MBBS, MD, FRCP
Consultant Gastroenterologist
Department of Gastroenterology
St George’s Hospital
London
UK
Disclosures
AP is an author of a reference cited in this topic.
Sailish Honap,
Consultant Gastroenterologist
Department of Gastroenterology
St George’s Hospital
London
UK
Disclosures
SH has received honoraria from Pfizer (speaker, consultant, advisory board member, and received travel grants), Janssen (speaker fees, travel grants), AbbVie (speaker fees, consultant, travel grants), Takeda (speaker fees), Ferring (travel grants), Pharmacosmos (travel grants), Galapagos (travel grants).
Kamal Patel,
Disclosures
all disclosures
Aaron Bhakta, BMedSci (Hons), BMBS, MSc, MRCP
Clinical Fellow in Gastroenterology
Department of Gastroenterology
St George’s Hospital
London
UK
Disclosures
AB declares that he has no competing interests.
Acknowledgements
Dr Hesam A. Nooredinvand, and Dr Andrew Poullis would like to gratefully acknowledge Dr Ben Shandro, Dr Anet Soubieres, Dr Rhys Hewett, Dr Willem J.S. de Villiers, and Dr Houssam Mardini, previous contributors to this topic.
Disclosures
BS, AS, RH, WJSD, and HM declare that they have no competing interests.
Peer reviewers
Trevor Winter, MD, PhD
Associate Professor of Medicine
Division of Digestive Diseases and Nutrition
University of Kentucky
Lexington
KY
Disclosures
TW declares that he has no competing interests.
Sharon Stein, MD
Assistant Professor of Surgery
Division of Colon and Rectal Surgery
University Hospital Case Medical Center
Cleveland
OH
Disclosures
SS received a fee for educational courses on laparoscopic surgery, paid for in part by Covidien, Olympus, and Applied Medical.
Peer reviewer acknowledgements
BMJ Best Practice topics are updated on a rolling basis in line with developments in evidence and guidance. The peer reviewers listed here have reviewed the content at least once during the history of the topic.
Disclosures
Peer reviewer affiliations and disclosures pertain to the time of the review.
References
Key articles
World Gastroenterology Organisation. Global guidelines: inflammatory bowel disease. Aug 2015 [internet publication].Full text
Rubin DT, Ananthakrishnan AN, Siegel CA, et al. ACG clinical guideline: ulcerative colitis in adults. Am J Gastroenterol. 2019 Mar;114(3):384-413. Abstract
Feuerstein JD, Isaacs KL, Schneider Y, et al. AGA clinical practice guidelines on the management of moderate to severe ulcerative colitis. Gastroenterology. 2020 Apr;158(5):1450-61.Full text Abstract
Harbord M, Eliakim R, Bettenworth D, et al. Third European evidence-based consensus on diagnosis and management of ulcerative colitis. Part 2: current management. J Crohns Colitis. 2017 Jul 1;11(7):769-84.Full text Abstract
National Institute for Health and Care Excellence (UK). Ulcerative colitis: management. May 2019 [internet publication].Full text
National Institute for Health and Care Excellence. Colorectal cancer prevention: colonoscopic surveillance in adults with ulcerative colitis, Crohn's disease or adenomas. Sep 2022 [internet publication].Full text
Reference articles
A full list of sources referenced in this topic is available to users with access to all of BMJ Best Practice.
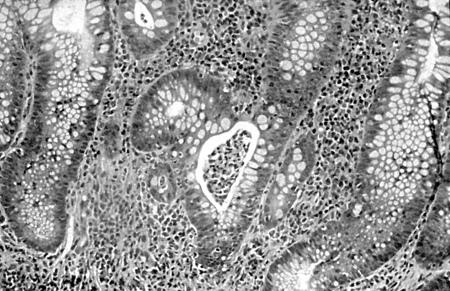
Differentials
- Enfermedad de Crohn
- Colitis indeterminada
- Colitis por radiación
More DifferentialsGuidelines
- Clinical nutrition in inflammatory bowel disease
- Management of moderate to severe ulcerative colitis
More GuidelinesPatient information
Colitis ulcerosa: ¿qué es?
Colitis ulcerosa: ¿qué tratamientos funcionan?
More Patient informationVideos
Demostración animada de venopunción y flebotomía
More videosLog in or subscribe to access all of BMJ Best Practice
Use of this content is subject to our disclaimer